改良无辅助切口完全腹腔镜全直肠系膜切除术治疗直肠癌的疗效
2019-02-23李瑞生段红艳
李瑞生 胡 滨 张 富 段红艳
(河北省玉田县医院普外科,玉田 064100)
直肠癌治疗主要以手术为主,开腹手术创伤大,术后恢复差,对患者损伤较大[1]。随着腹腔镜技术的不断发展,腹腔镜直肠癌手术的疗效与可行性已被认可,并广泛应用于临床[2]。目前,常用的手术方式是腹腔镜直肠癌全直肠系膜切除术,为能够将吻合器钉座置入直肠,需要在腹部上做1个辅助切口,从此切口完成标本的取出并进行吻合,因此,并不能算真正意义上的全腹腔镜技术,且患者术后疼痛、切口感染、切口疝等并发症发生率高,影响治疗效果,增加患者术后痛苦[3]。随着腹腔镜技术的熟练,我们对传统腹腔镜手术进行改良,将吻合器钉座自肛门放入肿瘤近端,自结肠壁戳孔引出钉座拉杆,腹腔镜下用切割闭合器离断钉座与肿瘤之间结肠,带瘤肠管经肛门拖出、切除,残端缝合后还纳,自肛门进入吻合器,腹腔镜下行结肠、直肠(肛管)吻合,无腹壁辅助切口,不仅保证临床疗效,还降低术后并发症的发生,做到完全腹腔镜技术,减轻患者的痛苦。本研究回顾性比较我院2012年2月~2016年2月28例直肠癌改良无辅助切口完全腹腔镜直肠癌全直肠系膜切除术与24例腹腔镜辅助切口全直肠系膜切除术,报道如下。
1 临床资料与方法
1.1 一般资料
本研究52例,排便不尽感18例,腹胀、大便变细12例,偶有肛门下坠感19例,大便带血3例。经结肠造影或结肠镜排除多发癌,胸腹部CT未发现转移癌。按照不同时间段分组,2012年2月~2014年5月24例行腹腔镜辅助切口全直肠系膜切除术为辅助切口组,2014年6月~2016年2月28例行改良无辅助切口完全腹腔镜全直肠系膜切除术为无辅助切口组。2组一般资料比较无统计学差异(P>0.05),有可比性,见表1。
病例选择标准:肿瘤占据<1/2肠腔,术前检查提示无周围侵犯,肿瘤距离肛缘>5 cm,无其他脏器转移。
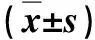
表1 2组一般资料比较
1.2 方法
手术均由同一术者完成。
无辅助切口组:全麻,取截石位,头低脚高15°~30°。气腹压力10~13 mm Hg(1 mm Hg=0.133 kPa)。在脐上缘做10mm切口,为腹腔镜观察孔;右锁骨中线与两髂前上棘连线交点做12 mm切口,为主操作孔;右锁骨中线平脐点做5 mm切口,为辅助操作孔;左锁骨中线脐下2 cm做5 mm切口,为次辅助操作孔。解剖、离断肠系膜下血管或直肠上血管,分离乙状结肠右侧系膜,清扫血管根部淋巴结,完全游离肠系膜下动脉根部,切开乙状结肠侧腹膜,游离直肠,切开直肠前腹膜反折处,再切断两侧韧带,此过程中要注意保护输尿管、盆腔自主神经等,直肠游离至盆底直肠裂孔处,离肿瘤15~20 cm处将乙状结肠裸化。将吻合器钉座与引导管相连,消毒肛门并扩肛,从肛门将引导管置入,从离肿瘤15~20 cm处肠壁引出吻合器订座拉杆,在腹腔镜下缝合固定,取出引导管。腹腔镜下用切割闭合器离断钉座与肿瘤之间结肠,将远侧带瘤肠管完全外翻、自肛门拖出体外,直视下距肿瘤下缘2~5 cm处离断直肠,直肠远端缝合后自肛门还纳,腹腔镜下行结肠、直肠(肛管)吻合,大量生理盐水冲洗腹腔,放置引流管。
辅助切口组:麻醉方式、体位、操作孔等均同无辅助切口组。探查肿瘤后在腹腔镜下完成直肠游离和淋巴清扫,在耻骨上3 cm处做一长约4 cm辅助切口,将肿瘤直肠自切口拉出腹腔外,在肿瘤上方5~10 cm切断乙状结肠,移除标本,放置吻合器后,放回腹腔,建立气腹部,在腹腔镜下进行吻合。
2组患者术后进行常规化疗,采用FOLFOX6方案:奥沙利铂100 mg/m2,亚叶酸钙200 mg/m2,化疗第1天静脉滴注,随后氟尿嘧啶2.4~3.6 g/m2持续48 h滴注,每2周重复,共10~12个疗程。
1.3 统计学处理

2 结果
无辅助切口组手术时间、术中出血量、肛门排气时间、术后住院时间明显短于/少于辅助切口组(P<0.05),2组淋巴结清扫数目差异无统计学意义(P>0.05),见表2。辅助切口组2例切口疝,均在1年后行无张力修补术修补;3例切口脂肪液化,均经换药处理后愈合。术后病理:无辅助切口组高分化腺癌8例,中分化腺癌7例,低分化腺癌9例,高级别瘤变4例;Duke’s A期16例,Duke’s B期12例。辅助切口组高分化腺癌7例,中分化腺癌6例,低分化腺癌8例,高级别瘤变3例;Duke’s A期15例,Duke’s B期9例。2组术后随访12个月,术后排便情况均正常,1~2次/d,无辅助切口组1例发生腹膜后淋巴结转移,辅助切口组1例锁骨上淋巴结转移,其余患者均未发现局部复发与远处转移。
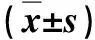
表2 2组术中、术后情况比较
A:高分化腺癌;B:中分化腺癌;C:低分化腺癌;D:高级别瘤变
*Fisher精确检验
3 讨论
腹腔镜技术被广泛应用于直肠癌手术,手术创伤小,相比开腹手术,对患者损伤小,术后患者恢复快,在低段位也能够做到完整切除肿瘤的基础上,超低保肛,是治疗直肠癌的有效方式[4]。随着腹腔镜技术的发展,手术方式也不断更新,对术后标本的取出方式进行不断的改进,有经自然腔道与经腹部辅助小切口两类[5]。在腹部作辅助切口,方便标本的取出以及进行肠道的吻合,但是术后切口感染、切口疝气、疼痛是最常见的并发症,患者术后恢复时间相对较长,并没有完全体现出腹腔镜手术的操作优势[6]。在丰富经验的积累上,进行腹腔镜手术操作的改良,采用经自然腔道取出标本,腹腔镜下进行肿瘤切除,并清扫淋巴结,经肛门将标本取出,手术难度并没有增加,并没有增加吻合口漏的风险,并且患者避免辅助切口,减轻患者的痛苦,避免术后患者的疼痛、切口感染等并发症,腹部留下的瘢痕很小,术后恢复更快,患者更容易接受。
我们总结手术成功的经验如下:①默契的团队配合是保证手术顺利完成的关键,团队成员要相对固定,才能在术中配合默契,减少手术并发症及副损伤;②术者及助手要有娴熟使用腹腔镜的技巧和能力;③术者必须具备开腹直肠癌根治术的手术经验,并能在腹腔镜下精准辨认解剖结构,找到正确手术入路最终顺利完成手术;④病例选择要恰当,避免过度肥胖以及手术分期超过T3患者;⑤肠管游离要充分,保证无张力吻合,结肠闭合端与结直肠端侧吻合口距离≤1.5 cm,避免人为憩室和肠漏发生。
本研究结果显示无辅助切口组手术时间明显缩短(P<0.05),术中出血量明显少(P<0.05),术后肛门排气时间和术后住院的时间明显缩短(P<0.05),且无辅助切口,值得临床推广。 本术式适应证:直肠肿瘤距离肛缘至少5 cm,直肠病变局限要小于肠腔的1/2,并且直肠肿瘤周围无侵犯,手术分期不超过T3,且由于肥胖患者带瘤肠管内翻经肛门拖出困难,所以不适用于肥胖患者[7]。手术应该遵守无瘤原则,复发与首次手术的彻底性及无瘤技术操作有关。术中要保留好盆腔自主神经,尽量保留患者能够自主排尿和性功能,对患者的日后生活有极其重要的影响。对上腹下丛、腹下交感神经及盆腔神经丛等辨认和解剖要熟练掌握,为减少腹腔感染的几率,所以将直肠外翻拉直肛门,在体外进行肠管敞开,减少肠内容物进入盆腔。距离下缘2~5 cm处进行切除,保证无瘤原则,也防止过度治疗,并且在体外直视下操作,确保病变部位的切除[8]。在保证治疗效果的同时,减少对患者的创伤,更易于患者术后的恢复。但本研究为回顾性研究且样本量小,有待大样本的临床研究来验证。
综上所述,采用改良无辅助切口完全腹腔镜直肠癌全直肠系膜切除术可行,并发症少,有推广价值。
