丛枝菌根影响土壤-植物系统中重金属迁移转化和累积过程的机制及其生态应用
2019-02-21陈保冬张莘伍松林李林凤
陈保冬, 张莘, 伍松林, 李林凤
(1.中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085;2.中国科学院大学, 北京 100049;3.中国地质大学(北京), 北京 100083)
重金属原义是指比重大于5的金属,而在环境科学领域中则特指能够对生物体产生毒害作用的金属或类金属元素,如Pb、Zn、Cd、Cr、As和Hg等。重金属在工农业生产及人们日常生活中有着非常广泛的应用,但由于重金属相关工业生产活动中废弃物的不合理排放,以及含重金属农药和化肥的大量施用等原因造成了土壤重金属污染,不仅对生态环境产生严重破坏,也可能通过食物链传递与累积直接威胁到人体健康[1]。在此背景下,采用适宜方法治理重金属污染土壤迫在眉睫。目前,重金属污染土壤治理方法主要有工程措施、物理化学修复和生物修复。工程措施主要指客土、翻土等,物理化学修复方法则主要包括电动力修复法、热处理分离法、固化/稳定化,以及土壤淋洗等技术,而生物修复主要是利用植物及微生物去除或固定土壤中重金属的方法。与物理化学修复技术相比,生物修复具有成本低、环境友好、二次污染小等优点,因而受到越来越多的关注。植物修复是生物修复中最具前景的一种修复方法。针对不同的污染情形,植物修复具体分为植物萃取、植物固定、植物过滤和植物挥发等。
在自然条件下,植物往往与土壤中的微生物有着密切的联系,有些土壤微生物甚至会深刻影响植物的生理代谢和环境适应性。有研究者提出,植物-微生物联合修复往往会比单一的植物修复或微生物修复有更好的应用效果[2-3]。在诸多土壤微生物类群之中,丛枝菌根真菌(Arbuscularmycorrhizalfungi,AMF)是一类广泛存在的专性共生土壤真菌,能够与陆地上大多数高等植物形成共生关系[4]。AMF从宿主植物获取碳水化合物以维持自身生长,同时能够帮助宿主植物从土壤中吸收矿质养分和水分。很多研究表明,AM共生体系对植物适应各种逆境胁迫(如土壤贫瘠、干旱和污染等)具有重要意义[5]。一些调查研究也发现,重金属污染区域往往存在着较高的AMF多样性[6-7],AMF不仅可以帮助植物在重金属污染土壤中生长[8],也有助于矿区生态系统的恢复重建[9],而且这些耐性AMF多趋向于与优势植物种群形成共生关系[10]。在重金属污染情况下,AMF能够通过多种途径减轻重金属对植物的毒害,增强植物重金属耐性[11],因而AMF无论对于重金属污染土壤生物修复还是生态重建都具有潜在应用价值。本文围绕AM影响植物吸收累积重金属机制,重点介绍相关研究前沿,并对未来研究方向及菌根应用技术的研发及推广进行展望。
1 重金属污染下AM对植物生长和吸收累积重金属的影响
重金属往往具有较强的生物毒性,会直接抑制植物和AMF的生长和生理活动,进而影响到AM共生体的建成和发育。另一方面,AM共生体也往往有助于植物适应重金属污染环境。通常情况下,AM能够强化植物根系对重金属的过滤作用(或屏障效应),从而降低重金属向地上部的分配比例,减轻重金属对植物地上重要生理器官的毒害作用。不过,AM植物吸收累积重金属会受到重金属种类及污染程度、植物和AMF种类及土壤理化性质等多种因素的影响,菌根效应也往往会因具体情况而有所不同。
1.1 重金属污染对AM形成的影响
重金属会同时影响植物及AMF的生理或遗传特性,进而影响菌根共生体系的建成和发育。很多调查研究表明[6-7,12],重金属污染会影响土壤AMF多样性,如Zarei等[6]发现,随着土壤Pb和Zn污染浓度的升高,AMF多样性降低。野外调查发现[7,10,12-14],在重金属污染地带生长的植物能够自然形成菌根共生体,如Chen等[10]发现,铜尾矿区(高度Pb、Zn、As、Cd和Cu污染)优势植物狗牙根(CynodondactylonLinn.)具有较高菌根侵染率。Whitfield等[7]也发现,重金属污染区的早生百里香(Thymuspolytrichus)等植物具有较高的AM菌根侵染,而且随着污染程度的增加根内泡囊显著增多,说明在重金属污染情况下,AMF能够与特定植物形成良好共生关系。一些室内模拟试验表明,重金属污染可能提高[15-16]或降低AM侵染率[17-18],具体受到金属元素种类、浓度及化学形态等因素影响[19]。低剂量重金属污染往往能够刺激AM真菌生长,促进菌根共生体发育,而高浓度重金属则往往抑制AM形成[20-21]。此外,重金属形态对AM侵染率有重要影响,如Leyval等[22]观察到土壤重金属总浓度与菌根侵染率无显著相关,而NH4NO3提取态Cd和Zn与AM侵染率呈显著负相关。
1.2 重金属污染下AM对植物生长的影响
重金属污染情况下,AM通常能够促进植物生长。如Chen等[23]发现Cu尾矿中,接种Glomusmosseae促进了金鸡菊(Coreopsisdrummondii)、蜈蚣草(Pterisvittata)和白三叶草(Trifoliumrepens)的生长。Dong等[24]发现严重As污染土壤中,接种G.mosseae显著提高了白三叶草和多年生黑麦草(LoliumperenneL.)的生物量。Zhang 等也发现,AM真菌能够显著促进在砷污染土壤中生长的蒺藜苜蓿(MedicagotruncatulaL.)[25]、紫花苜蓿(MedicagosativaL.)[26]和水稻(OryzasativaL.)[27]生长。Wu等[28-29]研究发现AM真菌能够显著促进铬污染土壤中蒲公英(TaraxacumplatypecidumDiels)、狗牙根及蒺藜苜蓿的生长。很多研究发现AM的促生效应与改善植物矿质营养(尤其是磷营养)密切相关[23-24,30-31]。AM能够活化土壤中的磷,促进植物根系对磷的吸收[32-33]。AM根外菌丝也能够直接吸收P[34]并传输到植物体内,而这种作用对于一些特殊的无根毛植物尤为突出,如Chen等[30,35]发现U污染下,AM能够显著促进无根毛突变体大麦(Hordeumvulgare)吸收P从而促进其生长,而对野生型大麦P营养及生长无显著作用。当然,AM也可能通过增强植物根系对重金属的屏障作用,降低植物重金属毒害,从而促进植物生长[24,30]。同时,AM的促生效应也受到植物种类、土壤性质等因素影响。
1.3 AM对植物吸收累积重金属的影响
在多数研究报道中,AM能够降低植物地上部重金属浓度,减轻重金属对植物的生理毒害。如Chen等[16,23-24,36]发现在重金属污染下,AM能够降低植物体内(尤其是地上部) Cu、Zn、As 和Cd 浓度。这一作用在放射性元素U污染的情况下也表现出来[37]。在田间试验中,对于轻度重金属污染,接种G.intraradices提高了克隆植物蒿柳(Salixviminalis(5027))根系Cu和Cd浓度,同时降低了地上部Cu和Cd浓度[38]。Wu等[29]研究发现接种AM真菌能够显著降低蒲公英地上部和根系的铬浓度。对于砷污染土壤中生长的植物,接种AM真菌同样能够降低蒺藜苜蓿和紫花苜蓿地上部和根系的砷浓度。由于重金属污染土壤中AM往往促进了植物生长,增加了植物生物量,所以,AM降低植物地上部重金属浓度通常被认为是一种“生长稀释”效应[16,23-24,36]。不过,在一些试验中也出现AM提高植物地上部重金属浓度的情况[21,39-42]。如Yu等[39]发现Cd污染下,AM增加了多花黑麦草(L.multiflorum)地上部及根系Cd浓度。刘灵芝等[40]发现不同土壤施Cd水平(0、5、20和50mg/kg)下,AM均提高了万寿菊(TageteserectaL.)地上部Cd浓度,促进了Cd自根系向地上部的转运。
尽管AM对植物体内重金属浓度影响不同,但由于AM通常会促进植物生长,所以AM往往会增加植物重金属吸收量。如接种G.mosseae降低了苜蓿(Medicagosaliva)、白三叶草和黑麦草体内As浓度,但却增加了As吸收总量[23-24,36]。当然,也有一些试验表明,AM同时增加了植物地上部及根系Cd浓度和吸收量[39-40],或者AM对植物重金属浓度及吸收量都没有显著影响[18]。这些不同的研究结果很可能与不同的试验环境条件以及植物自身生物学特性等有关。
此外,AM对植物体内重金属分配也有重要影响。多数情况下,AM能够抑制重金属自根系向地上部的转运,从而降低植物地上部与根系重金属吸收量之比[15-16,23-24,29,36-37,43]但特定情况下AM也可能提高植物地上部与根系重金属吸收量之比[39-40,42]。
2 AM植物吸收累积重金属的影响因素
总体上,AM植物吸收累积重金属受重金属元素种类及污染程度、植物和AM真菌种类及土壤理化性质等多种因素影响,在具体基础及应用研究中应综合考虑各种因素,以全面认识AM在植物适应重金属污染胁迫中的作用,并为应用AM修复重金属污染土壤奠定基础。
2.1 元素种类和污染程度
有些金属元素是植物生长发育所必需的,即微量营养元素,如Zn和Cu等,但大多数重金属则是植物生长发育所不需要的,为非必需元素,如As、Cd、Cr、Pb等重金属以及放射性元素U、Cs等。植物对于营养元素和非必需元素的吸收机制往往是不同的。植物通过长期的进化,已演化出专门的通道吸收微量元素[44-45],例如Zn通过被动运输进入大麦体内[44],通过细胞膜上P1B-type ATPases作用进入Zn超富集植物天蓝遏蓝菜(Thlaspicaerulescens)[46]。植物吸收非必需元素往往依赖已有的营养元素吸收通道,如通过磷酸根转运蛋白吸收砷酸根离子[47],通过硫酸根转运蛋白吸收铬酸根离子[48],通过钾离子吸收途径吸收放射性元素Cs[49]。一般情况下,植物需要吸收一定的营养元素以维持生长,故低浓度微量营养元素情况下,随着土壤中元素浓度的增加,植物生长增加,而过高浓度则会造成植物中毒,而非必需元素往往在低剂量下就对植物产生毒害作用。
对于微量营养元素Zn和Cu而言,当其在土壤中的浓度较低时AM能够促进植物对这些元素的吸收[50],而在达到污染浓度时往往能够降低其地上部浓度,对植物起到“保护”作用。例如Chen等研究发现,当土壤添加Zn浓度在50mg/kg 以下时,接种G.mosseae提高了红三叶草地上部Zn浓度,并促进了Zn向地上部的转移,而在 50mg/kg以上时,G.mosseae则降低了植物地上部Zn浓度,抑制了Zn向地上部的转运。无论高浓度和低浓度Zn施加水平下,AM均提高了根系Zn浓度[16]。对于Cu来说也有类似的规律,如有研究发现,Cu添加量低于1mmol/L(64mg/kg)时,Glomusgeosporum对海紫菀(AstertripoliumL.)地上部和根系Cu浓度无影响,而在Cu添加量高于1mmol/L时降低了地上部Cu浓度[51]。也有试验表明,Cu的临界浓度在2mmol/L(124mg/kg)左右,如土壤Cu添加浓度在100mg/kg以下时,接种Acaulosporamellea增加了玉米(ZeamaysL.)地上部Cu浓度,而在100mg/kg以上时则降低了地上部Cu浓度[52]。Cu添加浓度低于2mmol/L时,AM对辣椒(CapsicumannuumL.)体内Cu浓度无影响,而在高于2mmol/L时,则同时降低其地上部和根系Cu浓度[53]。
一般情况下,AM能够抑制非必需金属元素向植物地上部的运输,减轻重金属对植物的毒害。在As污染土壤中,G.mosseae总体上降低了蒺藜苜蓿(MedicagotruncatulaL.)和玉米地上部和根系As浓度[54-55]。Cd污染下,AM往往能够降低植物地上部Cd浓度[56-58]。也有发现,在10~500mg/kg Pb污染下,AM能够降低玉米叶片Pb浓度[59]。不过,对于某些特殊植物(如重金属超富集植物)而言,AM也可能增加植物地上部重金属浓度,促进重金属自根系向地上部的运输。如有发现G.mosseae增加了砷超富集植物蜈蚣草(PterisvittataL.)地上部As浓度[60]。AM甚至能够增加某些植物,如向日葵(Helianthusspp.)地上部放射性元素137Cs吸收量[61]。也有少数试验报道,重金属污染下AM对植物体内重金属(如Pb)浓度无显著影响[62]。
与必需元素相似,AM对植物吸收累积非必需元素的影响可能也存在一个浓度阈值。土壤中重金属浓度低于该阈值时,AM对植物体内重金属浓度影响较小,而高于阈值时则降低植物地上部重金属浓度。如Liu等[40,63]发现在土壤不施Cd时,接种处理万寿菊(TageteserectaL.)地上部Cd浓度与未接种处理无显著差异[40],甚或增加了地上部Cd浓度[63];当土壤施Cd 浓度在20mg/kg以上时,接种处理植物地上部Cd浓度显著高于不接种处理,而当土壤施Cd 浓度达到50mg/kg时,接种又降低了植物地上部Cd浓度。也有发现,AM在土壤施Cd浓度小于50mg/kg时对宝山堇菜(Violabaoshanensis)体内Cd浓度无影响,而在土壤施Cd浓度高于100mg/kg时则降低了其地上部和根系Cd浓度[64]。Pb的临界浓度要高许多,如Zhong等发现,土壤施加Pb浓度低于500mg/kg时,AM对宝山堇菜体内Pb浓度无影响,而在Pb浓度高于1000mg/kg时则降低了其地上部和根系Pb浓度[65]。
在多种污染元素共存时,AM对植物吸收重金属的影响是否依然符合以上规律呢?有研究发现0~500mg/kg Pb污染下,AM降低了玉米叶片Pb浓度,但同时增加了叶片Zn (土壤Zn本底浓度为0.4mg/kg)浓度[59]。这表明AM能够在增强植物吸收微量元素的同时减少植物吸收非必需元素,从而增强植物重金属抗性。然而,当营养元素浓度逐渐升高而成为胁迫因素时,AM对植物营养元素与非必需元素的吸收则均会表现为抑制吸收效应。如Garg等[65]试验发现,无论在Zn和Cd复合污染,还是单元素污染下,接种G.mosseae均降低了木豆(Cajanuscajan(L.) Millsp.)体内Zn和Cd浓度。当然,也有研究发现,Zn和Cd单元素污染与复合污染情况下,AM对玉米体内Zn和Cd浓度影响并不相同[66]。这种区别可能源于植物特性、AM真菌及土壤理化性质等因素的变化。此外,Chen等[67]发现在As和放射性元素U复合污染情况下,AM显著增加了蜈蚣草体内U浓度,而对植株As浓度没有影响,而这与单一As污染情况时AM对蜈蚣草体内As浓度的影响一致[68]。在Zn、Cd和Pb三种元素混合污染情况下,Vogel-Mikus等[69]也发现AM降低了重金属超富集植物遏蓝菜(T.praecox)根系Cd和Zn浓度,而对Pb浓度的影响存在临界值。总体来说,多元素复合污染下AM对植物重金属吸收作用的影响研究较少,难以得出一致的结论,但相比较单元素污染,这方面研究往往更接近实际情况,对于菌根修复技术的应用具有重要意义,所以今后应得到加强。
综上,无论对于微量营养元素还是非必需元素,无论单元素污染还是多元素复合污染情况,AM植物吸收累积重金属均受到重金属元素种类和污染程度的影响。一般来说,低浓度重金属污染下,AM增加植物体内(尤其是地上部)重金属浓度,而高浓度重金属污染下,AM则普遍降低了植物体内(尤其是地上部)重金属浓度。这一观点也得到了Audet等[70]的验证。Audet等[70]对20篇AM影响植物吸收累积重金属的研究文献进行了Meta分析,将AM植物与非AM植物体内重金属浓度或吸收量的相对差值定义为AM效应值(AM feedback),结果发现无论对于植物重金属浓度还是吸收量来说,低浓度(10-3~1mg/kg)土壤重金属污染下,土壤重金属浓度与AM feedback之间呈显著正相关关系,表明AM“强化”了植物吸收累积重金属;而在高浓度(1~104mg/kg)重金属污染下,土壤重金属浓度与AM feedback之间呈显著负相关关系,表明AM“阻滞”了植物吸收累积重金属。可见,土壤重金属浓度对AM植物吸收重金属的影响存在临界值。当然,Audet等所做的分析是在较大浓度范围下(土壤重金属浓度从10-3到104mg/kg)进行,而且没有考虑微量营养元素与非必需元素的区别,因而具体到某些特殊的植物、真菌及重金属种类结果也会有所不同。特别需要指出的是,AM真菌和植物只在一定重金属污染范围内具有耐受性,而且在这一范围内随着重金属浓度的增加,植物对AM真菌的依赖性往往有增加的趋势[70],然而超过这一范围,即在过高土壤重金属浓度下,植物和AM真菌可能均无法生存,AM作用也将不复存在。
2.2 植物种类
不同的植物对重金属耐受性及吸收累积特性不同,对菌根依赖程度不同,因而可以推断,AM对植物吸收累积重金属的影响会因宿主植物种类的不同而不同。在Pb污染情况下,AM增加了Kummerowiastriata(Thunb.) Schindl、IxerisdenticulateL.和Ecrusgallivarmitis根系和地上部Pb浓度之比,而对黑麦草和白三叶草无影响[21]。AM甚至对于同一种植物的不同重金属耐性品种作用也不相同[58,71],如有发现G.intraradices降低了转入金属硫蛋白基因的烟草(NicotianatabacumL.)地上部及根系Cd浓度,而对野生型烟草重金属吸收无影响[71]。在100mg/kgAs污染下,G.mosseae显著增加了非耐砷蜈蚣草根部As浓度,而对耐砷蜈蚣草地下部As浓度无影响[60]。放射性核素U污染下,AM对不同生态型植物吸收重金属影响也不同,如Chen等[35]发现,G.intraradices能够降低无根毛突变体大麦地上部U浓度,同时增加其根系U浓度,增强根部固持作用,而对野生型大麦吸收累积U无影响。此外,AM对植物重金属吸收的影响也会因植物生长期不同而不同。如50mg/kg Cd污染下,在植物与AM真菌共生生长11周后,AM增加了白三叶草地上部Cd浓度,而在生长20周后这种作用消失[72]。由此可见,AM对植物吸收重金属的影响会有一个时间效应,这可能与植物及真菌在不同生长期的资源分配有关,具体机制还需要进一步研究。
2.3 AM真菌种类
AM真菌没有严格宿主专一性,一种AM真菌能够侵染多种植物,而同一种植物也可能被多种AM真菌侵染。然而,这并不意味着不同AM真菌具有同样的生态功能。事实上,不同AM真菌和宿主植物之间有彼此的适合性。不同AM菌种对同一植物适合程度可能不同,共生体系生理效能自然也会有所差异,其对植物吸收累积重金属的影响也不同。在As污染情况下,G.mosseae和G.etunicatum均降低了玉米地上部As浓度,而G.constrictum对地上部As浓度没有影响[73]。类似地,也有研究发现不同AM菌种对植物吸收累积Cd影响不同[74-75],如Cd污染下,G.intraradices对紫羊茅Cd吸收的抑制效应大于G.mosseae[74]。
AM真菌自身的重金属耐性也是影响菌根植物吸收重金属的一个重要因素。研究发现,分离自重金属污染地带的G.intraradices能够改变烟草叶片Cd浓度,而分离自农田地的G.geosporum对烟草叶片Cd浓度没有影响[58]。即使对于同一AM真菌菌种,其对植物吸收重金属的影响也会因菌株的重金属耐性不同而不同,如G.mosseae重金属耐性菌株对蜈蚣草地上部和根系As浓度无影响,而非耐性菌株则增加了蜈蚣草地上部As浓度[60]。又如,Cd污染下,分离自Cd污染地的G.mosseae增加了白三叶草地上部Cd浓度,而对照G.mosseae菌株则对植株地上部Cd浓度无影响[72]。不过,也有试验表明不同耐性菌株对其宿主植物吸收重金属的影响没有差异[51,76-77]。
从不同污染地分离的AMF菌株其耐性范围往往会有所不同。Weissenhorn等[78]发现,从Zn污染土壤中分离的菌种G.mosseae较对照菌种来说只具有更高的耐Zn作用,而不具有更强的耐Cd作用,而从Cd污染土壤分离的G.mosseae和G.etunicatum混合菌种较对照混合菌种具有更高的耐Cd和Zn能力。不同耐性AM真菌菌种对植物吸收累积重金属影响也不同,如分别分离自0、10和100mg/kg Cd污染土壤的三种AMF对大麦吸收累积Cd影响各不相同[79]。此外,因为不同AM真菌特性不同,同时也存在侵染竞争,多种AMF混合接种与单一AMF对植物吸收重金属影响也可能不同[80],但目前该方面研究较少。然而,比较冯海燕等[81]G.mosseae和G.intraradices单一接种和Yu等[39]以同样两个菌种混合接种对黑麦草吸收累积Cd的影响的研究,发现混合接种和单一接种均增加了植物体内Cd浓度,二者作用是一致的。当然,考虑到自然环境中往往是多种AM真菌与植物共生,因此未来研究需要借助分子生物学方法分析混合菌中不同AMF侵染竞争动态,以期在更接近自然的状况下探究AM真菌在植物适应重金属胁迫中的作用及机制。
2.4 土壤理化性质
土壤理化性质(如土壤pH、肥力等)对植物及AMF的生长发育有着重要影响,同时也能够影响重金属生物有效性,进而影响植物吸收重金属。不同AM菌种的pH适应范围不一样,如球囊霉属(Glomus)多出现在pH=5~9,而无梗囊霉属(Acaulospora)、巨孢囊霉属(Gigaspora)、盾巨孢囊霉属(Scutellospora)则主要出现在pH<7的土壤中[80]。不同pH下,AM真菌对植物侵染也不同。如低pH水平下(4.3~5.1),Gigasporamargarita对紫云英(Astragalussinicus)侵染高,而在较高pH水平下(5.8~6.8)Glomusmosseae对紫云英有较强的侵染[80]。此外,不同pH下,AM真菌侵染状况及其群落组成也会发生变化[82]。土壤有效P对AM的形成也具有重要影响,AM侵染率往往随着土壤中速效P的增加而降低[30,35,83]。在重金属污染情况下,土壤理化性质也同样影响着AM的形成,如在Zn、Cd、Cu污染胁迫下,AM真菌只在pH 6.2下对大豆(GlycinemaxL.)有侵染,而在pH 5.7下无侵染[84]。可见,土壤理化性质在AM形成及功能中起着重要的作用,其对AM植物适应重金属胁迫也必然产生一定影响。许多研究发现[30,64,75],土壤肥力状况(尤其是速效P浓度)对AM植物吸收重金属具有重要影响。如5mg/kg Cd污染下,低P(1mg/kg)情况下G.intraradices增加了刀豆(CanavaliaensiformisL. D.C)地上和地下部Cd浓度,而在较高P浓度(10mg/kg)情况下这种作用消失[75]。在铅锌矿区中(DTPA提取态Cd浓度为23mg/kg,Pb浓度为387mg/kg),AM在不施加P时能够抑制宝山堇菜吸收Pb,而在施加250mg/kgP时则对植物吸收Pb无影响[64]。在自然U污染土壤中,不施P的情况下,G.intraradices显著促进了无根毛突变体大麦吸收P同时提高了根系U浓度,而在施加50mg/kg P的情况下菌根没有改善植物P营养,其对根部U浓度也无影响[30]。
土壤理化性质对AM植物吸收累积重金属的影响机制可能有两个方面。一方面,土壤理化性质(主要是pH或速效磷等)通过影响AM共生体系的形成和发育,进而影响AM植物吸收累积重金属。如前所述,不同AMF适宜的土壤pH不同[79],而土壤速效磷往往抑制菌根的形成[30,35,83]。另一方面,土壤理化性质也可能直接影响土壤重金属形态和有效性,进而对共生系统吸收重金属产生影响。如土壤pH的升高往往会降低土壤重金属生物有效性[85],土壤中的磷酸根离子往往可以与二价阳离子重金属反应使得重金属活性降低。
3 AM增强植物重金属耐性的作用机制
AM真菌可通过多种途径影响植物吸收累积重金属,概括起来可分为直接作用和间接作用。直接作用主要是AMF对重金属的直接吸收、固持,以及对根际重金属形态和生物有效性的影响,而间接作用则主要是AM通过促进植物对矿质养分(尤其是磷)的吸收和植物生长,从而增强植物自身重金属耐性。
3.1 间接作用机制(非专性机制)
重金属会对植物产生毒害作用,而土壤重金属首先作用于植物根系。植物根系受到重金属毒害其生长受抑,不能正常执行根系吸收矿质养分和水分的功能。同时,在重金属污染地带,土壤中矿质养分往往相对缺乏。AM真菌能够有效扩大植物根系吸收范围,并能活化土壤中的矿质养分,这在一定程度上可以弥补根系功能缺陷,增强植物对重金属污染环境的适应性。由于菌根的这种作用并非仅在重金属污染情况下才起作用,而在各种逆境胁迫下根系生长和生理功能受阻时均能发挥作用,因此也被称为非专性机制。
在土壤中金属元素Cd、Cu、Pb、Zn等能够与磷酸根结合形成难溶性磷酸盐,进而降低P的生物有效性,而AM能够通过活化土壤中的P[33],或通过菌丝直接吸收P[34]并传输到植物体内,从而改善植物P营养。例如,在U污染下AM根外菌丝可以帮助无根毛突变体大麦摄取P,以弥补根毛的作用[30,35]。Chen等[15,36]通过分室试验比较G.mosseae根外菌丝对重金属和P的吸收,发现AM真菌更容易选择吸收P。Christophersen等[86]发现,AM真菌能够降低植物根系HvPht1;1和HvPht1;2基因(编码根表层高亲和磷酸根离子通道蛋白)表达,从而抑制植物吸收砷酸根离子,同时增加AM诱导的共生界面磷转运蛋白基因HvPht1;8的表达,促进P的吸收和转运。AM通过改善植物P营养增加植物生物量,而植物生物量的增加往往导致降低植物体内重金属浓度相对下降,这一现象即被称为“生长稀释”效应[16,23-24,36]。此外,AM也能够改变根系形态[87],进而对植物自身吸收重金属过程产生影响。很多试验表明,虽然菌根可能导致植物体内重金属浓度下降,但植物重金属吸收总量却是增加的[23-24,36],这很可能是由于植物根系生长得到改善而直接吸收了更多的重金属。
3.2 直接作用机制(专性机制)
AM真菌对植物吸收累积重金属的直接作用是指菌根真菌直接参与重金属在土壤-植物系统迁移转化过程。这种作用对重金属具有专一性,因此又称为专性机制。根外菌丝直径虽仅有数微米,但其能形成发达的菌丝网络和巨大的表面积,因而可以相当可观地吸附和吸收作用固持根际土壤重金属。另一方面,根内共生结构(根内菌丝、泡囊、丛枝等结构)能够在细胞水平将重金属“区隔化”,阻止重金属进入植物根细胞,减轻其对植物的生理毒害。此外,AM真菌还能够通过菌丝分泌物等影响根际微环境,进而影响重金属的化学形态和生物有效性。
3.2.1根外菌丝对重金属的直接吸收作用
AM根外菌丝和根毛在吸收矿质养分方面具有一定的功能互补性[35],而很多研究也证实根外菌丝能够直接吸收转运重金属。由于菌丝直径通常只有几个微米,相比根直径低两个数量级左右,故在试验研究中可以一定孔径(30μm左右)的尼龙网将根系和菌丝隔开,形成单独的菌丝生长空间。向分室培养系统中的菌丝室施加重金属,即可考察根外菌丝对重金属的直接吸收作用。如Guo等[88]研究发现,大豆中24%的Cd和Cu、玉米中41%的Cd及19%的Cu均来源于根外菌丝的吸收。Chen等[16]通过在基质中加入P以消除“生长稀释”效应,同时在菌丝室加入不同浓度的Zn,发现菌丝可以吸收Zn并转运到植物体内。在菌丝室Zn浓度为50mg/kg时,通过菌丝吸收的Zn达到植物Zn吸收总量的22%。由于土壤中往往存在着本底重金属,所以仅应用分室培养系统,很难区分被菌丝和植物根系吸收的重金属,而利用同位素标记方法能够区分外源添加与土壤本底重金属,从而定量根外菌丝对植物吸收重金属的实质贡献。如利用放射性同位素标记方法,Joner等[89]发现,随着菌丝室中109Cd施加浓度的增加(从1、10到100mg/kg),接种G.mosseae的地三叶草(Trifoliumsubterraneum)体内109Cd浓度逐渐增加。Hutchinson等[57]也利用109Cd标记法发现长叶车前(Plantagolanceolata)吸收的Cd有10%来自于AM根外菌丝吸收贡献,而Jansa等[90]发现根外菌丝可以吸收65Zn并运输到玉米体内。
以土壤为培养基质的分室培养试验比较接近于自然情况,但难以排除重金属在不同分室间的扩散,所以难以严格定量根外菌丝对重金属的吸收。离体植物根器官和AM真菌的双重无菌培养系统能够在很大程度上免除培养基质本底及重金属扩散问题。Gonzalez-Chavez等[91]采用双重无菌培养系统研究证实G.intraradices根外菌丝能够吸收和泌出As,而G.intraradices中的P转运蛋白(GiPT)和亚砷酸盐泵出蛋白(GiArsA)可能分别负责As的吸收和泌出。Dupre等[92]用双重培养体系研究发现根外菌丝吸收了菌丝室总Cs的21.0%,其中83.6%转移到植物体内,而且绝大部分转移到植物根系中。利用这种培养系统,Rufyikiri等[93]也证实了AM根外菌丝可以吸收并向植物转运放射性元素U。此外,Wu等[94-95]通过双重培养体系证实了AM真菌菌丝对Cr(Ⅵ)的吸收及固持作用,发现AM真菌菌丝能够通过主动运输方式吸收Cr(Ⅵ)并将70%以上吸收的Cr累积在根外菌丝体中。
3.2.2AM共生结构对重金属的固持及区隔化作用
AM根外菌丝细胞壁成分如几丁质、纤维素及其衍生物、黑色素等能够与金属离子结合,因而对金属具有较强的吸附能力[96]。Chen等[97]利用玻璃珠分室培养系统获得根外菌丝,发现菌丝中Zn浓度达到宿主植物体内Zn浓度的10倍。陈保冬等[98]用离体菌丝进行吸附试验发现,菌丝体对不同重金属吸附能力不同,在1000μmol/L重金属初始浓度下,菌丝体对Mn、Zn和Cd的吸附量分别达到自身生物量的1.7%、2.8%和13.3%。也有研究发现[99],G.mosseae菌丝Cd吸附量为0.5mg/g(为真菌Rhizopusarrhizus的10倍),Cu吸附量为3~14 mg/g。菌丝对重金属的吸附可能源于细胞壁上带负价的羟基、羧基、游离氨基酸等与重金属离子等的结合作用[100]。相比较非菌根根系,菌根往往具有较高的阳离子交换量(CEC),对重金属的吸附能力更强[98],强侵染根段往往较弱侵染根段具有更高的P浓度和Pb浓度[77]。Zhang等[101]研究发现,相比较非菌根根系细胞壁,菌根根系细胞壁具有更高的Cu浓度,而细胞质具有更低的Cu浓度。其同时发现,菌根细胞壁对Cu的吸附较非AM根系细胞壁强。对重金属的强吸附作用使得AM根外菌丝及AM根段可以将大量重金属固持在根际,从而阻滞重金属进入菌丝及植物体内,减轻重金属对宿主植物的危害。Wu等[95]研究发现,AM真菌菌丝能够将大量Cr固持在菌丝表面,初步研究发现这些Cr主要以磷酸铬类似物形式存在。
尽管很多试验数据表明AM根外菌丝能够直接吸收转运重金属,但菌丝吸收的重金属并不一定真正进入植物体内,而是被大量固持在菌根共生结构中,这也是一种组织或细胞水平的重金属“区隔化”作用。有试验表明,菌根共生体中的重金属主要被区隔于细胞壁及泡囊等结构中[100,102-103],较少进入植物细胞中。丛枝结构作为菌根真菌和植物根细胞的物质交换界面,可能对重金属也具有很强的选择性屏蔽作用,即菌丝吸收的重金属并不能通过丛枝界面传输给植物根细胞,因而被滞留在菌根共生结构之中而不能向地上部运转。如Wu等[104]研究发现,AM真菌菌丝吸收的铬多数固持在植物根系中,只有少量被转移到地上部。进一步基于同步辐射的软X射线扫描透射显微成像技术研究发现Cr在菌根根系中主要分布于真菌结构(如丛枝、泡囊等)中,而Cr向植物细胞的转运非常有限[95]。此外,Nayuki等[105]利用基于同步辐射的X射线荧光分析发现Cd主要聚集在丛枝、泡囊等结构中。Wu等[106]近期研究发现,AM也能够将重金属Zn和Cu固持在根内丛枝结构中,从而缓解植物重金属毒害。
正是由于AM共生结构对重金属的固持和“区隔化”作用,在很多试验中可以观察到菌根减少了重金属自根系向地上部的运输,或者说菌根降低了重金属向植物地上部的分配比例[15-16,23-24,36-37]。这也可以视作菌根增强了植物器官水平的重金属“区隔化”作用。
3.2.3AM真菌改变菌根际微环境
AM真菌的生理活动,如分泌有机酸、球囊霉素相关土壤蛋白(Glomalin-related soil protein, GRSP)等往往能够改变根际微环境,进而影响重金属生物有效性和植物对重金属的吸收。AM分泌物能够通过直接与重金属结合或间接改变根际土壤理化性质改变重金属化学形态。如研究发现,AM增加了玉米根际土壤有机结合态Zn浓度,同时降低了结晶氧化态及残留态Zn浓度[107],增加了旱稻根际土壤可交换态Pb浓度和有机质结合态Pb浓度,降低了碳酸盐结合态以及铁锰氧化物结合态Pb含量[108],提高了根际土壤中水溶态As浓度[24]。也有研究表明,AM植物根际土壤Cu向金属纳米颗粒物转化[109],AM使玉米根际土壤中交换态Cu百分比从26%升高到43%,有机结合态Cu、Zn和Pb百分比分别提高15%、40%和20%[110]。AM对植物根际土壤重金属形态的影响因植物种类不同而不同。如Leung等[111]发现,AM能够促使蜈蚣草根际土壤中的As由Ca-As结合态向Fe-As结合态和Al-As结合态转化,从而提高了As的生物有效性,却促使狗牙根根际土壤中的As由Fe-As结合态、Al-As结合态及水溶态向Ca-As结合态转化,降低了As的生物有效性。也有研究发现[112],AM降低了种植旱稻的土壤溶液中As(Ⅲ)和总As浓度,即降低了As的生物有效性。
需要指出的是,AM分泌物GRSP[113],作为一种富含脂肪族烯类和亚甲基的糖蛋白[114],对重金属具有较强的结合能力[115-116],因而对土壤重金属生物有效性可能有重要影响。有调查显示,在Cu污染地带,根际土壤中GRSP的浓度与重金属Cu、Zn浓度之间呈显著正相关关系(P<0.001),GRSP结合态Cu浓度在3.76~89.0mg/g之间,占总Cu浓度的1.44%~27.5%[117];GRSP结合态Pb浓度达690~23400mg/kg,占土壤总Pb量的0.8%~15.5%,而且土壤中GRSP浓度与Pb浓度之间呈显著正相关关系(P<0.01)[118]。GRSP对重金属的结合作用对于改变重金属形态具有重要意义,然而其结合机理还不清楚。Gonzalez-Chvez等[119]将Cu加入GRSP溶液中后,分别用柠檬酸、硼酸和盐酸进行多次解吸,发现与GRSP结合的Cu不会被全部解吸下来,Cu在GRSP中的浓度为6.7~28 mg/g,占解吸前浓度的7.2%~12%,表明GRSP对Cu的结合方式除了弱离子交换以外,还有强化学络合作用。此外,不同组织部位的GRSP对重金属的结合能力也不同,相比较基质及非侵染根分离出的GRSP,根外菌丝中的GRSP往往具有较强的重金属结合能力[119]。这可能是不同部位GRSP成分不同所致。
综上,AM能够通过直接途径(专性机制)与间接途径(非专性机制)综合影响重金属在土壤-植物系统中的迁移转化,增强植物重金属耐性。AM增强植物重金属耐性机制示意图,具体见图1。
4 AM增强植物重金属耐性机理研究前沿
AM能够影响植物对重金属的吸收和累积,在植物适应重金属污染环境方面起着重要作用。然而,AM增强植物重金属耐性的生理和分子机制还有许多值得深入探讨的科学问题。这些问题包括:①AM真菌吸收和转化重金属的分子机制是什么?②重金属在AM真菌菌丝中以何种形态运输,其转运机理是什么?③AM真菌自身重金属耐性机理是什么?④重金属如何通过菌根共生界面——丛枝结构而在AM真菌和植物细胞间进行传输?⑤经由菌丝吸收的重金属在AM组织甚至细胞水平上的分布规律?⑥AM真菌如何调控植物自身重金属吸收及累积生理过程?这些问题的解答需要借助生物化学和现代分子生物学研究技术,目前尚处于起步阶段。
4.1 AM真菌对重金属的吸收和转运机制
AM真菌尚不能纯培养,也难以进行遗传操作,由此导致对其进行分子生物学研究相对困难。目前对AM真菌吸收重金属的分子机制所知极其有限。Gonzalez-Chavez等[127]通过RiT-DNA转化胡萝卜根与AM真菌双重培养体系发现G.intraradices根外菌丝可能通过P转运蛋白(Phosphate transporter, GiPT)和亚砷酸盐泵出蛋白(Putative arsenite efflux pump, GiArsA)吸收As(Ⅴ)和泌出As(Ⅲ)。ZIP转运蛋白和阳离子扩散蛋白(Cation diffusion facilitator,CDF)则可能在AM真菌吸收、转运及向“丛枝围”传输Zn中起到重要作用[128-129]。
4.2 重金属在AM共生体系中的分布及形态特征
研究重金属在菌根共生体组织及细胞水平微区分布和形态特征,一方面可以在微观层面验证AM共生结构对重金属的“区隔化”作用,另一方面则可为重金属在AM真菌和植物细胞界面上的传输机制研究奠定基础。已有研究表明,重金属主要位于AM的细胞壁及泡囊等结构中[101-102,130-131],如Chen等[130]发现Cd及Zn主要存在于丛枝、泡囊以及根外菌丝中。Zhang等[101]发现相对于非菌根根系,菌根根系细胞壁中累积更多的Cu,而细胞质中累积较少的Cu。采用传统的组织分离方法由菌根共生体获取菌物不仅工作量大,而且试验结果干扰因素多、可靠性不高。在此背景下,近年来发展起来的激光共聚焦显微技术、X射线能谱以及同步辐射等技术为研究菌根界面重金属分布提供了契机。如Weiersbye等[102]利用Micro-PIXE mapping技术发现U主要分布于AM的根内菌丝或泡囊中。González-Guerrero等[131]运用能量散射X射线能谱法发现无论是在孢子还是在根外菌丝中,重金属主要分布于细胞壁和液泡中,而在胞浆中分布较少。Wu等[95]利用同步辐射的软X射线扫描透射显微成像技术研究发现Cr主要赋存在根外菌丝表面及根内真菌结构中。
相比之下,重金属在AM中的赋存形态鲜有报道,已有研究多关注元素As。如有研究发现,玉米中主要以无机砷为主,AM降低了玉米地上部及根系As(Ⅲ)浓度,同时增加了玉米地上部DMA(二甲基砷酸)浓度,而MMA(一甲基砷酸)只出现在AM根系中。AM可能通过抑制玉米根系砷还原酶活性抑制玉米体内As(Ⅴ)向As(Ⅲ)的还原[55]。Zhang等[25,27]研究发现,接种AM真菌后,在外源添加As(Ⅴ)污染土壤中生长的蒺藜苜蓿地上部和水稻籽粒中均检出了二甲基砷DMA,由于植物本身不具备甲基化砷的能力,所以研究者推测AM真菌很有可能具备甲基化砷的能力。最近Li等[132]从AM真菌Rhizophagusirregularis中克隆了砷甲基转移酶基因RiMT-11,并通过双重无菌培养体系发现AM真菌能将无机砷转化为一甲基砷(MMA)、二甲基砷(DMA)以及气态的三甲基砷(TMA)。该研究证实了AM真菌的确具有砷甲基化和挥发的能力,在这一过程中RiMT-11基因发挥了重要的作用。
4.3 AM对植物自身重金属抗性生理和分子机制的调控作用
AM是一个共生体系,AM真菌和宿主植物之间往往存在着密切的信号交流途径。在重金属污染胁迫下,菌根真菌和植物之间必然有着协同抗逆的机制。目前这方面的研究多集中于AM真菌对植物重金属抗性生理和分子机制的调控作用。
4.3.1AM对植物吸收重金属分子途径的调控作用
AM真菌能够间接调控植物根系重金属吸收相关通道蛋白的合成。As污染情况下,G.intraradices能够降低水稻(OryzasativaL.)根系亚砷酸根离子转运蛋白基因Lsi1和Lsi2的表达,且提高了根系As(Ⅲ)和As(Ⅴ)的比值[133]。也有发现,AM降低了蒺藜苜蓿根系皮层细胞膜中MtPht1;1和MtPht1;2基因的表达,同时提高了共生界面编码P转运蛋白的MtPT4基因的表达,从而能够在改善P营养的同时减少植物对As的吸收[134]。Li等[43]研究也发现,接种处理显著提高了紫花苜蓿根系磷转运蛋白基因MsPT4的表达,促进植物吸收更多磷物从而促进植物生长,通过“稀释作用”降低植物体内砷浓度。此外,AM还能够降低蒺藜苜蓿根系细胞膜上Zn转运蛋白基因MtZIP2的表达,从而降低根系Zn浓度[129]。
4.3.2重金属胁迫下AM对宿主植物抗逆生理的调控作用
重金属胁迫能够造成植物氧化胁迫,同时影响植物的光合作用、呼吸作用等生理生化过程,如引起植物水分缺失,降低植物叶绿素含量等等[135]。AM往往能够减缓重金属胁迫对植物产生的生理胁迫,如Paradi等[136]发现Cd处理仅降低了非菌根植物腐胺和亚精胺含量,而对AM植物无影响。Aloui等[137]发现 AM降低了植物体内Cd引起的异黄酮类及其衍生物和查尔酮浓度。Andrade等[138]也发现AM能够降低植物脯氨酸浓度。也有研究发现,AM能够增强某些植物抗氧化酶的活性[139],降低植物体内活性氧物质浓度[140],缓解重金属对植物的生理毒害。有研究者观测到重金属污染胁迫下AM能够增加植物体内直接参与降低重金属毒性的物质如非蛋白硫醇(NP-SH)、谷胱甘肽(GSH)和植物螯合肽(PC)等的浓度[141]。Wu等[28]研究发现,Cr(Ⅵ)胁迫下,AM真菌能够显著提高蒺藜苜蓿根系中高亲和硫转运蛋白基因的表达,从而促进了植物对硫素的吸收,并增加硫代谢产物的累积,以抵御由于Cr毒害造成的氧化胁迫。Li等[43]研究也发现,高As浓度暴露下,菌根显著提高了紫花苜蓿根系金属硫蛋基因MsMT2的表达,并提高了紫花苜蓿砷浓度的根冠比,从而有效增强了紫花苜蓿对砷毒害的抗性。
4.3.3AM对植物重金属抗性基因的调控作用
目前,AM对植物重金属抗性基因的调控作用研究主要集中于AM对植物重金属络合蛋白基因表达的影响。Ouziad等[142]研究了重金属Zn和Cd污染下,G.intraradices对番茄根部及叶片中LePCS1(编码植物络合素合成酶)、Lemt1、Lemt3和Lemt4(编码金属硫蛋白)及LeNramp2(编码多种重金属的运输蛋白)等基因表达的影响,发现AM真菌减缓了由于重金属胁迫造成的Lemt2和LeNramp1基因表达增高的趋势。也有研究发现[143]Cu和Zn污染下AM真菌增强了新疆杨(Populusalba)叶片中编码金属硫蛋白的PaMT1、PaMT2、PaMT3基因和编码多胺的PaSPDS1、PaSPDS2、PaADC等基因的表达。Rivera-Becerril等[144]发现G.intraradices在提高豌豆(PisumsativumL.)根部Cd浓度的同时,下调了其金属络合蛋白基因的表达,而增强了抗氧化蛋白(如热激蛋白等)基因的表达。
4.3.4AM增强植物重金属耐性蛋白质组学研究
蛋白质组学是近年来发展起来的一门新学科,其以蛋白质组为研究对象,从整体蛋白水平探究生命活动规律[145]。蛋白质组学往往可以测定特定条件下,特定植物组织或细胞内全部蛋白表达情况,相比较传统单个或数个特殊功能蛋白研究,其能够提供更全面的信息,为系统层次上阐述生命过程奠定基础,因此更接近生命本质。重金属污染胁迫下,植物往往启动一系列的相关蛋白表达,以抵御重金属毒害,了解这些蛋白的表达是否受AM真菌的调控,对于从蛋白水平上理解AM共生系统抗胁迫机理具有重要意义。目前,利用蛋白质组学技术研究重金属胁迫下AM真菌对宿主植物体内相关蛋白表达调控作用的报道还比较有限。有研究报道,AM能够在Cd、As等胁迫下调控植物胁迫反应蛋白的表达[146-147]。如Repetto等[146]发现Cd污染下G.mosseae增加了豌豆(Pisumsativum,VIR4788)根部膜联蛋白碎片(Annexin fragment)和豌豆抗病反应蛋白(Pea disease resistance response protein Pi49)的表达量,降低了Cd诱导蛋白液泡ATP合酶B亚基(Vacuolar ATP synthase subunit B)、短链乙醇脱氢酶(Short-chain alcohol dehydrogenase)、岩藻糖苷酶前体(Profucosidase)等5种蛋白表达量。Aloui等[147]发现Cd胁迫下G.intraradices能够诱导蒺藜苜蓿产生亲环蛋白(Cyclophilin)、鸟苷酸结合蛋白(Guanine nucleotide-binding protein)等参与抗氧化过程的蛋白。也有研究发现[148]As胁迫下G.mosseae引起玉米叶片ATP合酶α亚基、ATP合酶β亚基、蛋白激酶(SNF1-related protein kinase 2.2)、MAP激酶等4种蛋白表达量上调,而病程相关蛋白(Pathogenesis-related protein 10)表达量下调。重金属胁迫下,AM植物蛋白质组学能够从蛋白水平上解释AM植物抗重金属生理过程,同时为进一步分子机理奠定基础,因而具有重要意义,但目前研究还处于起步阶段。相信随着蛋白质组学技术的发展,这方面将会有突破式的进展。
AM对植物自身重金属吸收及抗性生理和分子机制的调控作用,很大程度上是以植物抵御重金属毒害机制为中心,研究AM在这一过程中所扮演的“角色”,一定程度上可以揭示菌根共生体适应重金属机制。
4.4 AM真菌耐受重金属分子机制
AM真菌在重金属胁迫下会启动一系列的生理生化过程以减缓重金属毒害。由于AM真菌分子生物学研究存在技术瓶颈,故有关其重金属抗性基因的研究报道不多。目前,已有报道的AM真菌重金属抗性分子机制主要包括抗氧化机制、重金属络合机制以及重金属“区隔化”机制。
4.4.1AM真菌抗氧化分子机制
重金属进入生物体之后往往能够通过催化Haber-weiss反应产生活性氧基团[149-150],进而对生物体膜系统甚至遗传物质产生毒害[151]。超氧化物歧化酶(SOD)是一种能催化超氧化物分解成过氧化氢和水的酶,对机体活性氧基团水平的调节有重要作用[152]。根据SOD所含金属种类的不同可分为CuZnSODs、FeSODs、MnSODs、FeMnSODs和NiSODs 等[153],其中CuZnSODs仅在真核生物中出现,多位于线粒体外层空间和胞浆中[154]。目前在AM真菌中已发现并得到初步功能验证的有Gigasporamargarita(BEG 34)中的GmarCuZnSOD基因和G.intraradices中的GintSOD1基因(可以编码CuZnSOD)。进一步研究发现重金属胁迫下,二者转录水平在根内菌丝及丛枝和泡囊结构中最高[155-156]。在谷胱甘肽(GSH)存在情况下,谷胱甘肽转移酶(GST)具有过氧化物酶活性,能够催化过氧化氢或过氧化氢物分解[157],从而减少活性氧基团的产生。近来已有发现G.intraradices菌丝中存在编码GST的基因[158]。此外,在生物体抗氧化过程中扮演重要角色的吡哆醇生物合成蛋白(Pyridoxine biosynthesis protein,PDX,在维生素B6合成中起重要作用)和谷氨酸氧化还原酶(Glutaredoxins,GRX,同时具有氧化还原酶、过氧化物酶和谷胱甘肽-S-转移酶特性)基因GintPDX1和GintGRX1均已从G.intraradices中分离出来[159-160]。
4.4.2AM真菌重金属络合机制
重金属离子进入AM真菌细胞后,可被金属硫蛋白(MT)和谷胱甘肽(GSH)等络合,从而降低其毒性或进一步通过转运蛋白运输到液泡中。MT是富含半胱氨酸的多肽,可与重金属络合形成四面体金属硫复合物(Tetrahedrally coordinated metalthiolateclusters),也被认为能够促进机体自由基的清除[161]。目前在AM真菌中已发现GintMT1(从G.intraradices中分离)[162]和GmarMT1(从G.margarita中分离)[163-164]两种能编码MTs的基因,而GmarMT1的表达受AM真菌营养状况调控,其在真菌糖分缺乏时表达最高[163]。目前MTs功能机理研究还不深入,如MTs对重金属的络合是否具有特异性,重金属与MTs络合后如何迁移转化等,尚需进一步研究。GSH或谷胱甘肽寡聚体(如植物络合素)也被认为能够与重金属(如Cu、Cd等)络合,形成的复合物通过ATP结合子(ATP-binding cassette,ABC)转运蛋白(属于多药耐药蛋白家族,Multidrug resistance protein,MRP)[165]运转到液泡中,而相关基因GintABC1已从G.intraradices中分离出来[165]。此外,金属型分子伴侣(Metallochaperones)可从结合有重金属的内转蛋白中接收重金属并转移到外转蛋白或接收体蛋白上,以此起到“金属闸门”的作用,而相关基因只在一些外生菌根真菌中发现,是否也存在于AM真菌中还有待研究[166]。
4.4.3AM真菌重金属“区隔化”机制
为消减重金属对机体正常生理过程的不利影响,生物体往往将重金属富集在一些储藏器 (如液泡)中,从而降低关键生理功能部位活性重金属浓度,缓解重金属毒害,即所谓的“区隔化”作用。在“区隔化”过程中一些重金属转运蛋白往往发挥着重要作用,这其中包括阳离子扩散蛋白(Cation diffusion facilitator,CDF)、ABC型转运蛋白(ATP-binding cassette)、Nramps蛋白以及Zn、Fe转运蛋白(Zrt-, Irt-like protein,ZIP)等[135]。这些蛋白的主要功能是作为重金属在细胞浆和细胞器之间的运输通道[135,167-168]。目前,从AM真菌G.intraradices中已发现有GintZnT1(属CDF蛋白组)[128]、GintABC1[编码ABC型转运蛋白,属多药耐药Mmultidrug resistance protein(MRP)蛋白家族][165]以及类ZIP基因[169]。
目前AM真菌耐重金属分子机制研究多采用模式菌种(如G.intraradices),而土著耐性AM菌种往往较模式菌种具有更强的耐重金属特性,关于耐性菌株的耐性机制还鲜有报道,而该方面的研究无论对于全面阐释AM真菌耐重金属机理,还是对于菌根修复技术的应用都具有重要意义。另外一个需要关注的问题是重金属耐性菌株的遗传稳定性。由于AM真菌是多核细胞,单个细胞具有较高的遗传变异性,对于具有较高重金属耐性的亲代菌株,其后代的重金属耐性还是个疑问。培养条件,尤其是重金属胁迫程度可能会影响后代菌株的重金属耐性[22],而目前的相关研究多止于一个植物生长期的室内模拟培养,缺乏自然情况下的长期定位试验,因而对AM真菌自身重金属耐性遗传稳定性及其在植物适应重金属胁迫中的长期效应认识不够。要在分子机制层面阐明重金属耐性基因如何在亲代和后代菌株之间传递,又受到哪些因素的影响,还需要菌根学家和遗传学家的密切合作。
5 AM在农业生产及重金属污染土壤生物修复中的潜在应用
5.1 AM在安全农业生产中的潜在应用
由于农药、化肥等广泛使用造成大面积农田轻度重金属污染,而AM往往能够促进植物吸收矿质养分,同时抑制重金属自植物根系向地上部的转运[24,36],从而降低植物地上部重金属浓度。这对于保障农产品(籽粒)安全,降低重金属污染导致的健康风险具有重要应用价值。Zhang等[27]研究发现接种AM真菌能显著降低大米籽粒中无机砷的含量;李景龙等[170]也发现AM真菌与外源添加Fe对水稻地上部砷积累具有显著的抑制作用。在实际应用中,可以选取适当的AM真菌对作物接种以达到维系农业生产的同时保障农产品品质的目的[171];而另一方面,对于污染较重的农业用地,也可根据实际情况,选择适宜的AM真菌与宿主植物组合,促进土壤净化过程,或栽培不进入食物链的经济作物,进而应用菌根真菌强化重金属的植物固定作用,最大限度降低重金属污染的环境和健康风险。
5.2 AM在矿区污染土壤生物修复中的潜在应用
AM在重金属污染土壤中具有广泛的适应性[6,10,12-14,172],其往往能够改善植物矿质营养,促进植物生长。另一方面,在不同条件下AM可能降低[24,36-38]或提高[21,39-42]植物地上部重金属浓度,改变根际土壤重金属形态[24,107-111],因而无论在植物提取,还是植物稳定方面,菌根都有可能发挥其积极作用。在植物提取方面,AM可以提高一些超富集植物地上部重金属浓度,同时增加其生物量[31,173],极大增强植物对重金属的提取能力。即使某些情况下AM降低了植物地上部重金属浓度,但因其往往能够显著增加植物生物量,因而增加了植物地上部重金属吸收总量[23-24,174],从而促进植物提取重金属。在植物稳定方面,AM能够增加植物根系重金属吸收量,而减少了地上部重金属吸收量[23,51],甚至在添加化学螯合剂EDTA情况下,AM也能够在不改变植物地上部Zn吸收量的同时增加地下部Zn吸收量[18]。AM往往也能够降低根际土壤重金属可迁移性[110]。显然,无论是污染土壤生物修复还是矿区植被恢复,首要的条件是植物能够在污染土壤中生长,菌根最重要的价值即在于其能够帮助植物适应污染环境而存活下来。
此外,值得一提的是,矿区污染土壤往往养分含量极低,如果能够选取一些固氮植物(如豆科植物)与其他植物间作,同时引入AM真菌,这样可以完全通过生物学途径解决植物对N和P的需求,从而经济有效地提高植物修复成功几率。已有研究表明,重金属污染下AM真菌(或联合其他土壤动物或微生物)能够促进豆科植物固氮,并提高其重金属抗性[17,175-176]。铅锌尾矿污染下,AM真菌能够显著增强银合欢(L.leucocephala)固氮能力,而AM真菌与蚯蚓(Pheretimaguillelmi)共同作用下能够减少植物Pb和Cu吸收量,同时降低土壤中Pb和Cu的可移动性[175]。联合接种G.mosseae与耐性细菌(Brevibacillussp.)能够显著增加豆科植物白三叶草的根瘤数[176]。
另一种矿区废弃地生态恢复途径是栽种能源植物,这样可在土地复垦的同时,产生额外的经济效益[177]。目前国内外关于利用能源作物修复重金属污染土壤的研究已有一些报道[178-182],而AM真菌在能源作物适应重金属胁迫中同样起着重要作用[38,183],因而对于利用能源作物修复重金属污染土壤具有重要意义。当然,由于AM对植物吸收累积重金属的调控作用受到土壤重金属种类及浓度、AM真菌种类及耐重金属特性、宿主植物及土壤理化性质等多种因素的影响,在具体应用中应根据实际情况及修复目标选择最佳的AM真菌与植物组合,从而最大限度发挥菌根共生体系的积极作用。
目前,菌根修复技术的研究和推广尚处于起步阶段,以室内模拟研究居多,而田间试验少有报道。近年来一些田间试验表明,在生态脆弱的矿区AM能够显著促进植物生长,改善土壤营养状况及微生物多样性,利于土壤及植被生态恢复[184-186]。也有发现,在煤矿区土壤中,AM真菌能够与豆科植物形成良好共生,这对于利用AM真菌及豆科植物修复煤矿废弃地具有重要意义[187]。虽然菌根修复离大面积推广应用还有较远的路,相关机理及应用层面还有众多问题亟待解决,但作为极具潜力的生态修复技术其在未来必有长足的发展。
5.3 重金属污染土壤的AM菌根修复技术原理
重金属污染土壤往往存在着诸多问题共同制约着植物生长。这些问题包括:①重金属复合污染严重,如许多矿区是多种重金属或重金属与有机污染物复合污染,而且污染程度高,对植物毒性大;②许多污染地带往往位于山区,土壤贫瘠,有机质含量低,而且养分不平衡,浇灌不方便,容易受干旱影响;③污染区土壤原有微生物区系结构受到扰动,有益微生物丧失,不利于构建适合植物生长的微生物群落等。因而,在应用菌根技术进行生态恢复时要综合考虑土壤污染现状及区域自然经济状况,选取合适的AM真菌与植物组合,同时可结合一些化学或生物措施强化修复效果。重金属污染土壤菌根修复技术原理总结见图2。
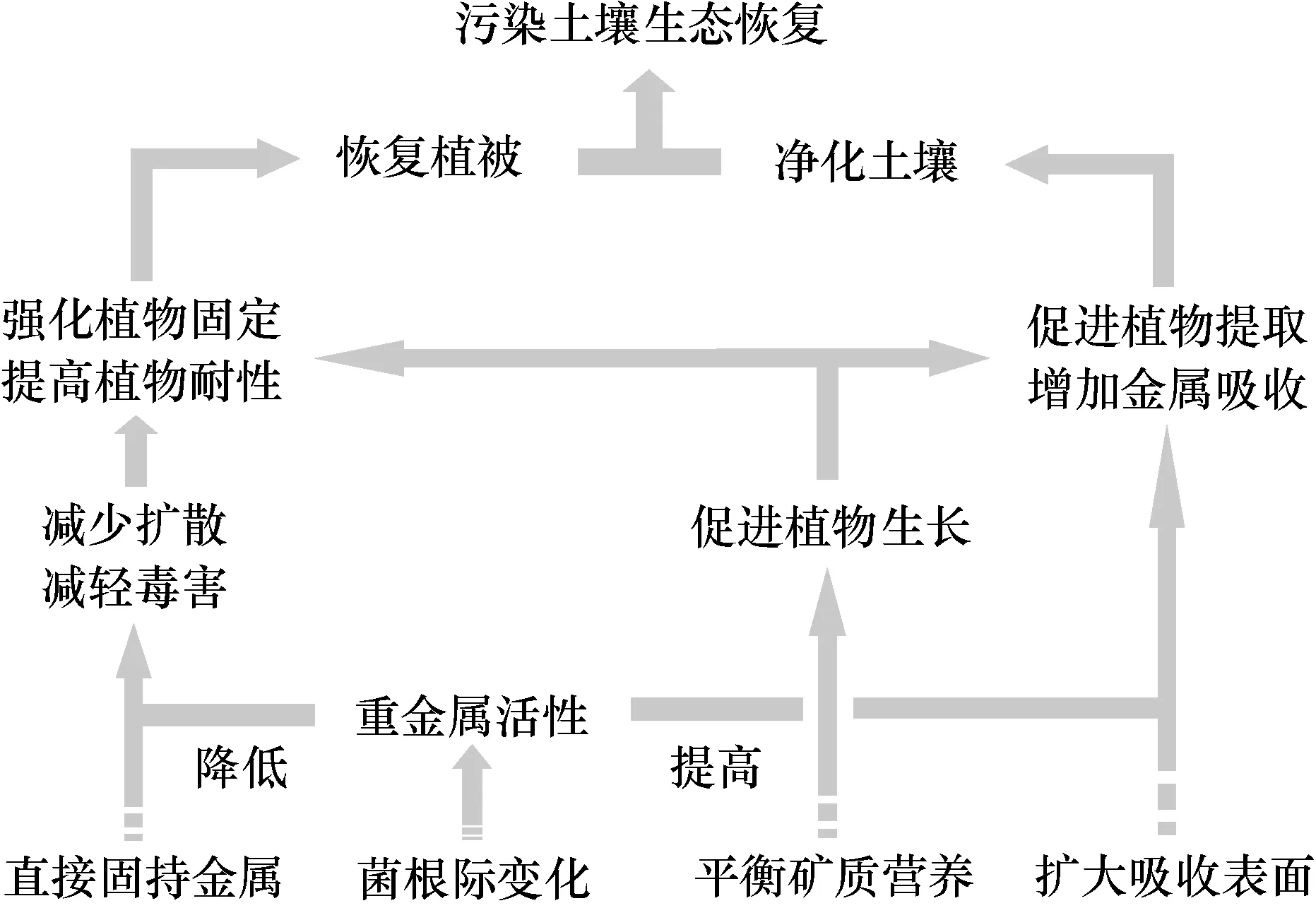
图2 重金属污染土壤AM菌根修复技术原理示意图Fig.2 AMF-assisted bioremediation of heavy metal conta-minated soils
应用菌根技术修复重金属污染环境首先要选取能够适应矿区土壤环境,对矿区主要污染元素具有较强修复功能的植物;其次,所选AM真菌要能够与所选植物形成良好共生关系且具有较强重金属耐性。相比商业菌剂,利用土著耐性AM真菌,或同时联合其他耐性土壤微生物强化植物修复的方法将具有特殊优势[58,72]。此外,如何利用群落生态学和生态系统生态学原理,合理选取不同植物和不同AM真菌菌群在修复污染土壤的同时最大程度恢复生态系统结构和功能,也是一个值得考虑的问题。
当然,任何一种修复技术都有自身的特点和最适应用范围。菌根修复受到植物及AM真菌自身生物学特性的限制,并不一定适用于所有矿区土壤的生物修复。例如,对于某些高磷土壤,AM的形成将会受到极大限制,进而影响其发挥作用[30]。另外,过高浓度重金属污染土壤将不适宜植物及AM真菌生存。因而,菌根修复技术有其自身的适用条件及范围:菌根修复往往适用于贫瘠土壤,而且在高污染尾矿区的修复中适宜作为物理化学修复技术的辅助技术措施。只有客观地认识到这一点,才能真正发挥菌根修复技术的优势。
6 结语与展望
作为与陆生植物关系最紧密的土壤微生物之一,AM真菌能够通过各种途径帮助宿主植物抵御逆境胁迫,并在退化生态系统生态恢复方面起着重要作用[188-189]。AM真菌深刻参与植物吸收、累积及耐受重金属的各个过程,因而在重金属污染土壤生物修复中也具有重要的潜在应用价值。然而,目前AM增强植物重金属耐性机制还需要更为深入系统的研究,AM在矿区污染土壤生态恢复中的应用还少有工程实践。因此,无论是在理论层面系统阐释AM植物适应重金属污染的机理,还是在应用层面实现菌根修复技术的大规模应用,都还有很长的路要走。当前需要重点关注以下几个问题。
6.1 AM植物重金属耐性关键影响因素研究
很多试验研究都发现,AM改善植物磷营养与增强植物重金属耐性密切相关。众所周知,AM真菌与宿主植物之间最基本的共生关系是一种碳-磷交换:植物为真菌提供碳水化合物,而真菌帮助植物摄取以磷为主的矿质养分。由此,我们提出一个值得思考的问题:植物与AM真菌之间的碳-磷交换效率是否是影响AM植物适应重金属污染胁迫的关键因素?进一步思考,在菌根共生体系中,植物和菌根真菌并非完全对等关系,植物作为宿主(Host)往往更具有主动性:接受或排斥AM真菌的侵染。这种情况下,AM真菌对植物磷营养的贡献可能对共生体系的互惠互利关系起到基础决定作用。据此,我们推测菌根共生体系磷营养效率(包括吸收、转运和传输效率)对其重金属耐受性可能具有决定性影响,因而有可能将AM真菌磷营养效率作为修复污染土壤高效菌株的筛选指标。磷营养高效菌株的表征指标体系则包括生物学(形态)、生理及功能基因(遗传)指征,具体哪些指标可作为主要考量参数,尚需进一步系统研究。当然,以上理论假设还需要系统的试验验证。同时,AM真菌自身对重金属的耐性也是不能忽视的因素。从重金属污染地带分离得到的耐性菌株是否具有遗传稳定性,还仅是一种表型可塑性,也是值得探究的问题。不管怎样,揭示AM植物适应重金属污染胁迫关键影响因素将会实质性推动菌根共生体系抗逆生理机制研究的进展和菌根应用技术的发展。
6.2 AM增强植物重金属耐性直接作用机理研究
限于研究条件,目前有关AM真菌对植物吸收累积重金属的直接作用机理普遍缺乏深度。以下几个方面可能是未来的研究热点。
(1)重金属在AM组织乃至细胞水平微区分布特征及赋存形态研究
这方面的研究对于阐明重金属在菌根共生界面的迁移转化具有重要意义,同时可为深入研究AM对重金属的解毒机制奠定基础。随着近年来同步辐射技术、荧光探针技术及能量散射X射线能谱法(EDXS)等技术的发展,原位无损测定AM组织及细胞结构中重金属的分布及形态已成为可能。
(2)AM真菌重金属耐性分子机制研究
这方面的研究主要包括两部分:一是AM真菌自身耐受重金属分子机制;二是重金属在AM真菌与宿主植物根系细胞之间转运的分子机制。该方面研究还处于起步阶段,目前已有相关的重金属转运、络合蛋白等基因从AM真菌中分离[156]。然而已有研究多关注模式种的耐性机理研究,缺乏对土著菌株耐性分子机理研究,同时在AM真菌重金属耐性分子遗传稳定性方面研究还鲜有报道。相信随着分子生物学技术的不断发展,AM真菌基因组研究工作的日臻完善,AM真菌耐重金属分子机制将逐步得以揭示。
(3)AM对植物重金属吸收及抗性分子和生理过程调控作用研究
已有研究者[140,143,146-147]观察到AM诱发植物对重金属胁迫的生理和分子响应往往与AM改变植物体内重金属浓度、改善植物矿质营养状况存在密切联系,故很难区分AM对植物抗逆机制的直接和间接调控作用。如何厘清AM对植物吸收累积重金属的影响、对植物矿质营养的改善,以及增强植物专性抗逆机制之间的关系,如何验证AM对植物自身重金属响应系统的调控作用,最终实现系统阐释AM植物适应重金属胁迫的分子机制,将成为未来研究的重要突破口。
6.3 重金属污染土壤菌根修复技术应用研究
目前菌根修复技术研究多限于室内模拟条件下单一重金属污染情况,难以应对自然环境中复杂的土壤、生物、气候及多种逆境胁迫并存的环境,而且现有研究多以模式植物和菌种为试验材料,而更具环境友好性的土著耐性菌种研究较少。因而,未来的研究需要加强田间试验研究,重视对土著菌种的分离和应用。同时,也要充分认识到菌根修复技术的适用条件及范围,将菌根修复技术与物理化学修复技术有机结合,最大限度发挥菌根的积极作用,在治理污染的同时恢复污染地带生态系统结构和功能。相信,随着相关机理及应用研究的不断进展,菌根修复技术将会有更广阔的的发展前景。
