太湖西北湖区2003—2012年间氮磷浓度及浮游植物主要类群变化趋势分析
2019-02-21张建云陈求稳施文卿孙秋根
王 敏,张建云,,陈求稳,*,施文卿,孙秋根
1 水文水资源与水利工程科学国家重点实验室,南京 210012 2 南京水利科学研究院生态环境研究中心,南京 210024 3 水利部应对气候变化研究中心,南京 210024
浮游植物作为水生态系统的主要初级生产者之一,可以通过光合作用将无机物转化为有机物,从而开启食物网能量流动,在水生生态系统的正常运行中起着至关重要的作用[1-2]。浮游植物群落结构受水体理化因子与生物因子的双重影响,光照强度、温度、营养盐及浮游动物牧食等条件的改变都会引起浮游植物群落结构的变化[3-5]。蓝藻是淡水湖泊浮游植物群落中较为常见的物种,对环境气候条件的适应性较其他藻类更强,能够迅速在群落中占据优势,大量繁殖并上浮至表层水体,聚集形成水华。近年来,不断扩张的蓝藻水华已成为全球性的重大环境问题之一。水华暴发时,蓝藻聚集堆积在水面上,造成水体透明度迅速下降,溶解氧降低,并散发出难闻的腥臭味,严重影响生态景观及居民日常生活;水华末期,藻细胞大量衰亡,引起水质急剧恶化;同时,大量细胞内毒素的释放严重影响水生动植物的生存,并对人类的饮用水安全构成威胁[6]。
目前,国内外学者普遍认为氮磷释放导致的水体富营养化是蓝藻水华的主要诱因,并在此基础上开展了大量的研究工作,试图阐明氮、磷营养盐与浮游植物群落结构演替及蓝藻水华间的关系。研究表明,磷是淡水系统中浮游植物生长最为关键的限制因子,磷浓度的增加使蓝藻在浮游植物群落演替中获得竞争优势,显著促进蓝藻水华的发生[7-8]。同时,当水体中磷源充足时藻类的生长也受到氮源的限制[9]。此外,温度也是影响浮游植物群落结构变化的重要因素,温度的上升导致蓝藻成为优势种,快速大量增殖形成水华[10-11]。过去30年以来,众多湖泊实施了大规模水环境治理,入湖污染负荷得到较好控制,湖体营养盐水平出现一定程度持续下降,但蓝藻水华却日益严重,并表现出强度大、时间早、持续长的特点,引起了学者和管理者的广泛关注[12-13]。
本研究利用太湖多站点水体理化与浮游植物序列数据,分析2003—2012年间太湖水温、氮磷营养盐和浮游植物丰度及组成的变化规律,阐明浮游植物主要类群和蓝藻水华动态变化特征及其影响因素,力图回答两个假设:(1)气候变暖是否在一定程度上影响了营养盐控制产生的控藻效果?(2)未来营养盐控制策略包括浓度水平和结构是否需要调整?
1 材料与方法
1.1 研究区域概况
太湖位于长江三角洲核心区域的太湖平原上,地跨江苏、浙江两省,东连苏州,南濒湖州,西接宜兴、长兴,北临无锡,流域总面积36500 km2,属亚热带季风气候区,四季分明,雨水丰沛,热量充裕。太湖水域面积2338 km2,最大水深2.6 m,平均水深1.9 m,是典型的平原浅水湖泊,入湖河流主要集中在湖区西北方向的无锡市区以及常州武进地区、宜兴地区,占入湖径流总量的83%,出湖河流集中在湖区东南部的湖州、苏州地区[14]。
根据太湖水环境特征,共划分竺山湖、梅梁湾、贡湖湾、湖心区、东太湖、西部沿岸区、南部沿岸区和东部沿岸区8个湖区,其中竺山湖和西部沿岸区两个湖区上游流域工农业发达,港口众多,入湖水量及入湖污染物通量最高,对太湖整体水质状况影响较大。
1.2 数据情况
图1 太湖监测点位布设Fig.1 The distribution of sampling sites in Lake Taihu
研究采用了2003—2012年间竺山湖和西部沿岸区两个湖区共4个监测点(图1)的水温、氮磷营养盐及浮游植物的逐月监测数据,其中,氮磷营养盐指标包括总氮(TN)、氨态氮(NH3-N)、硝酸盐氮(NO3-N)和总磷(TP);浮游植物指标包括丰度和主要组成类群。样品采集于每月月中进行,现场使用便携式水质参数测定仪原位测定水温;使用有机玻璃采水器采集水下0.5 m处水样3次,均匀混合后取1 L水样避光冷藏保存后尽快送至实验室用于氮磷营养盐浓度测定,另取1 L水样现场加入15 mL鲁哥氏液固定浮游植物,带回实验室静置48 h后浓缩至100 mL用于浮游植物鉴定。营养盐浓度分析参照相关国家标准进行[15],用紫外分光光度法测定TN及NO3-N,水杨酸-次氯酸盐光度法测定NH3-N,钼酸铵分光光度法测定TP。浮游植物鉴定参照《中国淡水藻志》、《淡水浮游生物图谱》和《中国淡水生物图谱》[16-18]进行,将浓缩样品摇匀后随机取0.1 mL加入20 mm×20 mm计数框内置于显微镜下进行浮游植物计数及种类鉴定。
1.3 数据处理
基础数据统计在Excel中完成,两个湖区内氮磷营养盐浓度和浮游植物丰度为该湖区内各监测点的平均值。根据太湖流域气象环境特征,氮磷营养盐及浮游植物季节变化为春(3—5月)、夏(6—8月)、秋(9—11月)、冬(12—2月)4个季节内各月平均值,年平均变化为全年各月平均值。采用SPSS Statistics 22.0对浮游植物丰度和环境因子进行相关性分析,分析前用K-S方法检验各变量是否满足正态分布,不满足正态分布的变量进行Log(X+1)转化。
2 结果
2.1 氮磷营养盐浓度变化
2003—2012年竺山湖和西部沿岸区氮磷营养盐浓度变化如图2所示。总体上,竺山湖TN浓度呈春冬季高于夏秋季的趋势,且10年间春、夏、秋、冬四季TN浓度均显著下降,分别由2003年的8.54、5.04、5.83 mg/L和8.52 mg/L下降至2012年的5.92、2.59、2.74 mg/L和5.75 mg/L。年均TN浓度自2004年的7.30 mg/L下降至2009年的4.28 mg/L,后基本维持恒定。竺山湖NH3-N和NO3-N浓度的季节变化趋势与TN相同,10年间各季节及年均NH3-N浓度均显著下降,但是NO3-N浓度却有所上升,无机氮主要形态由NH3-N逐渐转变为NO3-N。西部沿岸区TN、NH3-N和NO3-N浓度季节变化特征与竺山湖类似,均呈现春冬季高于夏秋季的趋势,但西部沿岸区无机氮形态始终以NO3-N为主。10年间西部沿岸区各季节及年均TN和NH3-N浓度总体略有下降,至2012年TN和NH3-N年均浓度分别下降至2.27 mg/L和0.32 mg/L;同时,各季节及年均NO3-N浓度总体显著下降,NO3-N年均浓度由2003年的1.66 mg/L下降至2012年的0.75 mg/L。竺山湖TP浓度季节变化趋势与TN相反,呈现夏秋季高于春冬季的趋势,10年间各季节内TP浓度虽上下波动,但总体有所下降,特别是夏季,由2004年的0.37 mg/L下降至2012年的0.19 mg/L。TP年均浓度在2003—2011年间有所波动,自0.24 mg/L下降至0.13 mg/L,2012年上升至0.19 mg/L。西部沿岸区TP浓度季节变化不显著,各季节及年均TP浓度均呈先上升后下降的趋势,但变化范围均较小,TP年均浓度2003—2008年间自0.10 mg/L上升至0.17 mg/L,后逐渐下降至2012年的0.10 mg/L。
两个湖区内TN/TP总体表现为春季>冬季>夏、秋季,各季节及年均TN/TP随时间略有波动,总体呈下降趋势。2004—2012年竺山湖春、秋、冬季TN/TP显著下降,分别由56.0、57.3、69.5下降至38.8、12.4、39.0,年均TN/TP由51.9下降至26.1。10年间西部沿岸区春季TN/TP波动较大,变化范围为35.1—71.5,秋季TN/TP则相对稳定,变化范围为15.9—29.5,年均TN/TP在2003—2008年为32.6—39.8,2009—2012年由45.5逐年下降至24.4。
2.2 浮游植物丰度及主要类群变化
10年间竺山湖和西部沿岸区浮游植物丰度季节变化表现为夏秋季大于春冬季,且秋季浮游植物丰度随时间显著增加(图3)。两个湖区的年均浮游植物丰度总体均呈上升趋势,2003—2006年间,竺山湖和西部沿岸区年均浮游植物丰度略有增加,变化范围分别为2140.2×104—2396.2×104个/L和764.0×104—1400.5×104个/L;2007—2012年间,两个湖区的年均浮游植物丰度均随时间有所波动,尤其是竺山湖,但总体上均显著高于2003—2006年。至2012年,竺山湖和西部沿岸区年均浮游植物丰度分别上升至5293.2×104个/L和3802.8×104个/L。

图3 2003—2012年竺山湖和西部沿岸区浮游植物丰度变化Fig.3 Variations of phytoplankton abundances in Zhushan Bay and West Coast of Lake Taihu during 2003—2012

图4 2003—2012年竺山湖和西部沿岸区浮游植物主要类群变化Fig.4 Annual variations of phytoplankton community structure in Zhushan Bay and West Coast of Lake Taihu during 2003—2012
10年间竺山湖和西部沿岸区浮游植物主要类群变化显著(图4)。2003—2006年,两个湖区蓝藻在浮游植物群落中所占比例分别为17.6%—55.4%和18.9%—39.1%,浮游植物主要种类为绿藻或蓝藻;2007—2012年,竺山湖蓝藻占比为74.0%—90.4%,西部沿岸区蓝藻占比为83.3%—87.5%,两个湖区内浮游植物均以蓝藻为绝对优势种群。
2.3 浮游植物群落结构变化与环境因子的关系
不同种类浮游植物与环境因子的相关关系如表1所示。蓝藻及其在浮游植物中所占比例与水温呈显著正相关(P<0.01),与TN/TP呈显著负相关(P<0.01)。如图5所示,2003—2012年两个湖区年均水温总体呈上升趋势,且年均水温与年均蓝藻丰度线性正相关(P<0.01)。此外,2003—2012年两个湖区蓝藻丰度与TN/TP的逐月监测数据表明(图6),TN/TP的下降往往伴随着蓝藻丰度升高,10年间随着TN/TP的总体下降,蓝藻丰度显著上升。
目前,大多数学者普遍认为,蓝藻水华是在富营养化水体中蓝藻丰度超过1500×104个/L,并在水面形成一层蓝绿色或有恶臭的浮沫[19]。如图6所示,2003—2012年竺山湖和西部沿岸区蓝藻丰度超过水华阈值的时间逐渐提前至4月,而下降至水华阈值以下的时间则逐渐滞后,12月份气温大幅度下降后蓝藻丰度仍然较高。10年间太湖水华呈现出暴发时间提前、暴发频次上升、持续时间延长达6—8个月的趋势。

表1 浮游植物丰度与环境因子的相关关系
*P<0.05,**P<0.01;蓝藻占比:蓝藻在浮游植物群落中所占比例;WT:水温,Water temperature;TN:总氮,Total nitrogen;NH3-N:氨态氮,Ammonium;NO3-N:硝酸盐氮,Nitrate;TP:总磷,Total phosphorus
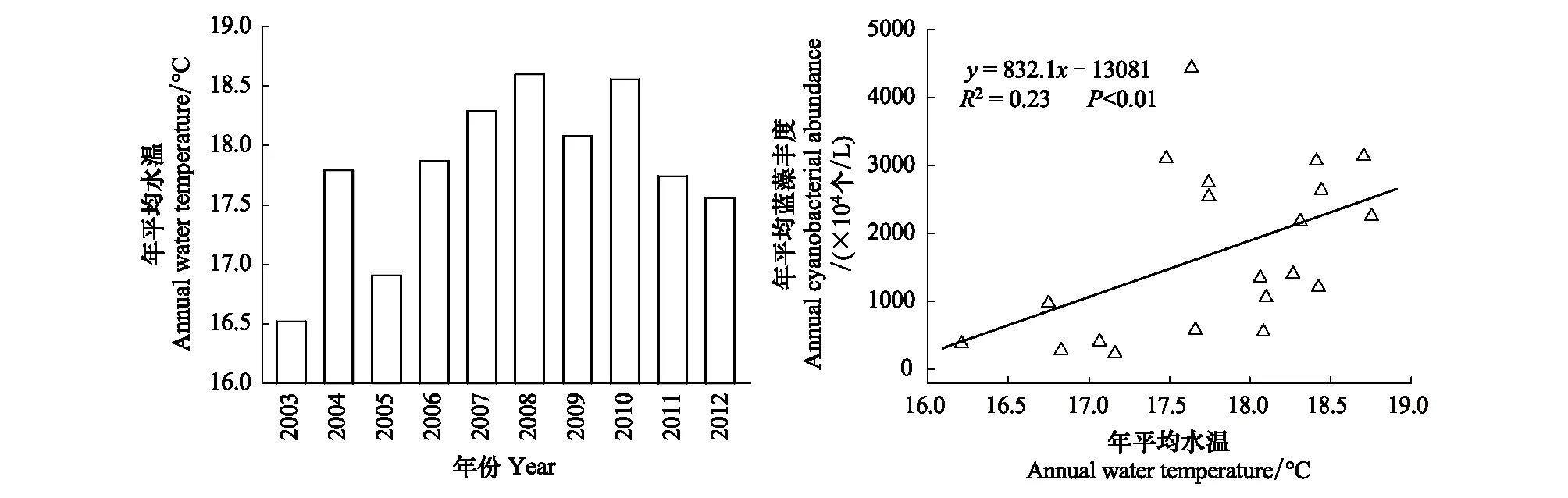
图5 2003—2012年年平均水温的变化及其与蓝藻丰度的关系Fig.5 Annual variations of water temperature during 2003—2012 and its relation with cyanobacterial abundance

图6 2003—2012年竺山湖和西部沿岸区蓝藻丰度及TN/TP月变化Fig.6 Monthly variations of cyanobacteria abundance and TN/TP in Zhushan Bay and West Coast of Lake Taihu during 2003—2012
3 讨论
太湖是我国第三大淡水湖泊,流域内自然条件优越、物产丰富、经济发达、人口密集[20]。伴随着流域内经济快速发展,人口大规模增长,高强度的人类活动造成入湖氮磷负荷急剧增加,湖泊富营养化日益严重,1987年左右已进入富营养化状态[21]。20世纪90年代后期,太湖治理受到高度重视,入湖污染物开始得到一定程度的控制。本研究中,2003—2012年竺山湖和西部沿岸区氮磷浓度水平均有所下降,特别是2007年后,除竺山湖NO3-N年均浓度略有上升外,两个湖区氮磷年均浓度均显著下降。这是由于2007年无锡突发饮用水污染事件后,相关部门开展了一系列综合治理工作,如流域内产业转型升级、截污纳管和生态修复,一定程度上控制了外源营养盐的输入。由于竺山湖周边工业区众多,且主要以纺织、化工、机械、电子信息等高氨氮污染产业为主[22],所以竺山湖NH3-N污染程度显著高于西部沿岸区。但是,10年间竺山湖NH3-N浓度显著下降,2011年NH3-N年均浓度不足2004年的20%,这可能是由于湖区上游流域工业点源污染治理不断加强,同时污水处理率及处理效果不断提高,导致入湖水体中NH3-N浓度得到有效控制。从季节变化来看,两个湖区氮浓度总体表现为春冬季节高于夏秋季节,而TP浓度则呈相反的趋势。就氮而言,首先春冬季节降水较夏秋两季少,湖泊水位相对较低,入湖污染物浓度稀释作用较弱,而且温度的下降导致水体中微生物活性减弱,反硝化速率降低,不利于脱氮[23];其次,两个湖区上游农业发达,春季化肥的大量施用导致湖泊氮营养盐输入急骤增加[24]。夏秋两季,特别是夏季TP浓度的升高则与太湖内源磷污染的释放有关,夏季水华暴发时藻类光合作用增加,导致水体pH升高,致使底泥中内源磷释放量增加[25-26]。
2003—2012年竺山湖及西部沿岸区浮游植物丰度总体呈上升趋势,且蓝藻在浮游植物群落中逐步占据绝对优势。相关性分析结果表明,10年间两个湖区浮游植物丰度及主要类群的变化受到水温和营养盐的共同影响。蓝藻丰度及其在浮游植物中所占比例与水温呈显著正相关(P<0.01),且10年间随着年平均水温的升高蓝藻丰度总体呈上升趋势,而其他浮游植物种群与水温相关性不强,说明温度的升高是蓝藻丰度显著增加并形成优势的重要原因之一。与其他浮游植物相比,蓝藻对高温的耐受力强,最适生长温度为25—30℃,远高于绿藻(20—25℃)和硅藻(14—18℃)[27-28],微囊藻甚至在水温超过35℃时仍能正常生长[23],一般当水温超过20℃时,蓝藻就已经开始表现出生长优势[29-30]。同时,温度与蓝藻水华的发生息息相关,春季温度的升高会促进水华蓝藻种群优势地位的更早确立,夏季的高温会加剧水华暴发的强度,秋季的高温会引起水华消退时间的滞后,而冬季温度的升高则为来年水华蓝藻的复苏蓄积了能量[31-33]。因此,10年间两个湖区蓝藻水华强度及暴发频次的增加可能与水温的升高有关。10年间氮营养盐,特别是NH3-N浓度的下降也是蓝藻获得竞争优势的重要原因。相关性分析结果表明,蓝藻丰度及其在浮游植物中所占比例与氮营养盐浓度呈显著负相关(P<0.01),而其他浮游植物种群与氮营养盐浓度则呈正相关关系(P<0.05或P<0.01)。与其他浮游植物相比,蓝藻生长需要的氮浓度更低,对氮的竞争能力更强[34],当表层水体氮浓度降低时,蓝藻可以下沉到底部寻找营养物质[35];当外源氮浓度不足时,部分蓝藻能够固定大气中游离态的氮以获得充足的营养,所以氮浓度的下降对其他浮游植物的限制作用多于蓝藻。同时,各种藻类丰度与NH3-N的相关性均高于NO3-N,这是由于浮游植物优先选择利用还原态的NH3-N来降低自身的能量消耗[23]。蓝藻丰度与NH3-N浓度的负相关性则是因为蓝藻的大量增殖消耗了水体中的NH3-N,导致了NH3-N浓度的下降。然而,随着蓝藻丰度的上升,呼吸作用的增强造成水体溶解氧下降,促进了底泥中NH3-N的释放[36];并且消亡的藻类提供了大量有机氮,通过细菌氨化作用转化为NH3-N,补入的NH3-N又能导致蓝藻生物量的进一步上升[37-38],致使NH3-N在蓝藻水华暴发期始终处于相对较低水平。
本研究中,各种藻类丰度与TP均存在正相关关系,而蓝藻在浮游植物中所占比例与TP不相关,说明10年间TP浓度的变化不是导致蓝藻成为绝对优势种的原因。这主要是因为,尽管10年间竺山湖TP浓度有所下降,但仍远高于限制藻类生长的阈值,两个湖区内TP浓度在多数情况下均超过0.1 mg/L,磷已不再是影响浮游植物生长和群落结构变化的主要因子。此外,蓝藻丰度及其在浮游植物中所占比例与TN/TP呈显著负相关(P<0.01),且两个湖区蓝藻丰度与TN/TP的逐月监测数据具有良好的反向对应关系。目前,关于氮磷比与蓝藻水华之间的关系并没有一致的结论。Smith[39]的低氮磷比学说认为蓝藻水华时TN/TP应小于29,而也有研究表明,无论TN/TP是否小于29,都会有水华发生,氮磷比的下降是由于蓝藻对氮的吸收速率比磷快,同时水华期间反硝化作用的加强带走了大量的氮,而藻类光合作用引起的水体pH升高却造成了磷浓度的下降,所以氮磷比的降低不是水华的原因,而是水华的结果[40-42]。本研究中,每年夏秋季节TN/TP下降至全年最低时,蓝藻生长旺盛发生水华,但二者间的对应关系并不表现在一个确定的值上。同时,从长时间序列来看,两个湖区在不易发生水华的春冬两季,TN/TP与蓝藻丰度间也有良好的对应关系,10年间随着春冬季节TN/TP的逐年下降,蓝藻丰度逐年上升。以往的研究也表明,硅藻和绿藻均喜欢生长在氮磷比较高的水体中,而低氮磷比条件下蓝藻易于形成优势[43-44]。所以,10年间氮磷比的下降在一定程度上影响了浮游植物群落结构的改变,促进了蓝藻优势。
4 结论
(1)2003—2012年太湖竺山湖和西部沿岸区氮磷浓度水平均有所下降,其中竺山湖TN、NH3-N浓度和西部沿岸区NO3-N浓度下降显著。
(2)2003—2012年太湖竺山湖和西部沿岸区浮游植物丰度总体呈上升趋势,尤其秋季浮游植物丰度随时间显著增加;浮游植物主要类群变化显著,蓝藻成为绝对优势种群,且水华暴发时间逐渐提前,消退时间逐渐滞后,水华持续时间逐年上升。
(3)10年间两个湖区浮游植物丰度及主要类群的变化受到水温和营养盐的共同影响,水温的升高及NH3-N浓度和TN/TP的下降是蓝藻丰度增加并形成绝对优势的关键原因。在温度和营养盐的共同作用下,10年间两个湖区水华暴发强度及持续时长逐渐增加,在全球气候变暖背景下,太湖水华治理需采取更加严格的营养盐限制标准,且在重污染的西北部湖区控磷依然是关键。
