低温和摄食对虹鳟脂肪酸合成基因表达的影响❋
2019-02-21刘骋跃周演根孙大江高勤峰董双林
刘骋跃, 周演根, 孙大江, 高勤峰, 董双林
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003; 2.中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广东省应用海洋生物学重点实验室,广东 广州 510301)
鱼类作为变温动物,周围环境温度的变化可以显著影响其生长发育,因此温度被视为是鱼类整个生活史中最重要的非生物因素。低温通常会造成重要养殖鱼类生长停滞甚至死亡,如罗非鱼(Oreochromisniloticus)[1]、大黄鱼(Larimichthyscrocea)[2]、点带石斑鱼(Epinepheluscoioides)[3]及大西洋鲑(Salmosalar)[4]等。
为了应对低温带来的不利影响,鱼类会做出一列生理生化以及行为上的响应。生物膜磷脂是迄今为止发现的温度适应过程可以发生补偿重组的结构成分,生物膜结构的重组是鱼类等变温动物对温度变化的普遍应答方式[5-7]。很多研究已经证明,当周围环境温度降低时,鱼类生物膜磷脂sn-1位置中饱和脂肪酸比例下降而单一不饱和脂肪酸的比例上升,sn-2位置中长链多不饱和脂肪酸(尤其是DHA和EPA)的比例上升,这一过程也被称作“膜脂相变理论”[8-10]。这是由于相对于饱和脂肪酸,其同源的不饱和脂肪酸的熔点较低并且在膜结构中占据的空间更大,从而使生物膜结构的流动性增加以此降低低温带来的不利影响[8-11]。
不同鱼类主要通过两种方式来改变磷脂中各种脂肪酸的比例,一种途径是通过去饱和酶和延长酶的交替作用逐步生成单一不饱和脂肪酸和多不饱和脂肪,主要出现在海水鱼当中,另一种途径是通过脱酰作用和重酰化作用将目的多不饱和脂肪酸(Polyunsaturated fatty acid, PUFA)和单一不报饱和脂肪酸(Monounsaturated fatty acid, MUFA)取代磷脂中的饱和脂肪酸(Saturated fatty acid, SFA),主要出现在淡水鱼当中[12-13]。
硬脂酰辅酶A脱氢酶(Stearoyl-coenzyme A desaturase,SCD)可以将饱和脂肪酸(如硬脂酸,18:0)转化为单一不饱和脂肪酸(如油酸,18:1n9)[2, 14]。在包括鱼类的脊椎动物中长链多不饱和脂肪酸(如ARA,EPA和DHA)的合成则是由C18脂肪酸(如亚油酸,18:2n6;亚麻酸,18:3n3)在去饱和酶(Fatty acid desaturase, Fads)和延长酶(Elongation of very long chain fatty acids like, Elovl)的交替作用下完成的[15-19]。
虹鳟是世界上养殖国家最多的鲑鳟鱼类,由于其具有较少的肌间刺、富含蛋白质和不饱和脂肪酸因而受到人们的喜爱[20]。近年来,虹鳟在中国的养殖产量逐年递增,但是由于中国北方地区冬季温度过低,可能会引起虹鳟的停食甚至死亡,造成一定的经济损失。虹鳟作为一种洄游性鱼类,整个生活史涉及到了淡水和海水环境,因而其具有独特的脂质代谢途径。本研究通过研究低温和摄食对虹鳟肝脏和肌肉中不饱和脂肪酸合成相关基因的影响,探究其低温适应机制,为虹鳟的成功越冬提供一定的理论依据,以此优化虹鳟的养殖技术体系。
1 实验材料和设计
1. 1 实验材料
实验材料为三倍体虹鳟((96.56 ± 8.71) g),实验时间:2017年9月21日~10月4日,实验用鱼取自日照市万泽丰渔业有限公司鲑鳟鱼类繁育基地。
1.2 实验设计
实验共分为4个处理组:低温摄食组(CF)、低温不摄食组(CU)、正常温度摄食组(NF)和正常温度不摄食组(NU),每个处理组设置3个重复每个水缸277 L(高:58 cm,半径:39 cm)放置20尾鱼。低温组水温为6 ℃(以1 ℃/2h的降温速度将水温由16 ℃降到6 ℃),正常温度组水温为16 ℃;摄食组每天投喂量占总体重的2%,不摄食组每天投喂量为0。根据前期实验结论可知,鲑鳟鱼类(硬头鳟和大西洋鲑)适应低温过程中,其生物膜磷脂脂肪酸的补偿重组可以在7 d内完成,因此,本实验将采样时间点定为第1、3、5、7和14天。
1.3 实验条件
本实验地点在中国海洋大学鱼山校区水产养殖生态学实验室(海水养殖教育部重点实验室)。实验开始前,将实验鱼类在实验室条件下((16 ± 0.5) ℃)暂养2周。暂养和实验过程中摄食组每天投喂2次(投喂时间:8:00和18:00),饵料为商品饲料(七好鲑鳟鱼饲料)。在投喂2 h后利用虹吸的方式将残饵粪便吸出,以保证水质。实验水温通过设定温控系统(ZKH-WK2000,中科海水处理公司,中国)达到,波动范围控制在±0.5 ℃。水缸上覆有纱网,防止实验鱼类跃出。每个水缸配有2个气石并24 h曝气,使水中溶解氧处于近饱和状态(>6 mg/L)。每天换水量为水缸总体积的1/2。光照周期为12 h光照:12 h黑暗。pH始终维持在7.8±0.3,氨氮、硝氮和亚硝氮的含量均低于1 mg/L。
1.4 样品采集
在投喂后4 h开始采样,每次采样每缸取3尾鱼,共48尾(每个重复12尾鱼)。取样前先用麻醉剂(MS-222,阿拉丁,中国;70 mg/L)将鱼麻醉,然后采集背肌、鳃丝和肝脏样品并放入液氮中,采样结束后样样品转移至超低温冰箱(-80 ℃)(New Brunswick Scientific, Edison, New Jersey, USA)保存。
1.5 虹鳟肝脏和肌肉中SCD、Δ6 Fad和Elovl2 mRNA表达水平的检测
1.5.1 引物的设计与合成 在NCBI(https://www.ncbi.nlm.nih.gov/nuccore)数据库中找到虹鳟SCD、Δ6Fad、Elovl2和β-actin的基因序列,然后通过软件Primer Premier 5.0设计引物,引物序列见表1。设计完成后的因为由北京擎科公司进行合成。
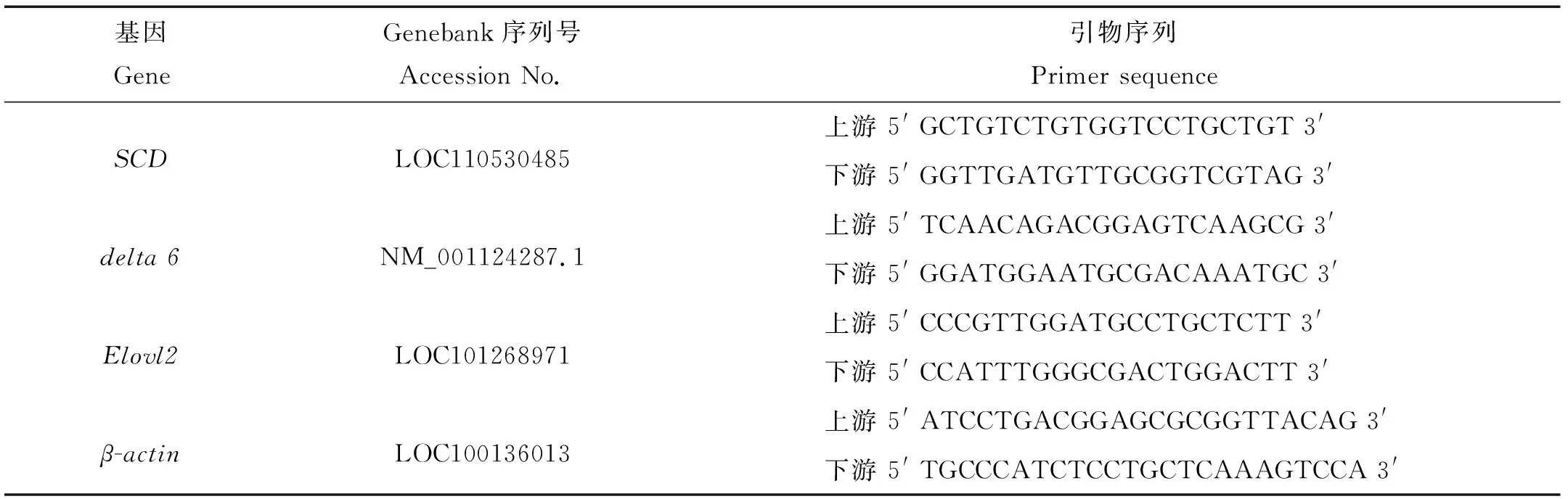
表1 实时定量PCR设计引物Table 1 Gene-special primers used in the real-time quantitative reverse-transcription PCR
1.5.2 虹鳟肝脏、肌肉和鳃中RNA提取和cDNA合成
(1)将1 mL TRIzol试剂加入1.5 mL EP管中,然后加入50 mg左右组织样品放,用匀浆仪(Tissuelyser-192,上海净信;50 Hz, 1 min)进行匀浆处理。
(2) 将匀浆后的组织样品样品加入200 μL 氯仿,剧烈震荡15 s,室温静置2 min后离心(4 ℃,12 000 r/min,15 min)。样品分为3层:底层为黄色有机相,上层为无色水相和一个中间层。
(3)将上层水相转移到新的1.5 mL EP管中,加入等体积的异丙醇,室温静置10 min后离心(4 ℃,15 000 r/min,15 min)。离心后在管侧和管底出现胶状沉淀。
(4)弃上清液,然后用预冷的75 %乙醇 1mL反复吹打洗涤后离心(4 ℃,8 000 r/min,5 min)。
(5)把水相转移到新管中,如要分离DNA和蛋白质可保留有机相,进一步操作见后。用异丙醇沉淀水相中的RNA。每使用1 mL TRIzol加入0.5 mL异丙醇,室温放置10 min。弃上清液然后在滤纸上晾干。
(6)加0.1 % DEPC水100 μL溶解。
(7)测OD260,计算RNA的浓度。
(8)测OD260/OD280 的比值,判定RNA的纯度,然后采用琼脂糖凝胶电泳判定RNA的完整度。
(9)选取合适的RNA样品,将得到的RNA反转录成cDNA根据反转录试剂盒说明书进行反转录。
1.5.3 基因表达量的检测 采用StepOnePlusTMReal-time PCR系统(Applied Biosystems, USA)进行测定,使用专用的荧光定量试剂盒(TaKaRa,Japan),实时荧光定量PCR的反应体系见表2。反应条件是为:95 ℃预变性,30 s;95 ℃变性,5 s;58 ℃退火,34 s;该程序循环40次。

表2 实时定量PCR的反应体系Table 2 PCR of reaction system
1.5.4 基因相对表达量的计算 ΔΔCt 法是实时荧光定量 PCR分析基因表达相对差异中较为常用的方法。PCR扩增信号进入到相对稳定对数增长期时的荧光值即是阈值,而Ct值是PCR循环到达阈值时所需要的循环数。本试验的Ct值是由PCR仪自动给出。以GADPH为内参照,目的基因在处理组中相对于对照组的ΔΔCt 值是由下列公式求得:
ΔΔCt= (Ct目的基因-Ct参照基因)处理组- (Ct目的基因-Ct参照基因)对照组。
处理组中目的基因相对于对照组表达水平的变化是由下列公式求得:
目的基因表达水平的差异倍数=2-ΔΔCt。
1.6 数据处理
数据以平均值±标准差(Mean ± SD)表示。采用SAS 9.4(SAS Institute Incorporated,Cary,North Carolina,USA)统计软件对实验数据进行单因素方差分析,并检验数据是否呈正态分布以及是否方差齐,如果方差齐则采用SNK(Student-Newman-Keuls)多重比较法分析,如果方差不齐则采用Dames-Howell法。以P<0.05表示为有显著相关性。
2 实验结果
2.1 SCD mRNA在肝脏中的表达情况
图1表示同一时间不同处理和同一处理不同时间SCDmRNA在肝脏的相对表达量。在14 d以前,不摄食组显著高于摄食组且CU组高于NU组。NF组在4个处理组中表达量最低(P<0.05)。在第14天,表达量最高的是NU组,其次是CF组,NF组和CU组最低。由图1 B可知,随着实验时间的增加,NF组和NU组变化不显著(P>0.05);CF组在3 d时SCD的表达量显著上升(P<0.05),但在第5天显著下降(P<0.05),此后变化不显著(P>0.05)。CU组在5 d之前SCD的表达量一直较高,在第7天后开始显著下降(P<0.05),第14天时表达量最低。
2.2 Δ6 Fad mRNA在肝脏中的表达情况
图2表示同一时间不同处理和同一处理不同时间Δ6FadmRNA在肝脏的相对表达量。由图2 A可知,在5 d以前,Δ6FadmRNA的表达量在低温组显著高于正常温度组(P<0.05),在14 d时,CU组最低。在第7天时,CF组显著高于其他3个处理组(P<0.05);在第14天时,CU组显著低于正常温度组(P<0.05),而CF组显著高于正常温度组(P<0.05)。由图2 B可知,随着实验时间的增加,NF组变化不显著(P>0.05);NU组在7 d后出现显著下降(P<0.05);CF在第3天显著上升(P<0.05),然后在第5天显著下降(P<0.05),在7 d后变化不显著(P>0.05);CU组在第3天后显著下降,第7天后变化不显著(P>0.05)。
(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理SCDmRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间SCDmRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05)。Data were presented as mean ± SD (n=3). NF: Normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: Cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05). )
图1 温度和摄食对虹鳟肝脏组织SCDmRNA表达的影响
Fig.1 The effect of temperature and feeding on the level ofSCDmRNA in liver
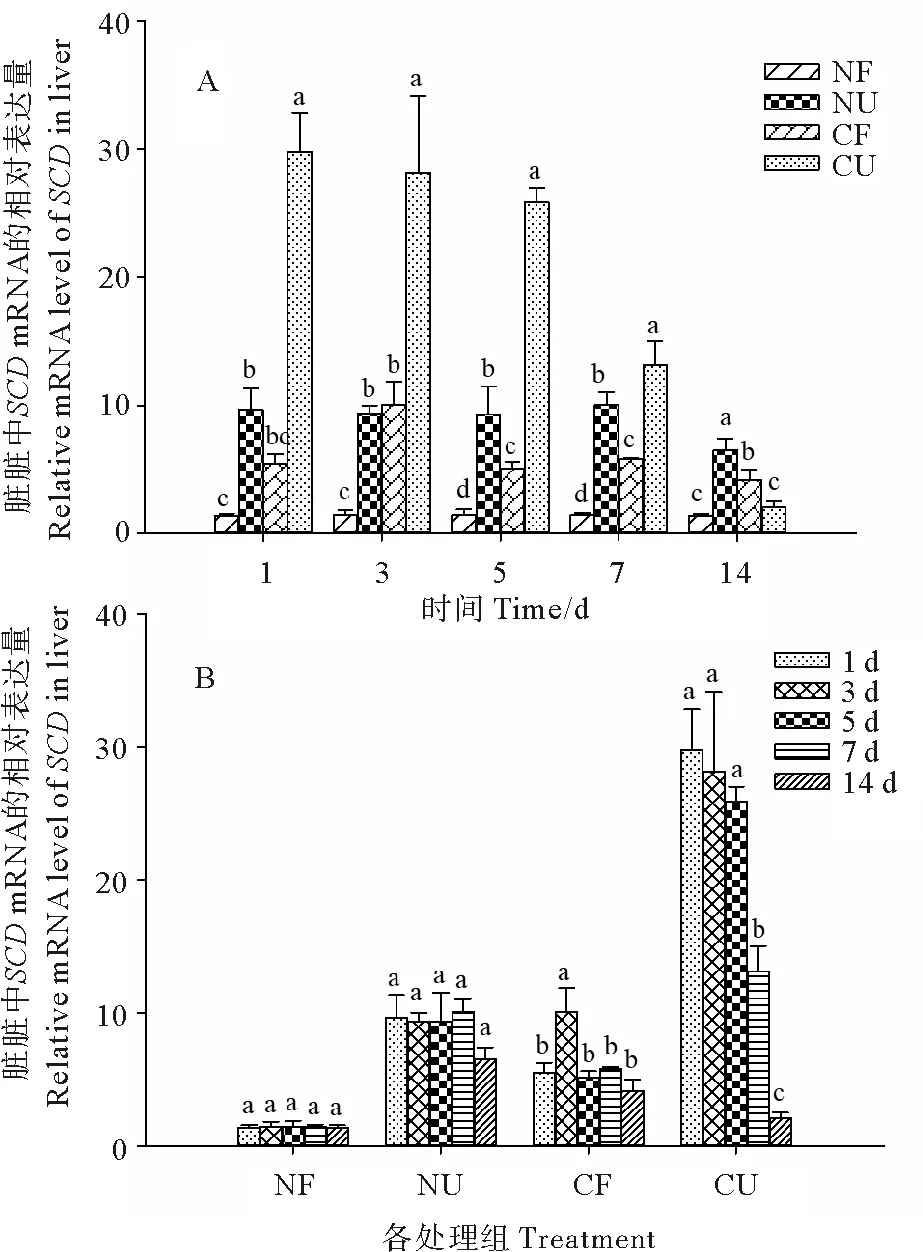
2.3 Elovl2 mRNA在肝脏中的表达情况
图3表示同一时间不同处理和同一处理不同时间Elovl2 mRNA在肝脏的相对表达量。由图3 A可知,除第7天外,CF组中Elovl2 mRNA的表达量在4个组中最高,而NF组最低。在第7天时,NU组表达最高;在第14天时,CU组和NU组与NF组差异不显著(P>0.05)且显著低于CF组(P<0.05)。由图3 B可知,随着实验时间的增加,NF组变化不显著(P>0.05);NU组在第14天时显著下降(P<0.05);CF组在第7天显著下降(P<0.05),CU组在第3天显著增加(P<0.05),随后在第5天显著下降(P<0.05)。

(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理Δ6FadmRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间Δ6FadmRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05)。Data were presented as mean ± SD (n=3). NF: Normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: Cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05).)
图2 温度和摄食对虹鳟肝脏组织Δ6FadmRNA表达的影响
Fig.2 The effect of temperature and feeding on the level ofΔ6FadmRNA in liver
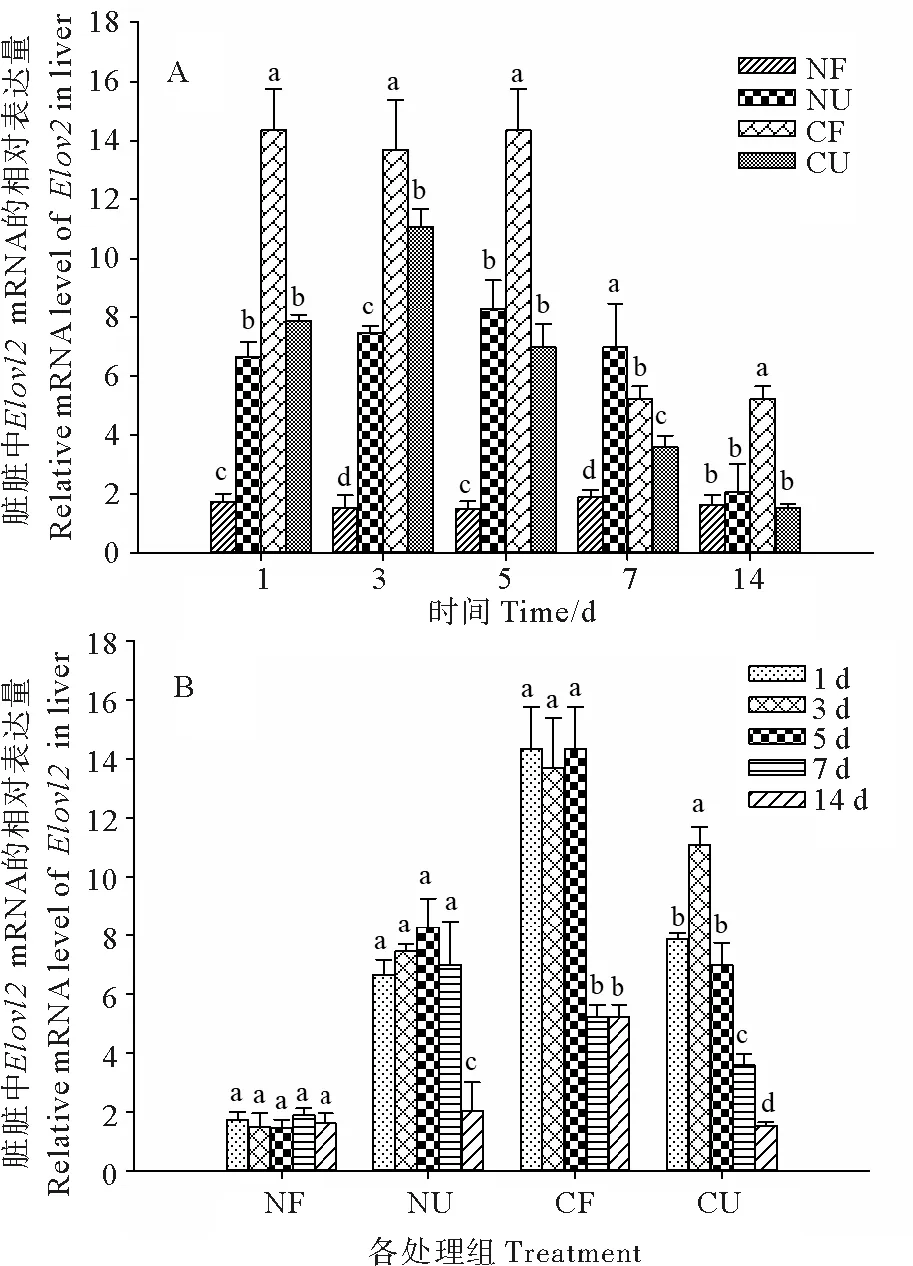
2.4 SCD mRNA在肌肉中的表达情况
图4表示同一时间不同处理和同一处理不同时间SCDmRNA在肌肉中的表达水平。由图4 A可知,7 d以前,低温度的SCDmRNA的表达量均显著大于正常温度组(P<0.05),并且除第5天外,相同温度处理组,摄食组和不摄食组差异不显著(P>0.05)。第14天时,NF、NU、CU三个处理组差异不显著(P>0.05)且现在低于CF组。由图4 B可知,随着时间的变化,NF组和NU组变化不显著(P>0.05);CF组和CU组在实验初期变化不显著(P>0.05),分别在第3和5天显著下降(P<0.05)。
(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理Elovl2 mRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间Elovl2 mRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05)。Data were presented as mean ± SD (n=3). NF: Normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: Cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05).)
图3 温度和摄食对虹鳟肝脏组织Elovl2 mRNA表达的影响
Fig.3 The effect of temperature and feeding on the level ofElovl2 mRNA in liver
2.5 Δ6 Fad mRNA在肌肉中的表达情况
图5表示同一时间不同处理和同一处理不同时间Δ6FadmRNA在肌肉中的表达水平。由图5 A可知,在第5天以前,正常温度组Δ6FadmRNA的表达量显著低于低温度(P<0.05),NF和NU差异不显著,CF组在3 d以前显著高于CU组(P<0.05),在第5天CU组和CF组差异不显著(P>0.05)。在第14天,CF组显著高于正常温度组,CU显著低于正常温度组(P<0.05)。由图5 B可知,NF组和NU组随着时间的变化不显著(P>0.05),CF组和CU组在实验初期变化不显著(P>0.05),分别在第5和7天显著降低(P<0.05)。
(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理SCDmRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间SCDmRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05。Data were presented as mean ± SD (n=3). NF: Normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05).)
图4 温度和摄食对虹鳟肌肉组织中SCDmRNA表达的影响
Fig.4 The effect of temperature and feeding on the level ofSCDmRNA in muscle

(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理Δ6FadmRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间Δ6FadmRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05)。Data were presented as mean ± SD (n=3). NF: Normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05).)
图5 温度和摄食对虹鳟肌肉组织中Δ6fadmRNA表达的影响
Fig.5 The effect of temperature and feeding on the level ofΔ6fadmRNA in muscle
2.6 Elovl2 mRNA在肌肉中的表达情况
图6表示同一时间不同处理和同一处理不同时间Elovl2 mRNA在肌肉中的表达水平。由图6 A可知,在5 d以前,正常温度Elovl2 mRNA的相对表达量显著低于低温组(P<0.05),且NF组显著低于NU组(P<0.05),CU组在第1天时显著低于CF组(P<0.05)。在7 d时,CF组显著高于NF、NU、CU三个处理组(P<0.05);在第14天时,CU组显著低于正常温度组(P<0.05)而CF显著高于正常温度组(P<0.05)。由图6 B可知,随着实验时间的增加,正常温度组变化不显著(P>0.05),低温度在实验初期变化不显著(P>0.05),CF和CU组分别在第5和7天显著下降(P<0.05)。
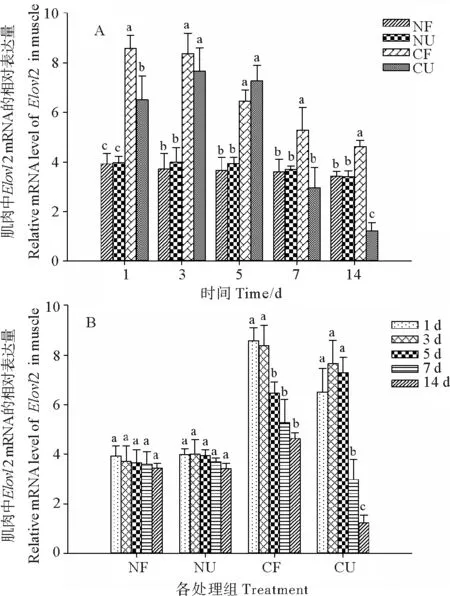
(数值以平均值±标准差表示(n=3)。NF:正常温度摄食组;NU:正常温度不摄食组;CF:低温摄食组;CU:低温不摄食组。A图表示同一时间不同处理Elovl2 mRNA的表达量,不同的小写字母代表同时间中不同处理存在显著差异(P<0.05);B图表示同一处理不同时间Elovl2 mRNA的表达量,不同的小写字母代表同处理中不同时间存在显著差异(P<0.05。Data were presented as mean ± SD (n=3). NF: normal temperature and feeding treatment; NU: Normal temperature and no feeding treatment; CF: Cold and feeding treatment; CU: Cold and no feeding treatment. The different letters in A mean significant difference between the different treatment for each specific sample time (P<0.05) and the different letters in B mean significant difference between the different sampling times for each specific treatment (P<0.05).)
图6 温度和摄食对虹鳟肌肉组织中Elovl2 mRNA表达的影响
Fig.6 The effect of temperature and feeding on the level ofElovl2 mRNA in muscle
3 讨论
鱼类可以直接通过去饱和作用合成单一不饱和脂肪酸。SCD是单一不饱和脂肪酸合成中的限速酶,它使得棕榈酸(16:0)和硬脂酸(18:0)中C9和C10之间形成双键变为棕榈油酸(16:1n7)和油酸(18:1n9)(Δ6 Fad和Elovl2均参与合成长链多不饱和脂肪酸(long-chain polyunsaturated fatty acid, LC-PUFA)途径之一“Sprecher经典途径”[21]。
同其他脊椎动物类似,鱼类机体内缺少Δ12和Δ15去饱和酶,因此无法直接将饱和脂肪酸转化成为LC-PUFA,但是可以将亚油酸(18:2n6)和亚麻酸(18:3n3)通过多种Fad和Elovl交替着相互作用合成LC-PUFA[21-24]。由于摄食环境的不同,淡水鱼和洄游性鱼类具有较强的LC-PUFA的合成能力,但是海水鱼类LC-PUFA的生物合成能力较弱[25]。不同鱼类主要通过两种方式来改变磷脂中各种脂肪酸的比例,一种途径是通过去饱和酶和延长酶的交替作用逐步生成单一不饱和脂肪酸和多不饱和脂肪,另一种途径是通过脱酰作用和重酰化作用将目的PUFA和MUFA取代磷脂中的SFA[12-13]。
由图1~3可知,正常温度下,虹鳟摄食组肝脏中SCD、Δ6Fad和Elovl2 mRNA的表达量显著低于不摄食组,但在第14天时显著下降(SCD下降但是不显著)。这表明摄食显著影响虹鳟肝脏对脂肪酸的调控,在营养供给充足的情况下,主要通过脱酰和重酰化作用(替代作用)来完成机体对MUFA和PUFA的需求;在营养供给不足时,可以通过相关脂肪酸生物合成作用来满足MUFA和PUFA的需求,但由于PUFA的生物合成需要C18PUFA,因此当饥饿导致LC-PUFA的前体脂肪酸下降时,Δ6Fad和Elovl2 mRNA表达量也会下降。很多研究表明,在食物充足的情况下,不饱和脂肪酸的生物合成基因受到抑制[26-28]。此外,张振宇研究发现,大黄鱼(Larimichthyscrocea)在禁食2周时,肝脏中脂肪酸去饱和酶(Fad)活性显著下降[33]。由图4~6可知,在正常温度下,虹鳟肌肉摄食组中SCD、Δ6Fad和Elovl2 mRNA表达量与不摄食组差异不显著。这可能是由于虹鳟肌肉中会沉积大量脂肪,当营养供应不足时,可以及时进行补充,以满足MUFA和PUFA的正常需要。
本实验结果发现,不论是虹鳟肌肉还是肝脏,低温组Δ6Fad和Elovl2 mRNA表达量显著高于正常温度组。虹鳟肝脏中,SCDmRNA在CU组表达较高,而在CF组中表达较低;而在肌肉中,SCDmRNA在CF组和CU组均表达量显著高于正常温度组。低温组中3个基因在第5或7天后显著下降,在第14天时,CU组中的表达量甚至低于NF组。磷脂是目前已知唯一可以对温度变化做出响应的生物膜结构成分。很多研究已经证明,当周围水温下降后,鱼类可以通过增加生物膜磷脂的流动性来适应低温,而膜流动性增加主要体现在:sn-1位置中,SFA比例下降而MUFA比例上升;sn-2位置中PUFA所占比例上升[8,29-30]。Ruyter等[31]的研究发现大西洋鲑在低温环境下(水温为5 ℃)肝脏DHA的合成速率要显著高于正常养殖温度(水温为12 ℃)。Tocher等[32]发现虹鳟肝细胞在5 ℃时Δ6 Fad的活性显著高于在17 ℃时。Xu等[2]在逐渐降温条件下大黄鱼肝脏中SCDmRNA的表达水平先升高后下降,并认为SCDmRNA表达量的下降主要是因为低温和饥饿双重胁迫的原因。本实验中虹鳟肝脏SCDmRNA的表达量在CF组较低,这可能是因为虹鳟通过摄食可以在一定程度上补充MUFA,由此SCDmRNA的表达量不高。本实验结果表明,当周围环境温度降低时,虹鳟不论是肝脏还是肌肉,MUFA和PUFA生物合成量增加。虹鳟在摄食条件下,大约在5~7 d可以适应低温;在长时间的饥饿和低温胁迫下,虹鳟机体内的脂肪酸生物合成可能会受到影响。虹鳟在低温的适应过程中,食物中的MUFA可以满足肝脏的需求,但无法满足肌肉的需求。
4 结语
摄食显著影响鱼类肝脏对脂肪酸的调控,在营养供给充足的情况下,虹鳟主要通过脱酰和重酰化作用(替代作用)来完成机体对MUFA和PUFA的需求;在营养供给不足时,其可以通过相关脂肪酸生物合成作用来满足MUFA和PUFA的需求。由于虹鳟肌肉中有大量脂肪沉积,因而短时间的不摄食对其影响较小。虹鳟肝脏SCDmRNA的表达量在CF组较低,这可能是因为虹鳟通过摄食可以在一定程度上补充MUFA,由此SCDmRNA的表达量不高。当周围环境温度降低时,虹鳟不论是肝脏还是肌肉,MUFA和PUFA生物合成量增加。虹鳟在正常营养条件下,大约在5~7 d可以适应低温;在长时间的饥饿和低温胁迫下,虹鳟机体内的脂肪酸生物合成可能会受到影响。
