罗布麻茶黄酮的分离富集及其抗氧化、抗疲劳活性
2019-02-20,*
,*
(1.青海大学农牧学院,青海西宁 810016; 2.青海大学农林科学院,青海西宁 810016)
罗布麻(ApocynumvenetumL.),属于夹竹桃科多年生宿根草本植物,分为红麻和白麻两种,也被称为野麻、茶叶花、泽漆麻等[1],广泛生长在盐碱和沙漠等地带,主要集中在新疆、内蒙古、甘肃、宁夏、青海等地区,最早在新疆罗布泊发现,故取名为罗布麻[2]。据董正钧[3]考证,罗布麻是一种传统的药用植物,即明代《救荒本草》中记载的泽漆,书中写到 “采摘嫩叶,用锅蒸,再晒干做茶吃亦可”。罗布麻茶是罗布麻的干燥叶,其饮用历史已有3000多年[4]。相关研究证实罗布麻具有广泛的药理功效,如抗疲劳、降血压及抗氧化等作用[5-6],因此其天然绿色的抗氧化、抗疲劳活性成分日益受到研究学者的青睐[7]。
随着国内外学者对罗布麻研究的深入,发现黄酮化合物是罗布麻发挥其功能作用的主要成分[8-9]。王亚宁[10]对新疆罗布麻花中的黄酮进行了研究,结果表明其黄酮具有显著的降血脂功效;徐天资等[11]对黄秋葵黄酮采用小鼠负重游泳进行抗疲劳活性研究,发现黄秋葵黄酮能显著延长小鼠负重游泳时间,具有抗运动性疲劳的作用;Geetha等[12]研究了沙棘粗黄酮的抗氧化活性,证明了沙棘中粗黄酮具有保护细胞免受氧化损伤和清除自由基的作用。
青藏高原罗布麻资源丰富,但尚未进行开发利用,青藏高原高寒缺氧,特殊生境下罗布麻化学成分积累及生物活性可能具有其独特性。目前关于青藏高原特殊生境中罗布麻化学成分及药理活性研究还未见报道,本论文以青海地区罗布麻茶为原料,选用不同柱色谱材料对罗布麻茶黄酮进行分离富集,并分别通过自由基清除率的测定和小鼠负重游泳试验对其体外抗氧化活性及体内抗疲劳作用进行评价,以期为青藏高原地区罗布麻功能性食品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
罗布麻茶 采自青海贵德,自制成茶;SPF级昆明小鼠 雄性,体重18~22 g,购于中国农业科学院兰州兽医研究所,合格证号:SCXK(甘)2015-0001;芦丁(≥98%) 上海金穗生物科技有限公司;ABTS(2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸)、DPPH(1,1-二苯基-2-三硝基苯肼) 南京奥多富尼生物科技有限公司;肌糖原(MG)、肝糖原(LG)、血清尿素氮(BUN)、乳酸脱氢酶(LDH)、考马斯亮蓝、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)等测试盒 南京建成生物工程研究所;D101、D218、D315、AB-8、HPD-600、聚酰胺树脂 江苏长丰化工有限公司;呀啦嗦牌红景天胶囊 青海康普生物科技股份有限公司;无水乙醇、石油醚、乙酸乙酯、亚硝酸钠、硝酸铝等 天津市富宇精细化工有限公司。
14-0807型超声波清洗机 宁波新芝生物科技股份有限公司;UV-2600型紫外可见分光光度计 日本岛津有限公司;SM600型酶标仪 上海永创医疗器械有限公司;ZF-1型紫外分析仪 杭州齐威仪器有限公司;H/T16MM型离心机 湖南赫西仪器装备有限公司;XW-80A型漩涡混匀器 上海驰唐电子有限公司。
1.2 实验方法
1.2.1 罗布麻茶黄酮粗提物的制备 称取300 g罗布麻茶,粉碎后过60目筛,按照1∶20 (g/mL)的料液比加入70%的乙醇溶液,在温度60 ℃,功率 180 W条件下超声提取40 min,过滤,滤液浓缩至约100 mL,加入石油醚萃取除色素,水相用乙酸乙酯萃取,收集乙酸乙酯层,浓缩至膏状,备用。
1.2.2 静态吸附试验 参考闵建华[13]的方法。分别称取D101、D218、D315、AB-8、HPD-600、聚酰胺树脂各5.0 g,加入50 mL罗布麻茶黄酮粗提液,摇匀,静置吸附24 h,得到吸附液,测定黄酮含量;吸附后的树脂加入80%乙醇溶液,解吸24 h,得到醇洗液,测定黄酮含量,分别计算吸附率和解吸率。
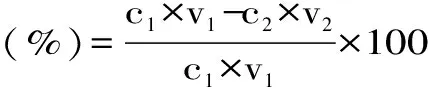
式(1)

式(2)
式中:c1-上样液中黄酮的质量浓度;V1-上样液的体积;c2-吸附液中黄酮的质量浓度;V2-吸附液的体积;c3-醇洗液中黄酮的质量浓度;V3-醇洗液的体积。
1.2.3 黄酮质量浓度的测定 参照李艳提等[14]的方法,采用亚硝酸钠-硝酸铝-氢氧化钠体系显色法。以芦丁为标品,绘制标准曲线为y=25.165x+0.054,R2=0.9925。取0.04 g/mL罗布麻茶黄酮粗提液 1 mL置于10 mL容量瓶,加入5%的NaNO2溶液0.3 mL,摇匀,静置6 min,再加入10%的Al(NO3)3溶液0.3 mL,摇匀,静置6 min,最后再加入4%的NaOH溶液4 mL,定容至刻度,于333 nm波长下测定吸光度值,根据标准曲线方程计算样品中黄酮质量浓度。
式(3)
式中:C为样品黄酮浓度,mg/mL;V为样液体积,50 mL;n为稀释倍数;M为样品质量,g。
1.2.4 罗布麻茶黄酮的富集 选用静态吸附试验优选的柱材料,采用湿法装柱,将罗布麻茶黄酮粗提物沿柱壁缓慢加入,待其充分吸附后,依次用蒸馏水、30%、50%、70%、90%、100%乙醇梯度洗脱,每个梯度洗脱至流出液无色为止,毛细管吸取少量洗脱液点样于滤纸上,喷涂1%三氯化铝乙醇液显色,置于365 nm紫外灯下观察荧光,收集检测斑点显黄色的洗脱液,旋蒸浓缩至50 mL后,于-55 ℃条件下真空冷冻干燥,得罗布麻茶黄酮粉末,4 ℃保存,用于后续实验。
1.2.4 罗布麻茶黄酮体外抗氧化活性研究
1.2.4.1 ABTS自由基清除率的测定 参考Zhang Hua等[15]的方法。称取0.197 g ABTS溶于50 mL蒸馏水中,加入过硫酸钾,使溶液浓度达到2.4 mmol/L,在室温、避光条件下混匀搅拌16 h后,用PBS磷酸缓冲溶液(pH=7.0)将其稀释至734 nm处吸光度值达0.700±0.005。以VC为阳性对照,将上述罗布麻茶黄酮粉末用蒸馏水稀释至不同浓度(0.05、0.09、0.19、0.38、1.50、3.00、6.00、12.00 mg/mL)后,分别与ABTS溶液按1∶20混匀,室温反应6 min后,于734 nm处测定吸光值,计算公式如下:
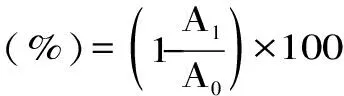
式(4)
式中:A0为空白对照组吸光度值;A1为样品溶液吸光度值。
1.2.4.2 DPPH自由基清除率的测定 参考秦嫚嫚等[16]的方法,以VC为阳性对照,分别移取1.5 mL不同浓度的罗布麻茶黄酮样品溶液(稀释系列为0.05、0.10、0.20、0.30、0.40、0.50、0.70 mg/mL),加入1.5 mL 0.2 mmol/L的DPPH乙醇溶液,在漩涡混匀器上摇匀,室温、避光静置60 min后,于518 nm处测定吸光度值,计算公式同1.2.4.1。
1.2.4.3 羟自由基清除率测定 参考Daniela等[17]的方法。将罗布麻茶黄酮样品稀释至不同浓度后(稀释系列为0.0375、0.075、0.15、0.30、0.60、1.20 mg/mL),依次加入0.03% H2O2标准应用液和0.03% FeSO4溶液各0.20 mL;最后加入0.03%水杨酸乙醇溶液0.20 mL,充分混匀后,于550 nm处测定吸光值,以VC为阳性对照,计算公式同1.2.4.1。
1.2.4.4 铁离子还原法(FRAP)试验 参考李丽红[18]的方法。先将NaAc-HAc缓冲液(pH=3.6,300 mmol/L)、10 mmol/L TPTZ和20 mmol/L FeCl3溶液按体积10∶1∶1配制成FRAP工作液。分别吸取4.50 mLFRAP工作液加入到150 μL不同浓度(0.0、0.2、0.4、0.6、0.8、1.0 mmol/L)的FeSO4溶液中混合,37 ℃水浴条件下反应10 min,于593 nm处测定吸光度值,绘制标准曲线,得回归方程为:y=0.7937x+0. 0548(R2=0.9961)。
取罗布麻茶样品溶液将其调整为10 mg/mL,各取150 μL按上述方法进行分析测定,由标准曲线查得相同吸光值处对应的FeSO4浓度,还原力用对应的FeSO4浓度(μmol/L)表示,以95%乙醇作为空白对照,50 μg/mL VC溶液作为阳性对照,计算公式如下:
抗氧化能力=OD样品-OD空白
式(5)
1.2.5 罗布麻茶黄酮抗疲劳活性研究
1.2.5.1 动物分组及给药 将小鼠进行1周的适应性喂养,温度(24±1) ℃、湿度40%±2%,12 h光照/12 h黑暗,按啮齿动物标准提供食物和饮用水。随机分为空白对照组(双蒸水)、红景天阳性对照组(100 mg/kg bw)、罗布麻茶黄酮低、中高剂量组(50、100、200 mg/kg bw),每组10只,各组小鼠每天定时、定量灌胃一次,连续喂养21 d,并每周记录小鼠体重变化情况。
1.2.5.2 负重游泳试验 末次灌胃30 min后,在每组小鼠的尾部负荷重量为体重5%的铅皮,将其放入水温为(26±2) ℃、50 cm×40 cm×40 cm的水箱中游泳,直至小鼠的头沉入水中,经8 s后不能露出水面视为力竭,用秒表记录小鼠从开始游泳至力竭的时间[19]。
1.2.5.3 生理生化指标的测定 小鼠负重游泳休息30 min后摘眼球取血,脱颈椎处死,解剖,取出各脏器(心、肝、脾、肾)并记录湿重。将全血以(3500 r/min,4 ℃)离心10 min以获取血清样本,严格按照试剂盒方法测定糖原、血乳酸(LD)和血尿素氮(BUN)指标;肝组织经生理盐水处理后,采用考马斯亮蓝试剂盒测定其蛋白含量,并严格按照试剂盒操作说明测定超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)和丙二醛(MDA)含量。
1.3 数据分析

2 结果与分析
2.1 树脂的筛选
以D101、D218、D315、AB-8、HPD600 5种大孔吸附树脂和聚酰胺树脂的吸附率和解吸率为考察指标。如表1所示,不同类型的树脂极性、孔径和比表面积不同[20],导致了对黄酮类化合物吸附强弱有差异,其中聚酰胺树脂对黄酮吸附效果最好,吸附率达65.08%±0.26%,解吸率达41.27%±0.18%,可能是因为聚酰胺是一类高分子聚合物,结构中含有重复单位酰胺键(-CONH-),可以与含有酚羟基的黄酮形成氢键缔合进而产生吸附作用[20]。所以优选聚酰胺树脂对罗布麻茶黄酮进行富集。

表1 不同树脂对罗布麻茶黄酮的静态吸附与解吸附性能Table 1 Absorption and desorption capabilities of different macroreticular resins to total flavoids
2.2 罗布麻茶黄酮体外抗氧化活性结果
2.2.1 罗布麻茶黄酮对ABTS+·清除率的测定 ABTS+·是一种醇液呈蓝绿色的亚稳态离子,可使黄酮类化合物褪色,且褪色程度越好,表明自由基清除能力越强,常用于机体抗氧化能力评价[21]。由图1可知,罗布麻茶黄酮对ABTS+·清除能力随着质量浓度的增加而升高,在12 mg/mL处达到98.2%±0.16%,与同浓度下阳性对照组VC的清除效果相当,表明罗布麻茶黄酮对ABTS+·清除作用较强。
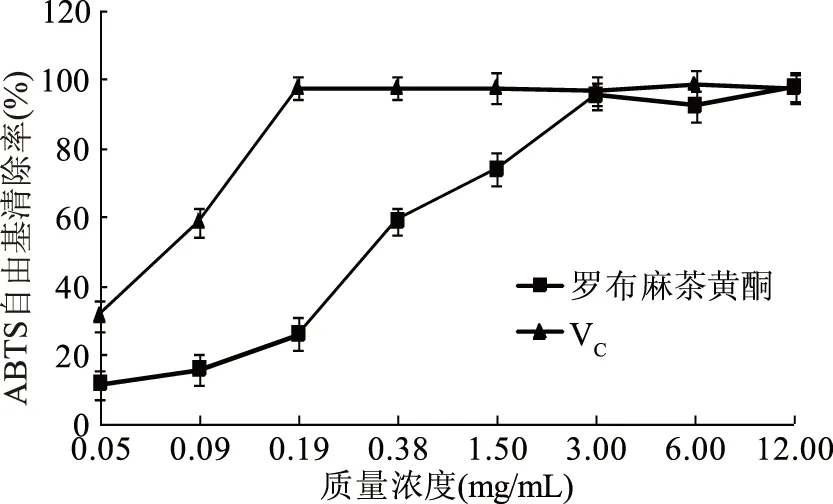
图1 罗布麻茶黄酮对ABTS+·清除率的影响Fig.1 Effect of Apocynum venetum flavone on ABTS+· clearance rate
2.2.2 罗布麻茶黄酮对DPPH自由基清除率的测定 由图2可知,罗布麻茶黄酮对DPPH自由基的清除作用随着质量浓度的增加而上升,当浓度达到0.20 mg/mL时对DPPH·清除率达98.5%±0.18%,优于同浓度下阳性对照组VC,并且之后随浓度增加,DPPH·清除率呈现稳定趋势。
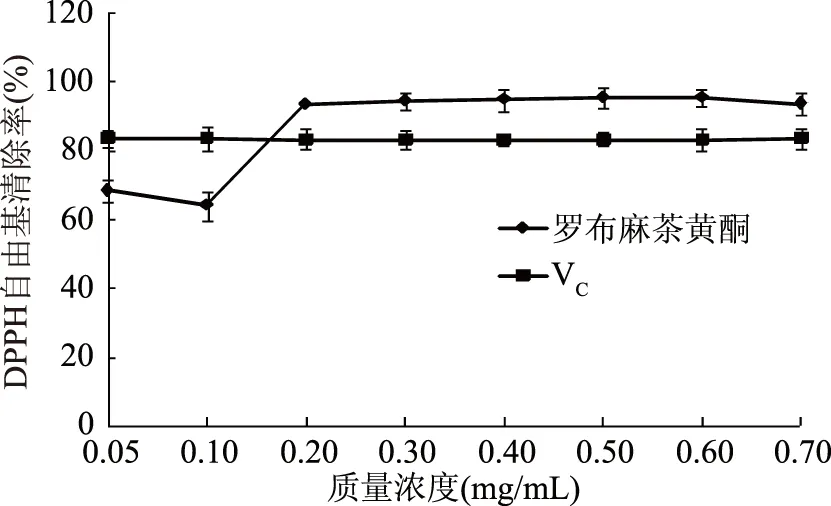
图2 罗布麻茶黄酮对DPPH·清除率的影响Fig.2 Effect of Apocynum venetumflavone on DPPH· clearance rate
2.2.3 罗布麻茶黄酮对羟自由基清除率的测定 ·OH是一种对人体危害较大的活性氧自由基[22]。由图3可知,在一定浓度范围下,罗布麻茶黄酮对羟自由基的清除能力随质量浓度的增加而增强,在1.20 mg/mL时清除率高达84.9%±0.21%,略低于阳性对照组VC。
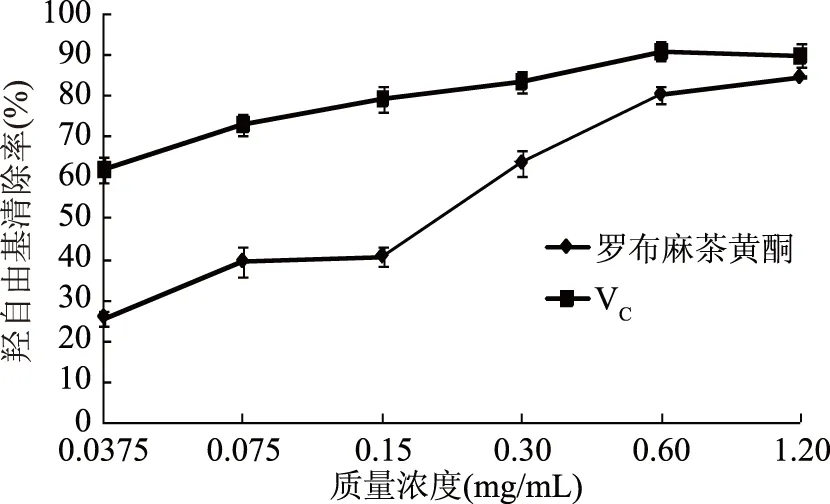
图3 罗布麻茶黄酮对羟自由基清除率的影响Fig.3 Effect of Apocynum venetum flavone on hydroxyl radical clearance rate
2.2.4 罗布麻茶黄酮铁离子还原力的测定结果 由图4可知,随着质量浓度的增加罗布麻茶黄酮的铁离子还原力逐渐增加,当黄酮浓度为3.20 mg/mL时,铁离子还原能力为(865.82±0.0)5 μmol/L FeSO4,仅与0.08 mg/mL VC的铁离子还原力相当,可见罗布麻茶中的黄酮具有一定的铁离子还原能力,但是作用效果与VC相比还是有较大的差距,说明罗布麻茶黄酮抗氧化作用主要表现在对ABTS及DPPH自由基的清除方面,这可能是罗布麻茶黄酮结构更易与自由基发生反应,而与铁离子相互作用相对较弱的原因。
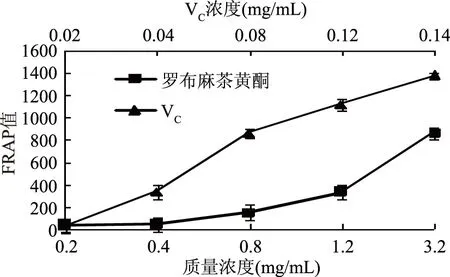
图4 罗布麻茶黄酮对铁离子还原力的影响Fig.4 Effect of Apocynum venetum flavone on iron ion reduction ability
2.3 罗布麻茶黄酮抗疲劳试验结果
2.3.1 罗布麻茶黄酮对小鼠体重的影响 如表2所示,灌服不同剂量的罗布麻茶黄酮21 d后,各剂量组小鼠的体重均稳步增长。第三周试验结束时,各剂量组小鼠体重与空白对照组相比均无显著差异(P>0.05)。

表2 罗布麻茶黄酮对小鼠体重的影响Table 2 Effect of Apocynum venetum flavone on body weight of mice
2.3.2 罗布麻茶黄酮对运动后小鼠脏器湿重的影响 由表3可知,灌服不同剂量的罗布麻茶黄酮21 d后,解剖称量各组小鼠脏器湿重,经统计学分析后,各剂量组小鼠脏器湿重与空白对照组均无显著差异(P>0.05)。表明灌胃不同剂量的罗布麻茶黄酮,并没有对小鼠各脏器产生异常变化。

表3 罗布麻茶黄酮对小鼠脏器湿重的影响Table 3 Effect of Apocynum venetum flavone on wet weight of mice
2.3.3 罗布麻茶黄酮对小鼠力竭游泳时间和肝组织蛋白含量的影响 运动耐力是评价机体抗疲劳能力的重要指标,而负重游泳试验是测定运动性疲劳程度最有效和最常用的试验方法[23]。由表4可知,与空白对照组比较,除罗布麻茶黄酮低剂量组外,中、高剂量组小鼠负重游泳时间均有所延长,且随着灌胃剂量的增加,小鼠游泳时间也逐渐延长,效果与灌胃剂量呈现正相关关系。

表4 罗布麻茶黄酮对小鼠游泳时间和肝组织蛋白含量的影响 Table 4 Effect of Apocynum venetum flavone on swimming time and protein content in liver tissue of mice
与空白对照组相比,罗布麻茶黄酮低剂量组与中剂量组均无显著性差异,这可能与剂量选择有关也可能与小鼠个体差异有关,尤其是罗布麻茶黄酮中剂量组,小鼠负重游泳时间最高值可达190.42 min,而最低值只有109.92 min,小鼠个体间差异较大,究竟是个体差异造成的还是剂量选择欠佳造成的其具体机制可能需要通过大量实验进一步深入研究。另外,灌胃不同浓度的罗布麻茶黄酮21 d后,测定小鼠肝组织蛋白含量,经统计学分析后,各剂量组小鼠蛋白含量与空白对照组比均无显著差异(P>0.05),表明罗布麻茶黄酮具有延缓运动性疲劳产生的作用,且药物对小鼠肝组织蛋白无显著影响。
2.3.4 罗布麻茶黄酮对运动后小鼠肝糖原和肌糖原含量的影响 研究表明,运动引起的体力耗竭和肌糖原的消耗是同时发生的,在运动过程中,随着肌糖原不断被消耗,机体为了维持正常血糖水平,消耗肝糖原从而使肝糖原的含量降低[24]。由表5可知,灌胃罗布麻茶黄酮中、高剂量组小鼠的肝糖原和肌糖原含量均有所上升,其中罗布麻茶黄酮高剂量组显著高于空白对照组(P<0.05),且效果优于阳性对照组。
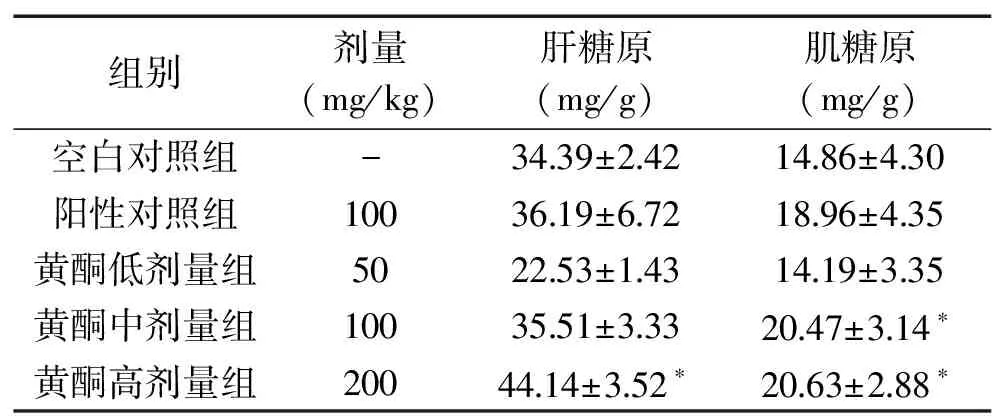
表5 罗布麻茶黄酮对小鼠糖原的影响 Table 5 Effect of Apocynum venetumflavone on glycogen in mice
2.3.5 罗布麻茶黄酮对运动后小鼠全血乳酸(LD)和血清尿素氮(BUN)、乳酸脱氢酶(LDH)的影响 运动过程中由于供氧不足,肌肉产生乳酸,渗透进入血液,导致血乳酸含量上升,而乳酸的减少依赖于乳酸脱氢酶的参与,它可以将乳酸转化为丙酮酸,减少乳酸的积累,从而延缓疲劳的产生[25]。另一方面,当机体不能通过一定的途径获得足够的能量时,蛋白质和氨基酸的分解代谢会增强,血清尿素氮含量也随之增加[26]。由表6可知,3个剂量组小鼠的LD含量均极显著低于空白对照组(P<0.01),其中罗布麻茶黄酮高剂量组LD含量低于阳性对照组;且各剂量组小鼠的BUN含量也均比空白对照组低(P<0.01),其中罗布麻茶黄酮高剂量组效果更佳;而3个剂量组小鼠的LDH活力均有一定程度提高。说明罗布麻茶黄酮能够降低运动后小鼠全血乳酸和血尿素氮含量,提高乳酸脱氢酶活力,加速乳酸的清除。

表6 罗布麻茶黄酮对小鼠LD、BUN和LDH的影响 Table 6 Effect of Apocynum venetum flavone on LD,BUN and LDH in mice
2.3.6 罗布麻茶黄酮对小鼠肝脏氧化应激指标的影响 自由基理论表明,疲劳的产生是由于自由基攻击线粒体等生物膜,导致膜流动性受损和能量代谢发生紊乱,进而导致疲劳[27]。超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)负责清除体内的氧自由基,它是机体内主要的抗氧化酶,能直接反映机体的抗氧化水平,而丙二醛是自由基引起脂质过氧化的主要产物之一,可间接显示机体清除氧化产物能力和抗氧化活性[28]。如表7所示,各剂量组小鼠的SOD活性均极显著高于空白对照组(P<0.01),其中罗布麻茶高剂量组SOD活性最高,优于阳性对照组;并且3个剂量组小鼠的GSH-PX活性与空白对照组相比也都有所提高,其中罗布麻茶黄酮高剂量组效果最佳,GSH-PX活性极显著高于空白对照组(P<0.01);并且3个剂量组小鼠的MDA含量都有一定程度的降低,罗布麻茶黄酮高剂量组MDA含量极显著低于空白对照组(P<0.01)。表明罗布麻茶黄酮能提高力竭游泳后小鼠SOD和GSH-PX的抗氧化酶活性,降低MDA含量,尤其罗布麻茶黄酮高剂量组效果最佳。
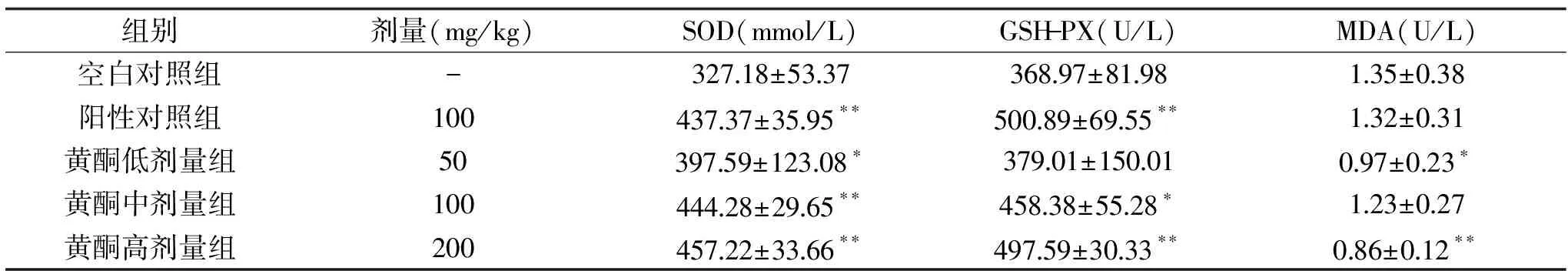
表7 罗布麻茶黄酮对小鼠肝脏氧化应激指标的影响 Table 7 Effect of Apocynum venetum flavone on oxidative stress index in mice
3 结论
本论文首次对青海地区罗布麻茶黄酮进行分离富集和抗氧化、抗疲劳活性研究,发现聚酰胺树脂对罗布麻茶黄酮不仅富集效果好,且得到的总黄酮抗氧化和抗疲劳活性较强,其对罗布麻茶黄酮的吸附率达65.08%、解吸率达41.27%,明显高于其余5种大孔吸附树脂,研究结果可为罗布麻茶黄酮富集提供一定参考。
体外抗氧化活性试验研究发现,当罗布麻茶黄酮浓度为0.20 mg/mL时,其对DPPH自由基清除率达98.5%±0.18%,优于同浓度下阳性对照组VC,具有良好的抗氧化能力,具备开发成新型天然抗氧化剂的潜力。抗疲劳活性试验发现,罗布麻茶黄酮能延长小鼠负重游泳时间,提高糖原的储备能力,降低血清尿素氮含量,缓解肝脏氧化应激反应等,部分生化指标测定结果优于红景天阳性对照组,且与小鼠药物灌胃剂量呈一定依赖关系。结合体外抗氧化活性指标推测其抗疲劳作用有可能主要通过增强氧化应激能力来实现,罗布麻茶黄酮体外清除自由基能力越强时,体内抗氧化酶系活力越高,越能有效地降低脂质过氧化造成的细胞损伤,从而有效缓解疲劳。
此外,罗布麻生长在高寒缺氧地区可能会提高其耐缺氧能力,长期低氧适应性赋予其较强的抗氧化抗疲劳功能作用。青藏高原罗布麻资源丰富,本研究可为高原地区罗布麻抗氧化抗疲劳功能性食品的开发提供相应的数据支撑,促进该资源的开发利用。
