类风湿关节炎骨质疏松危险因素分析
2019-02-20曾婷婷田永建谭立明余建林吴洋蒋永清陈娟娟李华余乐
曾婷婷 田永建 谭立明* 余建林 吴洋 蒋永清 陈娟娟 李华 余乐
1.南昌大学第二附属医院检验科,江西省检验医学重点实验室,江西 南昌 330006 2.南昌大学第二附属医院风湿免疫科,江西 南昌 330006
类风湿关节炎(rheumatoid arthritis, RA)是临床常见的一种自身免疫病,以关节软骨及骨质侵犯为主要特征,晚期可累及全身多个系统[1]。该病好发于老年女性,发病原因及具体的致病机制至今尚未阐明。骨质疏松(osteoporosis, OP)是以骨微结构退化、骨皮质变薄、骨小梁减少、骨密度(bone mineral density, BMD)和强度减低为特征的全身性骨病[2],也是RA常见的并发症之一;OP导致RA患者相较于正常人群有更高的骨折风险,增加了RA的致残率和病死率。本文通过对133例RA患者年龄、病程、实验室检查指标及激素使用情况回顾性分析,探讨RA患者发生OP的风险因素,结果报道如下。
1 材料方法
1.1 研究对象
受试对象为2016年5月至2017年11月在南昌大学第二附属医院确诊的133例RA患者,以及该院同期60名健康体检者,研究对象人口学特征见表1。
1.2 纳入和排除标准
纳入标准:所有研究对象均签署知情协议,自愿参与;临床诊断明确(RA诊断符合相关指南[3]),有详实完整的临床、影像及实验室检查资料;采血前一个月内未出现感染性、炎症相关性等影响实验室检测结果的疾病;近期未服用影响骨代谢的药物。排除标准:合并RA以外其他自身免疫病;合并其他影响骨代谢的疾病如骨关节炎,骨肿瘤等;合并严重的心血管系统、血液系统、消化或内分泌等系统异常;妊娠及哺乳妇女。
1.3 资料收集及指标检测
患者一般信息及病史病历资料通过该院病例系统查询,包括性别、年龄、病程、肿胀关节计数、关节压痛指数和晨僵时间等。采集符合纳入标准的患者空腹促凝血3 mL,1 026 g离心10 min分离血清。ELISA检测anti-CCP水平,试剂购自上海科新生物技术股份有限公司;采用美国贝克曼公司IMMAGE 800 型全自动特定蛋白分析系统及配套试剂,通过速率散射比浊法测定血清RF水平,骨代谢指标骨γ-羧基谷氨酸蛋白(bone gamma-carboxyglutamic-acid-containing proteins, BGP)、25羟维生素D3(25-hydroxy vitamin D3, (25-(OH)D3))、甲状旁腺素(parathyroid hormone, PTH)、Ⅰ型胶原氨基端前肽(aminoterminal propeptide of type I collagen, PINP)及β胶原特殊序列(β-crosslaps, β-CTx)采用Cobas e601全自动电化学发光仪检测(罗氏诊断产品有限公司,中国上海);骨碱性磷酸酶(bone alkaline phosphatase, BALP)水平采用手工法测定,试剂购自北京中生金域诊断技术股份有限公司。所有指标检测操作严格遵照试剂及仪器说明书和南昌大学第二附属医院标准化操作程序(Standard Operation Procedure, SOP)文件进行。GE公司Lunar Prodigy双能X线(美国)检测所有RA患者包括股骨颈、全髋和腰椎L1~L4等部位BMD,且对所有RA患者根据检查结果及临床表现进行28关节疾病活动度评分(28 joint disease activity score, DAS28)。标本均在患者知情条件下获得,并经南昌大学第二附属医院伦理委员会许可。
1.4 统计方法
利用SPSS 22.0软件进行数据分析处理。K-S检验和Levene’s检验分析计量资料的正态性和方差齐性。正态分布资料以均数±标准差(mena±SD)表示,组间差异采用成组t检验比较;否则以中位数(四分位数间距)[media(IQR)]的方式表示,并用Mann-Whitney U检验比较组间差异。计数资料组间差异分析采用卡方检验。P<0.05则认为差异有统计学意义。
2 结果
2.1 RA组和健康对照组人口学特征及实验室检查结果比较
一共纳入RA患者133例(RA组)以及健康体检者60例(健康对照组),两组性别(P=0.7454)和年龄(P=0.931)差异无统计学意义,具有可比性。RA组RF、anti-CCP、CRP、ESR、BALP和β-CTx)水平经独立样本t检验或Mann-Whitney U检验显著高于健康对照人群,详见表1。
注:*正态分布资料,采用独立样本t检验分析组间差异。
Note: *tested by t test.
2.2 OP、骨量减低和骨量正常组实验室检查结果比较
133例RA患者按照世界卫生组织骨质疏松定义标准,根据BMD检测结果分为:骨量正常组(BMD低于同种族、同性别健康成人骨峰值1个标准差以内);骨量减低组(BMD减低1~2.5个标准差)和OP组(BMD减低达到或者超过2.5个标准差)[4]。将三组人口学特征、一般资料及实验室检查结果进行对比显示OP及骨量减低组年龄高于骨量正常组,CRP、ESR、BALP、β-CTx、DAS28等指标水平也较高。RA患者糖皮质激素使用率为66.92%(89/133),其中OP组和骨量减低组患者糖皮质激素使用率显著高于骨量正常组患者(80.77%和71.74% Vs 40%,P<0.0125)。详见表2。
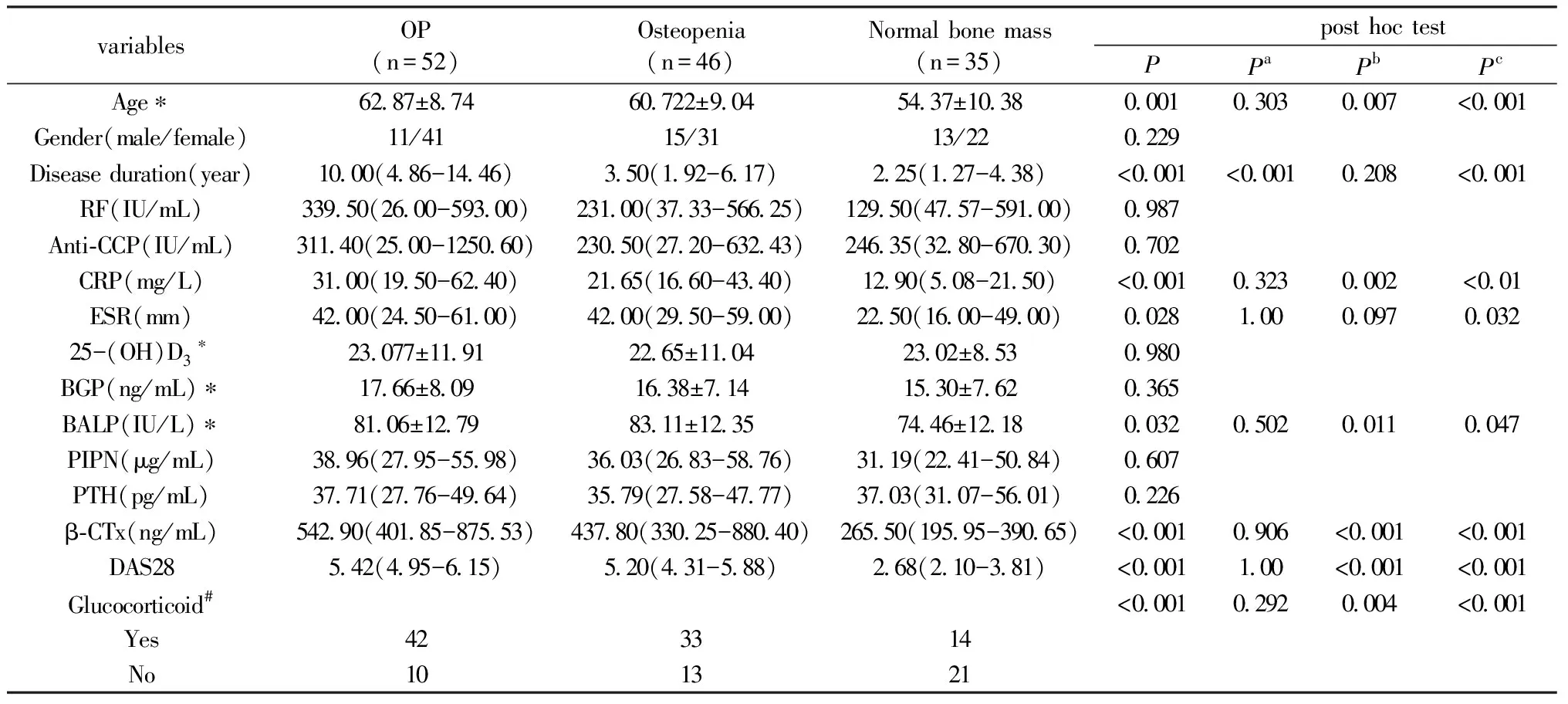
表2 OP、骨量减低和骨量正常组实验室检查结果比较Table 2 Clinical characteristics comparison between osteoporosis, osteopenia and normal bone mass group
注:P:采用单因素方差分析(正态分布指标,表中以*标注)、卡方检验(计量资料指标,表中以#标注)或Kruskal-Wallis检验(非正态分布指标)分析各指标三组间水平差异;Pa,Pb,Pc:采用事后LSD检验(正态分布指标,表中以*标注)、卡方分割(计量资料指标,表中以#标注)或Nemenyi检验(非正态分布指标);Pa: 骨质疏松组与骨量减低组比较;Pb:骨量减低组与骨量正常组比较;Pc:骨质疏松组与骨量正常组比较。
Note: P:tested by One-Way ANOVA (normal distribution data, presented as * in the table), Kruskal-Wallis test(Non-normal distribution data)or chi-square test(categorical data, presented as # in the table);Pa,Pb,Pc:tested post hoc LSD test (normal distribution data, presented as * in the table), partition of chi-square(categorical data, presented as # in the table) or post hoc Nemenyi test (Non-normal distribution data);Pa: comparison between osteoporosis and osteopenia group;Pb:comparison between osteopenia and normal bone mass group;Pc:comparison between osteoporosis and normal bone mass group.
2.3 各指标与RA骨质疏松及骨量减低的关系
采用单变量及多变量多元logistics回归分析各指标与RA骨质疏松的关系,经单变量logistics回归分析及多变量调整证实患者年龄、病程、DAS28评分及糖皮质激素使用是RA患者发生OP及骨量减低独立危险因素,OR(95%CI)分别为1.116(1.013-1.230)、1.775(1.191-2.645)、4.356(1.741-10.898)和9.448(1.040-85.802),详见表3。
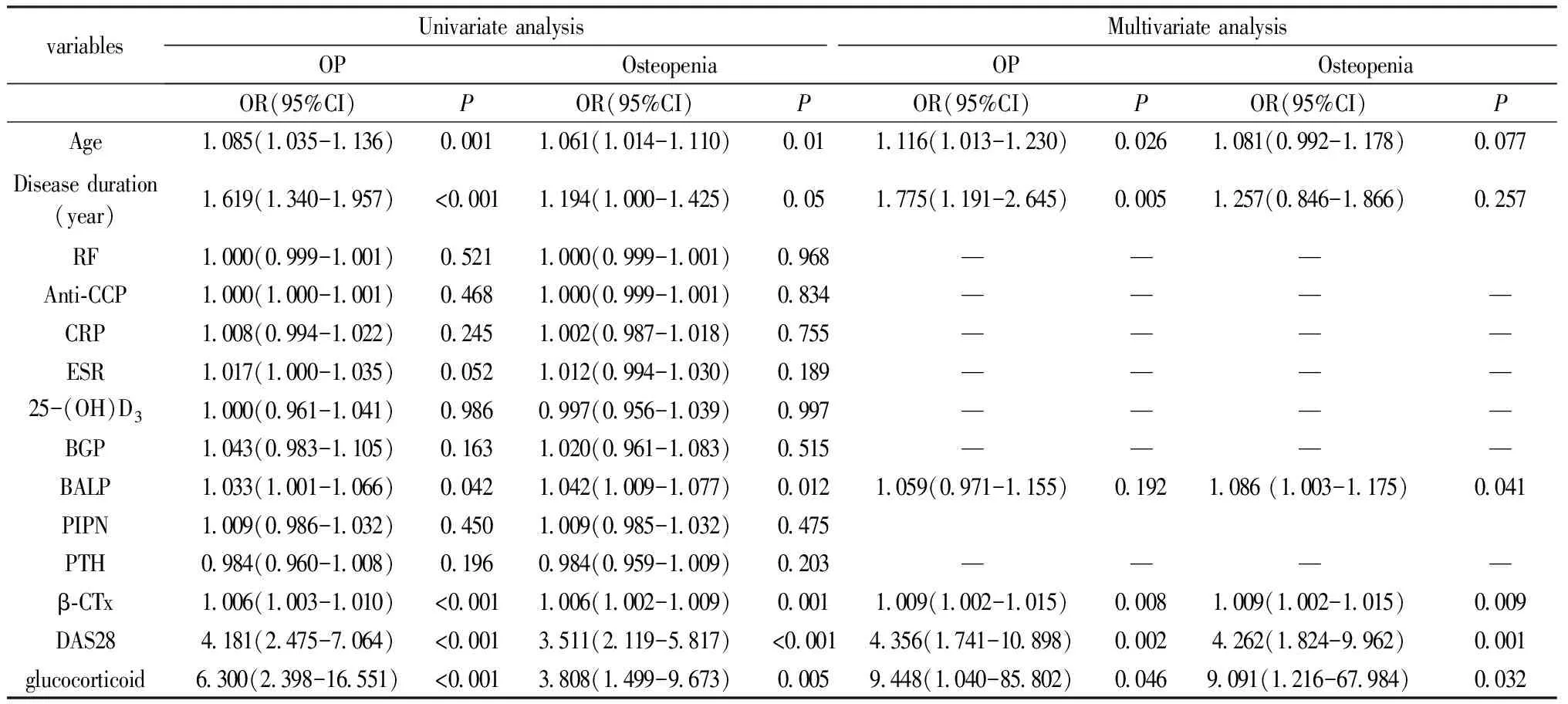
表3 RA骨质疏松及骨量减低危险因素分析Table 3 Univariate and multivariate logistic regression analysis of risk factors for osteoporosis and osteopenia
3 讨论
RA以关节滑膜慢性增生性炎症起病,随后病变可突破关节滑膜损伤关节局部骨质,患者极易发生关节功能丧失及畸形[5]。随着疾病进展,RA可累及全身多个系统,引起多种关节外并发症。OP是一种以全身性骨量降低和骨结构破坏为特征的系统性骨病,是RA患者一种常见的并发症,同时也是RA患者发生骨折和致残的重要原因[6]。因此,在RA治疗过程中及时了解患者骨代谢状态,避免OP和骨折发生十分重要。
骨的正常代谢依赖骨形成和骨吸收过程的动态平衡[7],骨代谢标志物包括成骨性指标(常见如BALP、BGP和PIPN)、破骨性指标(常见如β-CTx)及骨转化指标(常见如25-(OH)D3及PTH)。已有研究表明,骨代谢指标水平往往在局部或全身性OP出现之前即发生改变,可用于反映患者全身骨代谢状态[8]。本研究中通过对比RA患者和健康对照组人群骨代谢指标水平发现6项指标中BALP及β-CTx在RA组显著高于健康对照组,其他几项指标两组间无显著差异,可能与RA患者治疗过程中服用骨保护药物导致骨代谢指标水平变化相关。另外,BALP与β-CTx水平在发生OP的RA患者为90.02±15.25IU/L和542.90(401.85-875.53) ng/mL显著高于骨量减低及骨量正常组人群,与国内其他研究报道略有不同[9-10]。说明RA伴发OP和骨量减低的患者破骨活性确实较高而BALP水平升高可能与患者代偿性的成骨增加有关。
RA作为常见的自身免疫病,患者血清中可检测多种自身抗体[11]。RF和anti-CCP是RA患者常规检测的2种经典自身抗体,其检测临床上常用于RA的诊断及分类[3]。本研究中,RA患者血清RF及anti-CCP水平分别为240.00(33.55-591.50)IU/mL和262.00(26.07-851.77) IU/mL,较健康对照人群显著升高,而在OP、骨量减低及骨量正常三组间无显著差异。另外单因素与多因素logistic回归结果显示,本研究中RF及anti-CCP均非RA患者发生OP的危险因素,OR(95%CI)分别是1.000(0.999-1.001)和1.000(1.000-1.001),与Serena Bugatti[12]及Giovanni Orsolini[13]等研究结果不同。刘瑜等[14]研究表明,年龄、病程、激素使用时间、激素累积使用量及ESR是RA患者发生椎体压缩性骨折的危险因素,而患者性别、anti-CCP 抗体与患者发生椎体压缩性骨折无关,结论与当前研究基本一致,表明anti-CCP作为RA患者发生OP危险因素与国外研究结果差异可能由种族差异所致。
CRP和ESR是两种常见炎症指标,在RA疾病中通过检测CRP及ESR水平可以较为准确的反映患者系统性炎症状态;另外结合患者28关节肿胀及压痛等临床表现,临床常对患者进行DAS28评分进而评估RA患者疾病活动度。以上指标均有助临床医生判断患者病情以便进行合理治疗,而其与OP这种重要并发症的关系目前研究较少。当前研究结果显示,CRP及ESR水平在RA组明显高于对照人群(P<0.001),同时CRP和ESR在OP组水平升高更为显著。RA患者发生OP的具体机制尚未明确,但已有大量研究证实OP与RA慢性炎症有关,炎症因子打破骨形成与骨吸收平衡使BMD减低[15]。耿晔和刘海等[16-17]分析了白细胞介素(interleukin, IL)IL-6和IL-17与RA发病的关系,发现RA活动期IL-6和IL-7水平升高并与RA患者发生OP相关,提示RA骨转化过程与机体炎症状态确有关联。
糖皮质激素作为一种强效抗炎药物,是RA临床治疗中一种重要药物,可以作为慢速抗风湿药物的补充,快速控制炎症缓解临床症状。但使用该药副作用多,其中骨质疏松即为大剂量使用糖皮质激素的RA患者常见的不良反应。本研究结果显示,RA患者糖皮质激素使用率为66.92%(89/133),其中OP组和骨量减低组患者糖皮质激素使用率显著高于骨量正常组患者(80.77%和71.74% Vs 40%,P<0.0125)。多元Logistic回归分析了各指标与RA发生OP的关系,单因素分析发现年龄、病程、BALP、β-CTx、DAS28及糖皮质激素用药与OP和骨量减低均相关,经多因素校正发现年龄、病程、DAS28及糖皮质激素用药为OP的独立危险因素,OR值分别为1.116(1.013-1.230)、1.775(1.191-2.645)、4.356(1.741-10.898)和9.448(1.040-85.802),与胡晶等[18]研究结论基本一致,说明随着患者年龄、病程及DAS28评分增高,患者发生OP的风险也增加。
总之,血清自身抗体、炎症指标及骨代谢指标水平在RA患者存在不同程度异常,患者年龄、病程、疾病活动度及糖皮质激素使用情况可作为判断RA患者骨质疏松风险的参考指标,有助于指导临床对RA患者疾病发展和病程进行监测,并进行及时的合理治疗,对改善RA患者疾病预后减轻患者疾病负担具有重要意义。
