分子马达运动:生命滑动的乐章
2019-02-19郭晓强
郭晓强
北京大学 深圳医院,广东 深圳 518036
生命就是运动,宏观的肌肉收缩和微观的细胞迁移、细胞分裂、物质运输等生命过程都离不开运动[1]。活的生命每时每刻都在运动,因此可以毫不夸张地说,没有运动就没有生命。运动如此重要,自然衍生出一个重要问题——生命运动是如何完成的?
1 肌肉收缩
自然界物质运动的基本规律于17世纪由牛顿力学揭示,而对生命运动的真正研究则开始于19世纪下半叶。肌肉收缩是较早观察到的一类生命运动,这一过程对哺乳动物具有十分重要的意义。肌肉是一种特殊的收缩组织(图1),在动物中普遍存在。肌肉收缩和舒张引起的长度变化支持一系列的生命活动,从低等章鱼的灵巧触手和海兔的波形蠕动,到足球运动员和芭蕾舞演员的腿部协调运动等。科学家对两个问题产生浓厚兴趣:参与肌肉收缩的分子有哪些?肌肉收缩是如何完成的?
1864年,德国生理学家屈内 (Wilhelm Friedrich Kühne,1837—1900)在研究肌肉生理时,从肌肉提取物中鉴定出一种黏性成分,命名为肌球蛋白(myosin),并推测该物质参与了肌肉收缩。受技术条件所限,屈内未能得到纯化的肌球蛋白,因此也就无法对其生物学功能展开深入研究。
20世纪30年代,随着蛋白质研究技术的快速发展,肌球蛋白逐渐得到重视。1939年,苏联生物化学家恩格尔哈特(Vladimir Aleksandrovich Engelgardt)和妻子发现肌球蛋白具有ATP酶活性,即具有水解“能量货币”ATP并释放能量的作用。这初步说明两个问题:一是ATP可能是肌肉收缩的能量来源;二是肌球蛋白在肌肉收缩过程发挥重要作用。这一发现开启肌肉生物化学研究新时代。尽管该发现在当时还受到一定的质疑,却吸引了匈牙利著名酶学和维生素领域专家圣捷尔吉(Albert von Szent-Györgyi Nagyrápolt,1893—1986)的巨大兴趣。当时,圣捷尔吉刚于1937年由于维生素C的发现及代谢研究而获得诺贝尔生理学或医学奖,他决定将研究方向转向肌球蛋白[2]。
为研究肌球蛋白的生理功能,圣捷尔吉首先需制备大量纯蛋白。当时,肌球蛋白提取使用新鲜研磨的兔肌肉匀浆,在高离子强度和碱性环境搅拌20 min后借助离心方式制备上清液;然后加水稀释为低离子强度和中性环境,此时肌球蛋白从溶液中析出,形成沉淀;再将沉淀溶解就可得到肌球蛋白。然而,圣捷尔吉的助手在一次提取肌球蛋白过程中出现一个小失误,他在制备出肌肉匀浆后,忘记离心,第二天发现匀浆变得极为黏稠,近乎凝胶状,已无法进一步操作。圣捷尔吉并未轻易丢弃半凝固的肌肉匀浆,而是开始思考这一现象背后的原因。恰恰这一“小意外”奠定了下一步研究的基础。
圣捷尔吉和助手向凝胶状肌肉匀浆中加入少许ATP,意外地发现匀浆重新液化;几分钟后待ATP消耗殆尽,溶液重新凝胶化。圣捷尔吉根据状态差异推测肌球蛋白存在两种形式:低黏度时称为肌球蛋白A;高黏度时称为肌球蛋白B。随后,圣捷尔吉将肌球蛋白A和B均制成线状结构,并补充ATP,惊奇地发现肌球蛋白B纤维明显缩短,而A不受影响。这是人类第一次在体外观察到生命收缩,圣捷尔吉将其看作一生中最激动人心的时刻。圣捷尔吉据此推测,肌球蛋白A和B的区别在于B中含有一种未知成分。
1942年,圣捷尔吉实验室的匈牙利生物化学家斯特劳布(Brunó Ferenc Straub, 1914—1996)负责研究肌球蛋白B。借助精妙的实验设计,斯特劳布最终从肌球蛋白B中纯化出一种新蛋白,该蛋白含量与肌球蛋白B补充ATP后的收缩程度(称为“活性”,activity)成正比,因此命名为肌动蛋白(actin)。斯特劳布还发现,肌动蛋白本身存在两种形式:在无盐溶液中呈球状(globule),称为G-肌动蛋白;生理盐浓度下呈丝状( fi lament),称为F-肌动蛋白[3]。至此,对肌肉有了一个较为全面的理解:主要由肌球蛋白和肌动蛋白构成,在体外补充ATP可完成肌球蛋白收缩。这一发现开启了现代肌肉生物化学研究的大门(图1)。1953年,圣捷尔吉由于在肌肉生物学领域的重大发现而荣获美国拉斯克基础医学奖,成为该奖历史上唯一一位获得诺贝尔奖后再获拉斯克奖的科学家(当然获奖内容不同),从而也说明该项研究的重要性。体外实验表明肌球蛋白可以收缩,那么这一作用是否就是肌肉收缩的机制呢?进一步的研究否定了这一说法。

图1 肌球蛋白和肌动蛋白的发现
2 滑动模型
早在19世纪,科学家就对肌细胞结构有了初步理解。借助光学显微镜发现横纹肌纤维由明带(I带)和暗带(A带)交替,暗带中央较亮区域为H带,明带中央为Z线,相邻Z线间区域称为肌节(sarcomere)。肌节是肌肉收缩和舒张的基本单位。然而直到20世纪50年代才开始理解肌肉收缩的机制[4]。
1948年,英国分子生物学家休斯·赫胥黎(Hugh Esmor Huxley,1924—2013)加入剑桥大学医学研究委员会(medical research council,MRC),跟随结构生物学家肯德鲁(John Kendrew,1962年诺贝尔化学奖获得者)进行博士学习。当时,利用X射线衍射技术研究蛋白质等生物大分子刚刚兴起,而拥有物理学背景的休斯决定用这种技术研究肌肉收缩。休斯通过对X射线衍射图案分析发现,肌肉收缩过程中存在反射强度的改变,据此推断该过程可能涉及肌球蛋白和肌动蛋白之间的某种关系变化。1952年,休斯为得到更直接的证据而离开英国加入麻省理工学院开展博士后研究。此时另一位来自英国的博士后汉森(Jean Hanson)也加入团队,极大地加快了研究进程。他们联合使用光学显微镜和电子显微镜观察后发现,破坏肌球蛋白只影响A带结构,因此提出,A带主要含有肌球蛋白(形成粗肌丝),而H带主要由肌动蛋白构成(形成细肌丝)。他们还进一步提出滑动肌丝假说(sliding filament hypothesis),这一模型却遭到众多肌肉生物学领域专家的质疑,从而使休斯这位初出茅庐的年轻人感到压力巨大,对自己的结果也产生了些许怀疑。恰在此时,休斯在一次学术会议上与另一位赫胥黎——安德鲁·赫胥黎(Sir Andrew Fielding Huxley)相识,从而使问题得到很好的解决。
安德鲁当时已具有极高知名度,可说誉满全球,曾于1949年提出解释动作电位产生的离子假说,并因此分享1963年诺贝尔生理学或医学奖。1952年,安德鲁研究方向出现重大转换,对肌肉收缩产生浓厚兴趣。他敏锐地意识到普通光学显微镜研究肌肉收缩时存在分辨率低这一巨大劣势,而干涉显微镜一定程度上可弥补这一缺陷。为此,安德鲁组装了一台干涉显微镜,同时招募德国生理学家尼德格尔克(Rolf Niedergerke,1921—2011)加入实验室。他们使用干涉显微镜对横纹肌观察后发现,肌肉收缩过程中A带宽度不变,只有H带相应变窄。当两位赫胥黎相遇并就他们的实验结果展开讨论时,最后得出高度一致的结论——滑动肌丝假说(图2)。这个研究结果最终于1954年在同一期英国《自然》杂志上背靠背发表(安德鲁小组论文发表在前)[5-6]。滑动肌丝假说认为:肌肉缩短和伸长均通过肌节内肌球蛋白和肌动蛋白相互间滑动来实现,其能量由肌球蛋白通过与肌动蛋白相互作用过程中催化ATP水解而将释放的化学能转化为机械能提供。滑动肌丝假说将肌细胞结构(A带和H带,细胞学范畴)、肌细胞组成(圣捷尔吉等发现的肌球蛋白和肌动蛋白,生物化学范畴)和肌肉收缩(生理学范畴)实现了有机整合,奠定了肌肉生理学基础,在分子运动生物学领域具有里程碑意义。

图2 肌肉滑动模型
虽然两篇论文提供了确凿证据,但滑动肌丝模型仍遭到许多科学家的质疑。圣捷尔吉(研究重心已转向癌症)就是其中之一,他难以置信肌动蛋白仅局限于A带。休斯在随后50年时间坚持不懈地推动肌肉收缩领域的发展。1958年,休斯观察到肌球蛋白的“跨桥”结构,即肌动蛋白通过头部附着于肌动蛋白丝形成复合物;1969年,他进一步提出详细描述肌丝滑动的摆动跨桥模型(swinging cross-bridge model)[7]。模型认为,缺乏ATP时肌球蛋白以人字形方式与肌动蛋白结合,而补充ATP可驱使二者分离。此时肌动蛋白出现划桨样运动(往复摆动),从而完成肌肉收缩和舒张(图2)。20世纪70年代开始,滑动肌丝假说和摆动跨桥模型逐渐被科学界接受。
3 体外运动系统
休斯本人不仅为肌肉收缩研究贡献一生,而且还为该领域培养了一大批青年才俊,美国生物化学家斯普迪赫(James Anthony Spudich)就是其中之一。
1968年,跟随著名酶学大师阿瑟·科恩伯格(Arthur Kornberg)获得生物化学博士学位的斯普迪赫加入休斯实验室从事博士后研究,重点研究肌肉收缩过程中的调节机制,在此期间阐明了钙离子通过影响跨桥形成而调节肌球蛋白和肌动蛋白间滑动。1971年,斯普迪赫回到美国,成为加州大学旧金山分校员工。他建立自己的实验室,联合运用生物化学、遗传学、结构生物学等方法探索生命分子运动中的未解难题,重点聚焦两个方面:体外运动系统的开发和非肌肉细胞运动特征。
1977年,斯普迪赫加入斯坦福大学,继续开发体外运动系统,但经多次尝试均未成功,直到1982年美国细胞生物学家希茨(Michael Patrick Sheetz)的到来。当时,希茨是华盛顿大学副教授,由于学术休假来到斯普迪赫实验室。尽管希茨在肌球蛋白运动方面毫无研究经验,但对建立体外运动系统充满极大信心。经过几个月的尝试和努力,希茨和斯普迪赫终获成功。他们首先让肌动蛋白附着于固体支持物表面,然后加入肌球蛋白包被的小球,结果第一次在体外观察到肌球蛋白在补充ATP后可沿肌动蛋白移动[8],研究体外证实了滑动肌丝假说的正确性,更重要的是为进一步研究非肌肉细胞分子运动提供了理想实验体系(图3)。斯普迪赫随后还对体外运动系统进行了完善和改进,最终于1985年进一步实现用纯化肌球蛋白、肌动蛋白和ATP重建了体内运动过程。
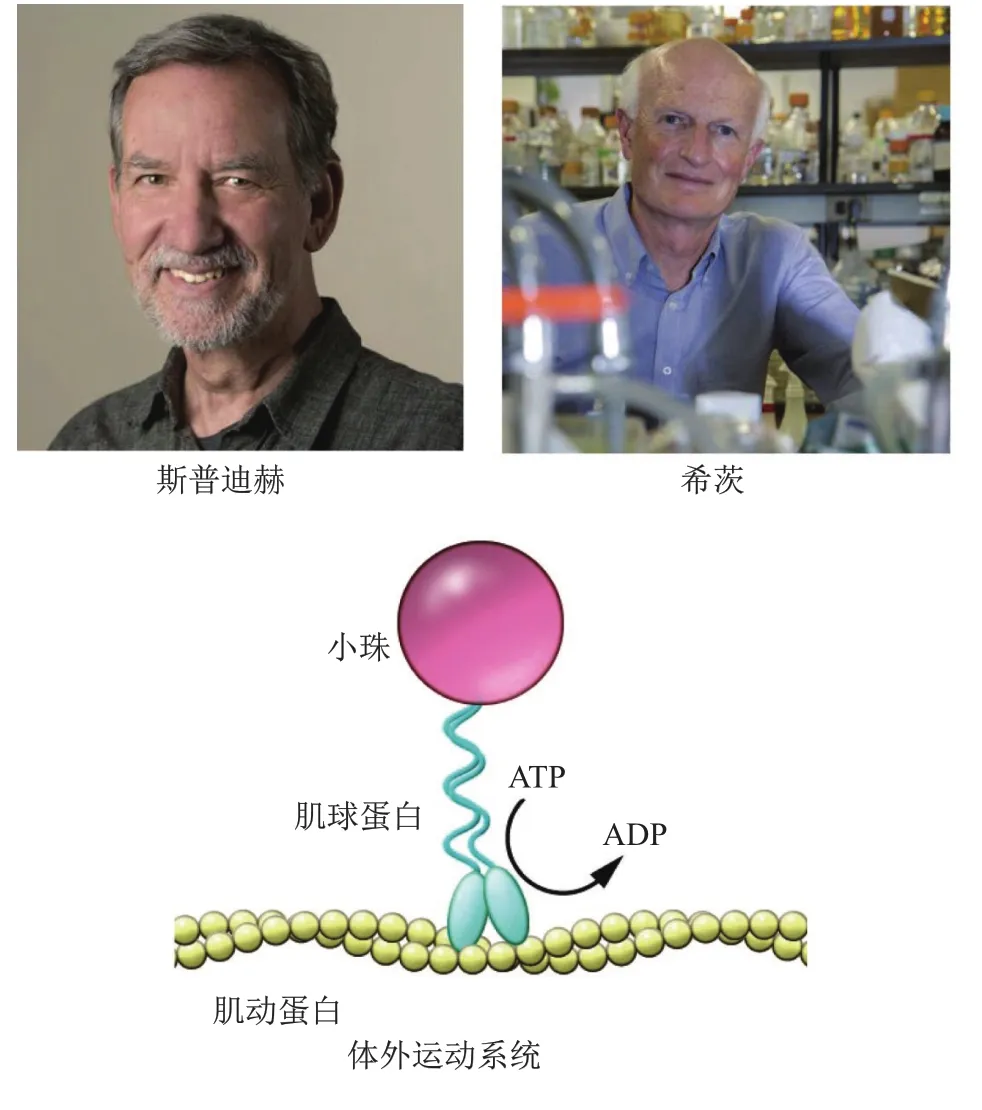
图3 体外运动系统
体外运动系统的构建成功吸引了众多年轻人的目光,美国生物化学家韦尔(Ronald David Vale)就是其中之一。1980年,韦尔从加利福尼亚大学圣巴巴拉分校毕业并获生物学和化学双学位,随后进入斯坦福大学攻读博士学位,重点研究神经细胞内物质运输机制,特别着迷于探索神经细胞体和末端之间长达1 m的轴突内物质运转之谜。当斯普迪赫和希茨成功地构建体外运动系统后,仅几层楼之隔的韦尔几乎第一时间就知道了这一信息,并敏锐地意识到该体系对自己当前的研究具有重要帮助。他立刻来到斯普迪赫实验室,经过讨论后韦尔与希茨形成共识,合作开展轴突运输的研究。
当时主流观点认为,非肌肉细胞可能与肌肉细胞采用相似的运动机制,而当韦尔与希茨使用轴突肌球蛋白交联的小球测试轴突内肌动蛋白时,他们未观察到运动的产生。经分析后他们认为肌动蛋白可能未发挥支架作用,并进一步采用体外重建方法证明是另一种支撑结构——微管(microtubule)参与了这一过程。
4 微管的发现
20世纪50年代,电子显微镜在细胞生物学领域的广泛应用大大加深了对亚细胞结构的理解和认识。1963年,研究人员在细胞内观察到众多小管状结构,命名为微管,但对这一结构的构成和功能却知之甚少,从而引起科学家的极大兴趣。1965年,美国芝加哥大学泰勒(Edwin Taylor)决定研究微管,并指派研究生波里希(Gary Borisy)负责。秋水仙碱(colchicine)是一种重要的生物碱,当时被发现可抑制细胞分裂,但机制不详。泰勒推测秋水仙碱可能是因为结合了细胞分裂过程中某种关键蛋白而抑制其活性。微管相关蛋白是候选对象之一。
1967年,波里希添加同位素标记的秋水仙碱到细胞提取物,进一步纯化到一种单一组分,称其为秋水仙碱结合蛋白。体外实验表明从富含微管的培养细胞、海胆卵、有丝分裂纺锤体和脑组织纯化的该蛋白在体外与秋水仙碱均具有较高结合能力,因此推测该蛋白就是微管组分[9]。1968年该蛋白被正式命名为微管蛋白。后续研究发现,微管主要包含两种亚基:α-微管蛋白和β-微管蛋白。二者首先组装为一个微管单位,微管单位再进一步聚合形成中空的微管结构。微管聚合与解聚是一个动态过程,该过程对细胞分裂具有至关重要的影响。常用抗癌药长春花碱等可破坏微管聚合,而紫杉醇则阻止微管解聚,它们均能造成细胞分裂停滞而最终死亡。
微管在多种细胞运动过程中发挥重要作用,包括细胞内物质运输、囊泡定位以及有丝分裂过程中染色体分离和纤毛/鞭毛摆动等。微管主要通过为两类马达蛋白——动力蛋白(dynesin)和驱动蛋白(kinesin)提供支持(类似肌动蛋白对肌球蛋白的作用)而参与细胞运动(图4)。微管可类比于一条细长高速公路,而马达蛋白则相当于路上货车,每时每刻都往复穿梭以保障“货物”及时、准确运达目的地,维持货车运行的能量来源则是马达蛋白水解ATP。
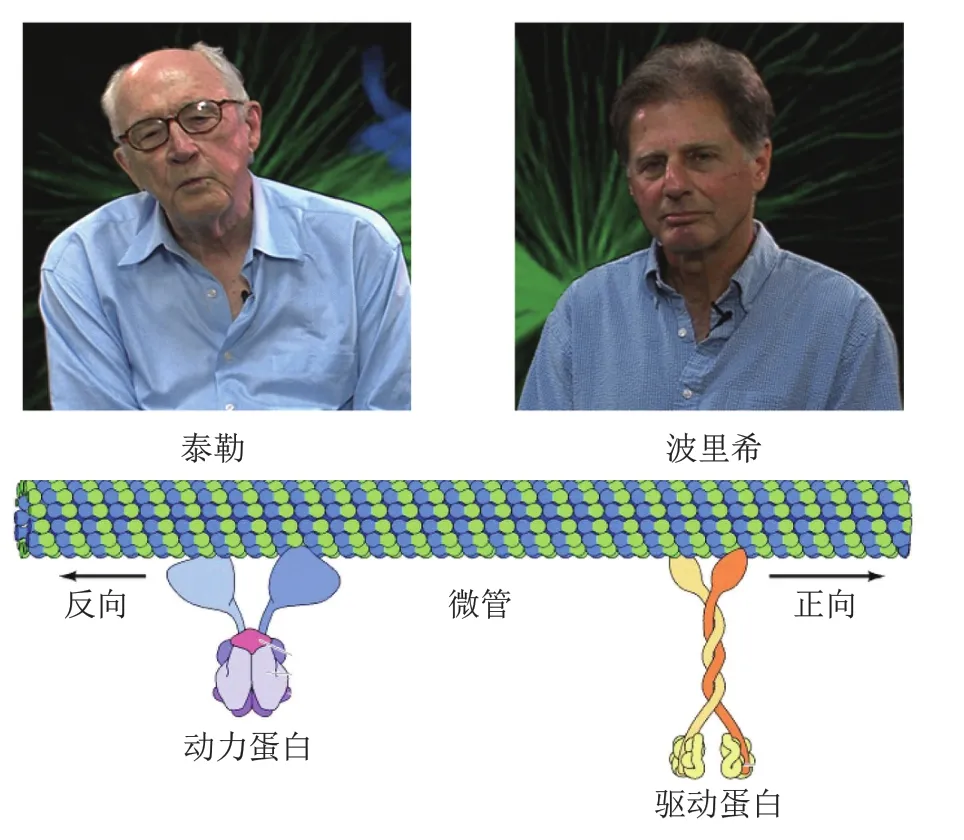
图4 微管的发现及在细胞运动中的作用
5 动力蛋白发现和作用
精子运动、黏液通过气道、纤毛和鞭毛运动等具有重要生理意义,因此吸引了众多生物学家的目光,其中包括英国著名生物物理学家吉本斯(Ian Read Gibbons,1931—2018)。1957年,吉本斯从剑桥大学获得生物物理博士学位,并于第二年进入哈佛大学主管电子显微镜室。借助电子显微镜,吉本斯观察到原生生物四膜虫鞭毛运动核心——轴索的结构,却不知其组成,因此决定寻找纤毛运动过程的关键蛋白。
1965年,吉本斯从四膜虫轴索中鉴定出一种ATP酶,并证明其活性和结构特征与四膜虫的轴丝弯曲功能相一致[10],因此命名为动力蛋白(dynein,来自希腊语dyne,意为“力”)。这是在非肌肉细胞鉴定的第一种马达蛋白,大大地推动了非肌肉细胞运动机制的研究。然而,当时的证据尚不足以证明动力蛋白参与了分子运动,吉本斯因此继续研究动力蛋白特性。为更好地获取材料,他于1967年加入夏威夷克瓦罗海洋实验室(Kewalo Marine Laboratory)。在这里,吉布斯发现从海胆精子尾部获取动力蛋白更便利,从而解决了材料来源问题。1972年,吉本斯成功地证明动力蛋白参与鞭毛运动的滑动微管模型,类似滑动肌丝假说,不过支持物不是肌动蛋白,而是微管(图5)。
20世纪80年代,韦尔开始研究轴突内物质运输,并证明细胞内物质运输并非采用自由扩散的方式进行,而是沿着特定轨道进行,这个轨道就是微管。韦尔的研究还表明单一微管上的物质运输为双向进行,其中从神经末端通过轴突向细胞体运输的“反向”运输由动力蛋白协助完成[11],这一结果表明动力蛋白不仅存在于鞭毛内,而且存在于细胞质中。
今天我们知道,动力蛋白是一种微管相关分子马达,分子量超大(可达2000 kD)。其重链球形头部含有ATP结合结构域,负责与微管结合;而轻链等其他组分则负责与“货物”如细胞器和囊泡等结合,最终通过自身运动达到货物运输目的。此外,动力蛋白还参与细胞分裂中染色体分离过程[12]。

图5 吉本斯与动力蛋白
6 驱动蛋白发现及作用
由于细胞质物质沿微管运输是双向方式,而动力蛋白只负责反向运输,那么正向运输由哪种蛋白负责呢?
美国细胞生物学家布雷迪(Scott Brady)借助视频增强光学显微镜已观察到无法水解的ATP类似物AMP-PNP可抑制轴突内物质正向运输。一方面无法水解AMP-PNP供能可抑制轴突运输,另一方面仍可促进“货物”(囊泡和细胞器)与微管结合,从而说明AMP-PNP诱导形成了一种包含货物、微管和微管相关马达蛋白的稳定复合物。
一直在研究轴突物质运输的韦尔决定纯化这种未知马达蛋白。他首先用AMP-PNP处理以稳定微管和分子马达等复合物,随后以紫杉醇为“钓饵”将复合物与其他组分分离,待去除微管蛋白和“货物”等以后最终获得一种新蛋白。体外实验表明这种新蛋白一方面可特异性与微管结合,另一方面具有ATP酶活性,在补充ATP后可促进微管滑动。该蛋白分子量远小于动力蛋白,因此是一种新型分子马达,命名为驱动蛋白(kinesin,来自希腊语kinein,意为“移动”)[13]。驱动蛋白由两条重链和两条轻链构成:轻链负责与囊泡和其他“货物”结合;重链含马达结构域,可水解ATP供能从而推动“货物”沿微管从细胞体向神经末端的快速 “正向”运输(图6)。
后续又发现一系列驱动蛋白,从而构成一个蛋白超家族。韦尔首先鉴定的那种被重新命名为驱动蛋白-1。驱动蛋白在真核细胞中广泛存在,参与了微管依赖的多种生命运动,如膜运输和有丝分裂/减数分裂过程中染色体运动。
7 马达蛋白的重要性
多种技术特别是单分子技术等在分子马达研究中的广泛应用使人们对生命运动有了全面理解和认识。肌球蛋白、驱动蛋白和动力蛋白是目前鉴定的三种分子马达,它们在蛋白质一级结构方面虽然存在巨大差异,但在关键结构域和作用机制上具有高度保守性:它们都包括ATP酶结构域和肌动蛋白(或微管)结合结构域;它们都采用滑动方式进行运动等[14]——当然肌球蛋白沿肌动蛋白滑动,而驱动蛋白和动力蛋白沿微管滑动。
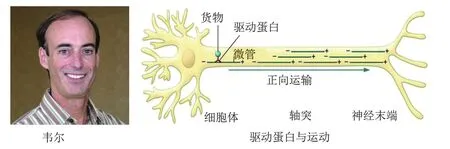
图6 韦尔和驱动蛋白
分子马达基因突变或功能异常可导致多种疾病发生[1]。例如:肌球蛋白及结合蛋白突变可造成家族肥厚性心肌病(该病常可诱发年轻运动员猝死);动力蛋白功能缺陷常可引发纤毛功能障碍,造成呼吸道慢性感染;驱动蛋白基因突变造成遗传性神经疾病和肾脏疾病等。
斯普迪赫实验室一直致力于研究心肌肥大和扩张型心肌病等发病分子机制,以期找到新的治疗药物从而避免心力衰竭和心脏猝死发生[15]。为此,斯普迪赫和韦尔等建立著名的生物制药公司——细胞动力学公司(Cytokinetics Inc.),主要研发肌肉激活剂以治疗先天或后天因素导致的肌肉功能损伤或衰退。该公司先后开发出骨骼肌肌钙蛋白激活剂Tirasemtiv和Reldesemtiv,用于治疗肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)和脊髓性肌萎缩症(spinal muscular atrophy,SMA)等;此外还开发出心肌肌球蛋白激动剂omecamtiv mecarbil,在心力衰竭治疗方面具有一定疗效。癌细胞转移是造成癌症患者死亡的主要原因,而转移与分子马达运动密切相关,因此分子马达运动相关研究也有望为癌症治疗提供新思路。
总之,分子马达鉴定和作用机制的阐明,一方面加深对许多生命现象的理解和认识,另一方面为众多医学应用奠定了坚实的基础。三位科学家斯普迪赫、希茨和韦尔由于在该领域的杰出贡献而分享有“小诺贝尔奖”之称的拉斯克基础医学奖。鉴于该发现的重要性,他们也有望将来分享诺贝尔奖,较生理学或医学奖,也许化学奖几率更高。
