PBK/TOPK表达对膀胱癌BIU-87细胞增殖及迁移能力的影响
2019-02-19贾建民葛永超
贾建民,段 堃,李 岩,赵 艳,夏 伟,吴 凡,葛永超
膀胱癌是泌尿系统最常见的恶性肿瘤,严重威胁人类的生存健康,目前关于其发病机制仍不清楚[1-2]。由于在临床中缺乏膀胱癌筛查及早期诊断的分子标志物,很多患者被确诊时已进展为中晚期[3]。寻找膀胱癌有效的早期筛查及诊断分子标志物,仍需要依靠基础研究的进展。PDZ连接激酶/T-LAK细胞源蛋白激酶(PDZ-binding kinase/T-LAK cell-originated protein kinase,PBK/TOPK)为一种丝-苏氨酸激酶,属丝裂原活化蛋白激酶激酶(mitogen activated protein kinase kinase,MAPKK)分子家族成员,目前研究表明其表达与多种恶性肿瘤的发生相关[4-6]。在膀胱癌组织中发现PBK/TOPK呈高表达[7],PBK/TOPK表达是否影响膀胱癌BIU-87细胞的增殖及迁移能力,目前尚不清楚。本研究旨在进一步探讨膀胱癌中PBK/TOPK的表达,及其表达对膀胱癌BIU-87细胞增殖和迁移能力的影响。
1 资料与方法
1.1 一般资料 收集2016年1月—2016年12月郑州大学第五附属医院膀胱癌患者的手术切除标本,共40例,所有患者均经病理学确诊,其中男性30例,女性10例,年龄55~65岁,平均年龄62岁。所有患者术前均未接受放疗、化疗及生物免疫治疗。癌旁组织为癌旁>3 cm的膀胱组织,所有新鲜标本均置于液氮中保存。
1.2 主要仪器与试剂 RNAiso PLUS(日本TaKaRa公司),氯仿(南京化学试剂股份有限公司),异丙醇(南京化学试剂股份有限公司),紫外分光光度计(美国ABI公司,型号:photoLab 6100),逆转录及定量PCR试剂盒(日本TaKaRa公司),7500 PCR仪(美国ABI公司,型号:ABI7500),PBK/TOPK多克隆抗体(美国Abcom 公司),单克隆甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国ABI公司),膀胱癌BIU-87细胞株(上海锐聪实验中心),胎牛血清(南美hyclone公司),DMEM(Dulbecco minimum essential medium,DMEM)必需培养基(上海中乔新舟生物科技公司),CO2孵箱(济南鑫贝西生物技术有限公司,型号:BPX-250-Z/BPX-250-ZS/BPX-150-Z),CCK-8(Cell Counting Kit 8)溶液(北京沃比森科技有限公司),酶标仪(南京华东电子集团医疗装备有限责任公司,型号:DG5035A),Transwell小室(北京明阳科华生物技术有限公司),姬姆萨染色液(厦门海标科技有限公司)。
1.3 实时定量PCR(quantificational real time-PCR,qRT-PCR) 收集新鲜的膀胱癌及癌旁正常膀胱组织标本,加入液氮,研磨成粉末加入1 mL RNAiso PLUS充分裂解细胞,室温静置5 min。按照0.2 mL氯仿/1 mL RNAiso PLUS的比例加入氯仿,漩涡振荡器上剧烈振荡15 s,室温静置5 min;4 ℃、12 000 rpm离心20 min,取上清液再加入等体积的异丙醇沉淀RNA,室温静置10 min后,4 ℃、12 000 rpm离心10 min,弃去上清,用焦碳酸二乙酯水溶解沉淀,于紫外分光光度计测定A260/A280,计算RNA的浓度,取A260/A280值为1.8~2.0进行后续实验。
采用逆转录及定量PCR试剂盒,严格按操作步骤进行,其中逆转10 μL体系包括2 μL的5×PrimeScriptTMRT Master Mix、500 ng的RNA,加RNase-freed H2O至10 μL,逆转条件为37 ℃15 min,85 ℃灭活15 s。上样量为20μL体系[包括SYBR PremixEx TaqTMⅡ(2×)10 μL,上游引物及下游引物各0.4 μL,cDNA模板2 μL,ddH2O 7.2 μL],于7500 PCR仪定量检测。反应条件为95 ℃预变性34 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环,其中,PBK/TOPK上游引物序列为:5′-GAGAGTGGCTTTCACAATGGA-3′,下游引物序列为:5′-GGCCGGGATATTTATAGTTGGA-3′;内参β-actin上游引物序列为:5′-TGGCACCCAGCACAATGAA-3′,下游引物序列为:5′-CTAAGTCATAGTCCGCCTAG AAGCA-3′,引物均由深圳华大基因有限公司设计合成。样本均设3个复孔,以2-△△ct计算mRNA的相对表达量,即:△Ct=(目的基因-内参基因),△△Ct=△Ct患者-△Ct对照,以2-△△Ct作为目的基因的相对表达量。
1.4 免疫印迹实验(Western Blot) 收集新鲜标本,加入液氮,研磨成粉末加入蛋白裂解液及蛋白酶抑制剂,采用蛋白定量法测定蛋白浓度。以50 μg蛋白上样于聚丙烯酰胺凝胶电泳凝胶2 h,再将蛋白转印至聚偏二氟乙烯膜,封闭后滴加PBK/TOPK多克隆抗体(稀释比例1∶1 500)和单克隆GAPDH抗体(稀释比例1∶2 000),置于4 ℃冰箱孵育过夜。Tris缓冲盐水洗涤后,滴加二抗孵育1 h,采用增强型化学发光法定量检测PBK/TOPK蛋白表达。
1.5 细胞培养及转染 参见相关文献[8],将膀胱癌BIU-87细胞采用含15%胎牛血清的DMEM完全培养基置于37℃,5%CO2孵箱中培养。实验分为干扰组、对照组及过表达组,干扰组转染特异性siPBK/TOPK干扰片段,对照组转染无关序列,过表达组转染外源性PBK/TOPK质粒。siPBK/TOPK干扰片段为:5′-CCCUGAGGCUUGUUACAUUdTdT-3′,PBK/TOPK干扰片段、过表达质粒及无关序列均由上海吉凯生物有限公司设计合成。
1.6 CCK-8细胞增殖实验 胰酶消化细胞,调整细胞密度为2×104/mL,取100 μL细胞悬液铺板于96孔板,铺板后12 h,加入CCK-8溶液培养4 h,于酶标仪上测定细胞的光密度(optical density value,OD)值,波长设为570 nm,每组设5个副孔,连续观察5 d。
1.7 Transwell细胞迁移实验 胰酶消化细胞,调整细胞密度为2×105/mL,取500 μL细胞悬液加入Transwell小室的上室,同时加入500 μL含20%胎牛血清的培养基于小室的下室,置于37 ℃,5%CO2培养箱内培养。24 h后,取出小室,用棉签擦去Transwell上室内未穿过滤膜的细胞,经95%酒精固定后行姬姆萨染色液染色,在高倍显微镜下(20×)随机取10个视野,统计迁移出Transwell上室的细胞数量。
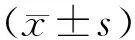
2 结果
2.1 PBK/TOPK在膀胱癌组织中的表达 qRT-PCR检测结果表明:膀胱癌组织中PBK/TOPK mRNA表达水平明显高于癌旁组织,差异比较具有统计学意义(t=12.324,P=0.000);同时,Western Blot检测结果显示PBK/TOPK蛋白在膀胱癌组织中的表达也明显高于癌旁组织,图1。
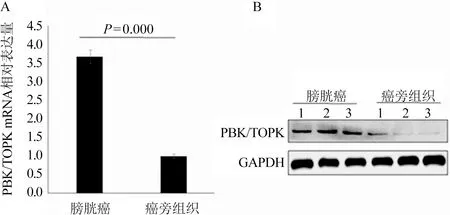
图1 qRT-PCR及Western blot检测PBK/TOPK在膀胱癌组织中的表达
2.2 膀胱癌BIU-87细胞中PBK/TOPK表达的干扰及过表达 经转染PBK/TOPK干扰片段后,PBK/TOPK mRNA在膀胱癌BIU-87细胞中的表达明显下调,差异具有统计学意义(t=-62.191,P=0.000,表1)。同时,经转染PBK/TOPK过表达质粒后,PBK/TOPK mRNA在膀胱癌BIU-87细胞中的表达明显高于对照组,差异具有统计学意义(t=11.887,P=0.007,表2);同时,Western Blot检测结果表明经转染后PBK/TOPK蛋白均被成功地敲低及过表达,图2。
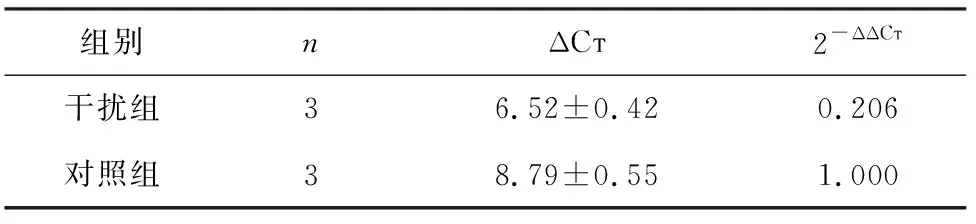
表1 qRT-PCR检测干扰后膀胱癌BIU-87细胞中PBK/TOPK mRNA的表达水平
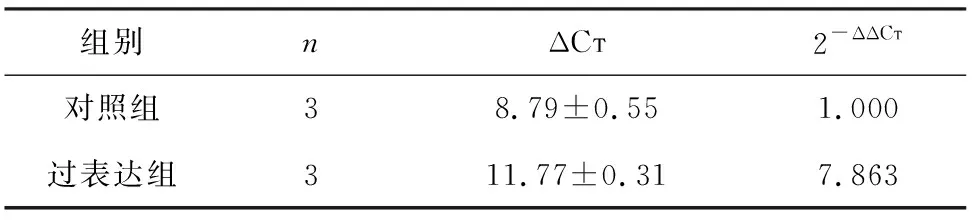
表2 qRT-PCR检测过表达后膀胱癌BIU-87细胞中PBK/TOPK mRNA的表达水平
2.3 PBK/TOPK表达对BIU-87细胞增殖及迁移能力的影响 CCK-8实验结果表明干扰PBK/TOPK表达能明显抑制BIU-87细胞的增殖,而PBK/TOPK过表达能明显促进BIU-87细胞的增殖(图3,P=0.000)。Transwell实验结果表明干扰PBK/TOPK表达能明显抑制BIU-87细胞的迁移(t=20.212,P=0.000),而PBK/TOPK过表达能明显促进BIU-87细胞的迁移(t=16.652,P=0.000),图4。
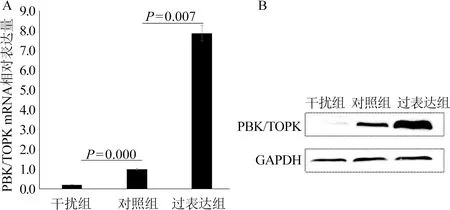
图2 qRT-PCR及Western Blot检测转染后PBK/TOPK在膀胱癌BIU-87细胞中的表达
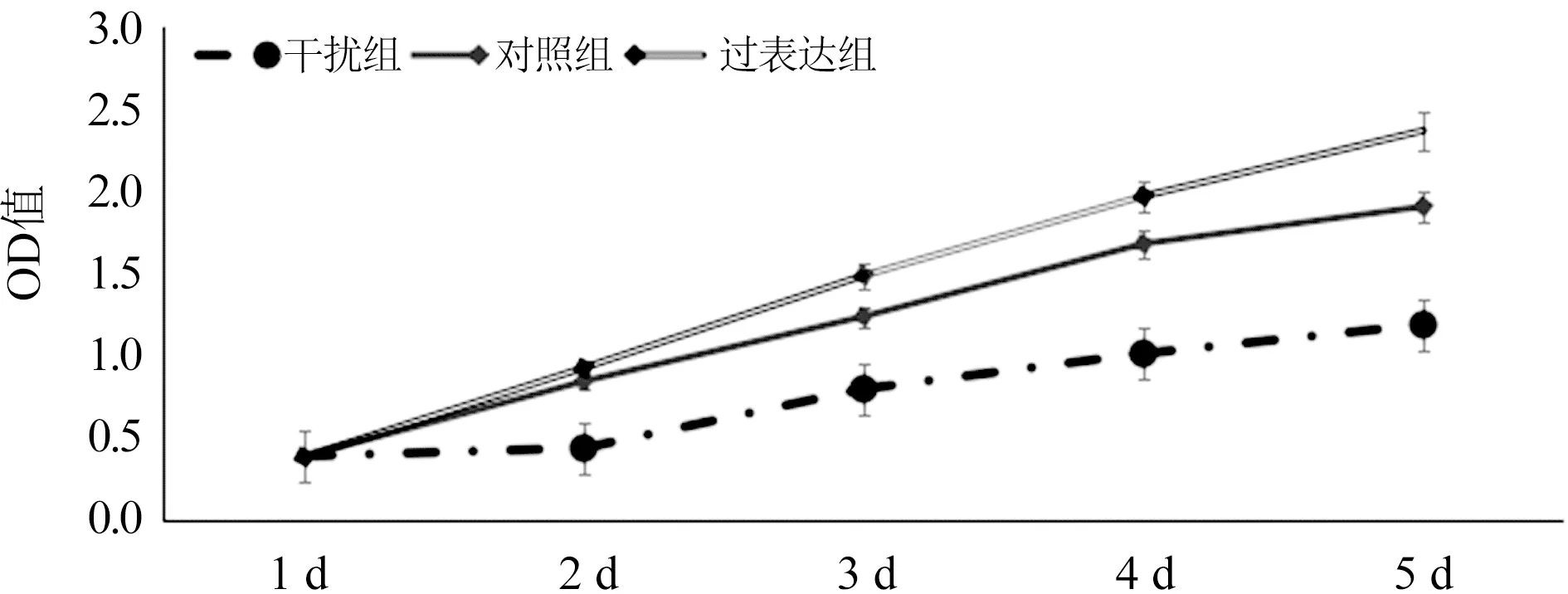
图3 PBK/TOPK表达与膀胱癌BIU-87细胞增殖的关系
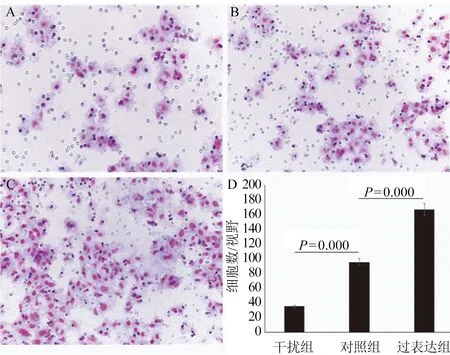
A:PBK/TOPK干扰组细胞的迁移数(20×);B:PBK/TOPK对照组细胞的迁移数(20×);C:PBK/TOPK过表达组细胞的迁移数(20×);D:细胞迁移数统计学分析图4 PBK/TOPK表达与膀胱癌BIU-87细胞迁移的关系
3 讨论
PBK/TOPK是一种丝-苏氨酸激酶,首先由Gaudet等[4]于2000年在Hela细胞cDNA文库中克隆出来,命名为PBK。随后,Abe等[9]构建T-LAK细胞cDNA文库克隆出新型的蛋白激酶,命名为TOPK,然而通过序列分析发现TOPK与PBK为同一种分子,为此命名为PBK/TOPK。PBK/TOPK含有322个氨基酸,介导淋巴因子激活的杀伤T(T-LAK)细胞的细胞毒作用。由于PBK/TOPK缺少MAPKK家族中维持催化功能的重要结构域,因此PBK/TOPK本身没有催化活性,主要参与调控肿瘤细胞的增殖及细胞周期中有丝分裂期的纺锤体形成,其异常表达具有强烈的细胞致癌潜能[5]。目前研究表明PBK/TOPK在多种恶性肿瘤中均呈高表达,如非小细胞肺癌、结直肠癌、乳腺癌及白血病等[10-13]。此外,Singh等[7]检测了PBK/TOPK在65例膀胱癌组织中的表达,发现PBK/TOPK阳性表达率为64.6%,其在肌层浸润性膀胱癌中的表达明显高于非肌层浸润膀胱癌组织中的表达,提示PBK/TOPK表达可能有助于膀胱癌细胞的增殖及侵袭,然而仍缺乏可靠的实验依据。因此,探讨PBK/TOPK在膀胱癌发生发展中的生物学功能仍具有潜在的研究价值。
本研究结果显示PBK/TOPK在膀胱癌组织中的表达明显高于癌旁正常组织,与相关报道一致[7],进一步提示PBK/TOPK阳性表达与膀胱癌的发生有关,可能为膀胱癌的分子标志物。此外,通过干扰及过表达PBK/TOPK在膀胱癌BIU-87细胞中的表达,发现干扰PBK/TOPK表达明显抑制了膀胱癌细胞的增殖及迁移,而PBK/TOPK过表达能明显促进膀胱癌细胞的增殖及迁移。这些结果提示PBK/TOPK在膀胱癌中具有调控细胞增殖及迁移的能力,可能会影响膀胱癌患者的病情进展。同时,在非小细胞肺癌、乳腺癌及白血病中发现PBK/TOPK表达也有助于肿瘤细胞的增殖[10,14-15],与本研究结果较为一致,均提示PBK/TOPK表达有助于肿瘤细胞的增殖。此外,PBK/TOPK表达与口腔癌及肺癌患者的预后相关[10,16],然而,PBK/TOPK表达是否会影响膀胱癌患者的预后,目前仍不清楚,有待进一步研究。
目前,关于PBK/TOPK在膀胱癌中的作用机制尚不清楚。研究发现PBK/TOPK在乳腺癌中能通过激活p38及MAPK信号通路促进细胞的增殖[17]。在肺癌中,TOPK/PBK能通过PI3K/PTEN/AKT信号通路促进细胞的迁移[18]。然而,PBK/TOPK促进膀胱癌细胞增殖及迁移的机制是否与p38、MAPK及PI3K/PTEN/AKT信号通路有关仍不清楚,有待于进一步的深入研究。
