丹参乙酸镁通过抑制TGF-β途径减轻脑缺血/再灌注损伤的保护作用及机制
2019-02-19詹舒仪黄露露龙思齐周雅倩雷文枚
詹舒仪,黄露露,龙思齐,周雅倩,雷文枚,娄 峥
缺血性脑卒中是临床常见心脑血管疾病,其病因通常是由于血栓形成、血管畸形造成局部脑组织缺血缺氧而导致神经细胞凋亡、坏死。现阶段治疗方法一般采用组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)进行溶栓治疗,使组织尽快恢复供血,部分患者在使用上述治疗方法后会出现病情加重的结果,称为缺血/再灌注损伤,其中再灌注损伤甚至超过了缺血损伤。缺血/再灌注损伤涉及机制较为复杂,涉及氧化应激、炎症反应、神经兴奋性毒性等方面[1],而氧化应激又是学界的研究热点。
丹参作为我国传统中药,具有活血通络、清心除烦的广泛作用,丹参多酚酸盐是丹参的水溶性提取物,其中主要成分为丹参乙酸镁[2]。现代研究认为丹参乙酸镁可以通过抑制血小板激活来抑制血栓形成,同时具有良好的抗氧化作用,丹参多酚酸盐注射液现阶段已经成为心肌缺血的辅助用药,已有使用丹参多酚酸盐用于缺血性脑卒中治疗的循证医学研究[3],而我们前期研究发现丹参多酚酸盐/丹参乙酸镁可以用于脑缺血/再灌注的氧化应激损伤,保护神经细胞,维持正常生理功能,该作用与抑制中枢系统内NADPH氧化酶(NADPH oxidase,NOX)水平有关[4-5]。但NOX上游调节机制并不十分清楚,本研究拟探讨丹参乙酸镁通过转化生长因子-β1(transforming growth factor-β1,TGF-β1)途径对脑缺血/再灌注损伤的保护作用及其机制,为临床使用丹参乙酸镁治疗缺血性脑卒中提供理论基础。
1 材料与方法
1.1 材料 健康雄性清洁级SD大鼠,体重250~300 g,湖南斯莱克景达实验动物有限公司提供[动物合格证号:SCXK(湘)2011-0003]。实验仪器:Western Blot装置(美国Bio-Rad公司),7500 Real-time PCR仪(美国ABI公司),多功能酶标仪(美国Beckman公司),ChemiDoc XRS+成像系统(美国Bio-Rad公司)。实验试剂:丹参乙酸镁(上海绿谷制药股份有限公司),2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC,南京建成生物工程研究所),NOX活性试剂盒(杰美基因医药科技有限公司),Power SYBR Green PCR Master Mix试剂盒(日本Takara公司),pSMAD2、pSMAD3、ALK5兔抗体(美国Santa Cruz公司),TGF-β1 ELISA试剂盒(英国Abcam公司),H2O2检测试剂盒(江苏碧云天生物技术研究所)。
1.2 方法 构建线栓法脑缺血/再灌注模型[4-5]:10%水合氯醛腹腔麻醉实验动物后,暴露并分离左侧颈总动脉(common carotid artery,CCA),颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。结扎CCA近心端及ECA,用动脉夹暂时夹闭ICA。于CCA远心端放置一打好结的备用丝线,在此线下端剪一小口,将MCAO栓线(北京沙东生物技术有限公司,栓线头部直径为0.40±0.02 mm)插入至ICA,收紧丝线,放开ICA上的动脉夹,顺ICA将栓线送至颅内,从CCA分叉处算起,插入深度为约20 mm。阻断血流2 h后,栓线取出以实现再灌注,同时将备用线结扎CCA远心端,并缝好皮肤,再灌注24 h后处理动物。
32只SD大鼠按数法随机平均分为4组:假手术组(sham组),分离出CCA、ECA和ICA,不插入栓线;脑缺血/再灌注组(I/R组),缺血2 h,再灌注24 h;脑缺血/再灌注+丹参乙酸镁组(I/R+MLB组),再灌注后30 min舌下静脉给药(用量:20 mg/kg 0.9% NaCl溶解);脑缺血/再灌注+溶媒组(I/R+vehicle组),再灌注后30 min舌下静脉给药0.9%NaCl溶液。
1.3 神经功能评分 参照Longa等[6]的五级4分评分并改进的方法,待大鼠清醒后由多名实验人员进行神经功能评分。0分:无神经缺损症状;1分:对侧前肢屈曲、不能伸直、同侧霍纳征,表现出提颈时左上肢向下、不能上抬;2分:向外侧转圈;3分:行走时向对侧倾倒;4分:不能自发行走,意识丧失。1~4分为有效模型。评分为1~3分纳入实验动物,小于1分的动物舍弃。符合评分但有蛛网膜下腔出血、麻醉后未清醒及术后死亡作为缺失值,予以剔除。因上述因素导致各实验组动物数不足者,则随时补齐动物数并重复实验,如出现评分分歧,取评分高分。
1.4 梗死体积检测 再灌注24 h后用10%的水合氯醛腹腔注射麻醉大鼠,迅速将脑取出,去掉嗅球及后脑,从额极开始切取4张冠状脑片,厚约2.0 mm,立刻置于1% TTC溶液中,37 ℃避光孵育30 min,期间翻动脑片2~3次使染色均匀。最后用10%多聚甲醛溶液浸泡固定24 h,将每组脑片排列整齐后进行扫描。再应用图像处理软件Image J测出各区脑梗死面积,根据公式:梗死体积=[(各片正面梗死面积之和+各片反面梗死面积之和)/2]×每片厚度,同样方法计算出全脑体积。
1.5 TGF-β1水平检测 应用双抗体夹心法测定TGF-β1水平。用纯化的大鼠转化TGF-β1抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入TGF-β1,再与辣根过氧化物酶(horse radish peroxidase,HRP)标记的TGF-β1抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物四甲基联苯胺(tetramethylbenzidine,TMB)显色。按TGF-β1 ELISA试剂盒说明书进行实验操作。
1.6 ALK5 mRNA水平检测 利用荧光定量实时PCR仪进行反应。按照Power SYBR Green PCR Master Mix试剂盒步骤扩增目的基因片段。Real-time PCR反应条件:95℃预变性30 s,95℃变性5 s,60 ℃退火和延伸31 s,共40个循环。反应完成后,接着运行溶解曲线程序,检测扩增产物特异性,用7500 System SDS软件分析数据。激活素受体激酶5(activin receptor-like kinase 5,ALK5)引物序列为:上游引物序列5′-TTGTTGAGGAGAAGCTGAGGC-3′、下游引物序列5′-CACTGTAATGCCTTCGCCCC-3′。
1.7 蛋白水平检测 凝胶上样孔每孔加40~50 μg变性好的蛋白,装配好垂直电泳装置,置电泳缓冲液中恒压80 V电泳约30 min,待样品进入分离胶后,恒压120 V,待溴酚蓝到达底部时结束电泳。把电泳后的凝胶放在聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,252 mA恒定转膜2 h。将转膜后的PVDF放入含有5%的脱脂奶粉的三乙醇胺缓冲液(tris buffered saline tween,TBST)中,37 ℃摇床封闭1 h;用TBST将牛奶洗掉,一抗4 ℃摇床孵育过夜,TBST洗涤3次,每次10 min;室温摇床孵育二抗1 h,TBST洗涤3次,每次10 min;将高灵敏的BeyoECL Plus发光剂加到PVDF膜的正面,采用ChemiDoc XRS+成像系统进行拍照分析,并利用Image Lab软件进行灰度值分析。
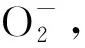
1.9 H2O2水平检测 H2O2是NOX下游的重要氧化物,也是造成细胞损伤的重要活性氧。按厂家提供标准品制备标准曲线,在将脑组织匀浆液和NG108-15神经细胞裂解液与试剂盒工作液反应,于酶标仪540 nm检测吸光度值,再根据标准曲线计算出样品中H2O2水平。
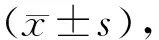
2 结果
2.1 丹参乙酸镁对缺血/再灌注大鼠神经功能评分、死亡率和脑梗死体积的影响 图1A、B所示,sham组神经功能评分均为0分,且实验过程中无动物死亡,I/R组大鼠在缺血/再灌注后,出现较严重的神经损伤(P<0.05),且有33%的动物死亡;在丹参乙酸镁干预下,与I/R组比较神经损伤明显减轻(P<0.05),死亡率也从33%下降到了11%(χ2=9.084,P=0.028 2)。图1C、D所示,将脑组织进行TTC染色后,非梗死区域呈红色,梗死区域呈白色,与sham组比较I/R组大鼠有较大梗死区域(t=7.712,P=0.006),丹参乙酸镁干预下可以明显缩小梗死体积(t=6.255,P=0.000 1)。
A图为中位数,D图为均数±标准差(n=8);与sham组比较*P0.05,与sham组比较**P0.01,与I/R组比较+P0.05,与I/R组比较++P0.01图1 丹参乙酸镁对缺血/再灌注诱导的大鼠神经功能评分、死亡率和脑梗死体积的影响
2.2 丹参乙酸镁对缺血/再灌注大鼠脑组织中TGF-β1和ALK5水平的影响 如图2所示,ELISA结果可见TGF-β1在脑缺血/再灌注模型中,含量较sham组有所增高(t=2.938,P=0.014 8),而TGF-β1受体ALK5在缺血/再灌注过程中,mRNA水平(t=6.023,P=0.01)和蛋白水平(t=3.572,P=0.01)较sham组都显著增高,TGF-β1/ALK5通路作用增强。给予丹参乙酸镁干预后,与I/R组比较TGF-β1含量下降(t=2.515,P=0.023 6),但是ALK5的转录(t=0.125 3,P=0.902 8)和翻译(t=0.052 91,P=0.958 8)并没有变化。
2.3 丹参乙酸镁对缺血/再灌注大鼠脑组织中pSMAD2/3水平的影响 当TGF-β1与其受体ALK5结合后,下游的信号转导蛋白SMAD2/3发生磷酸化,激活态的pSMAD2/3进入细胞核从而影响NOX的表达。如图3所示,与sham组比较,I/R组TGF-β1和ALK5水平增高后,pSMAD2(t=5.313,P=0.000 3)和pSMAD3(t=9.649,P=0.001)的蛋白含量明显升高,丹参乙酸镁可以有效降低缺血/再灌注模型中pSMAD2(t=3.471,P=0.006)和pSMAD3(t=8.061,P=0.001)的激活。
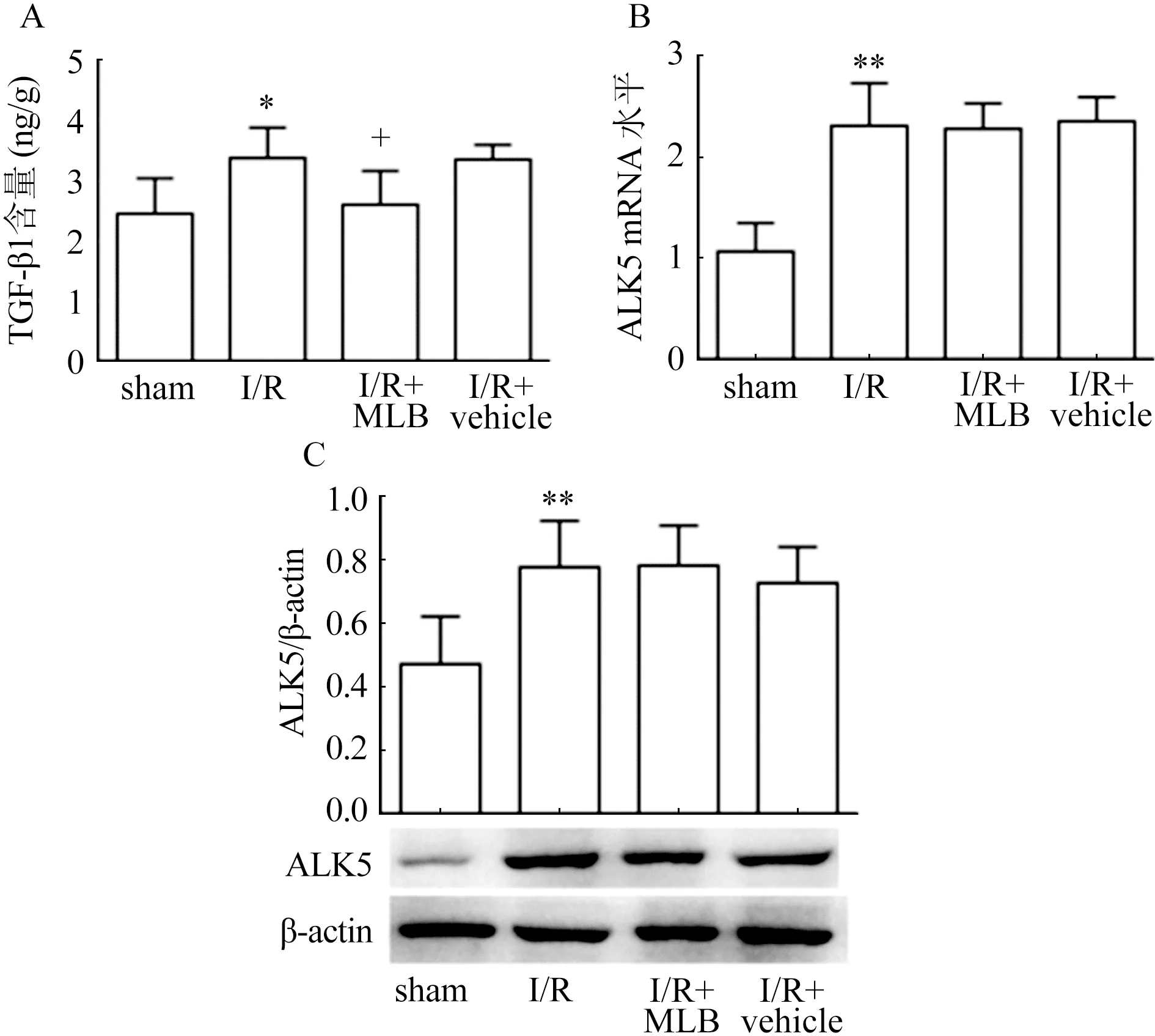
数据为均数标准差(n=8),与sham组比较*P0.05,与sham组比较**P0.01,与I/R组比较+P0.05,与I/R组比较++P0.01图2 丹参乙酸镁对缺血/再灌注大鼠脑组织中TGF-β1和ALK5水平的影响
2.4 丹参乙酸镁对缺血/再灌注大鼠脑组织中NOX活性、H2O2水平的影响 如图4所示,与sham组相比,I/R组pSMAD2/3水平升高,引起下游NOX表达增多,酶活性增高(t=5.04,P=0.005),H2O2水平提升(t=5.217,P=0.004)。丹参乙酸镁给药组可以减少脑缺血/再灌注引起的NOX活性(t=5.677,P=0.000 2)和H2O2水平变化(t=4.445,P=0.001 2)。
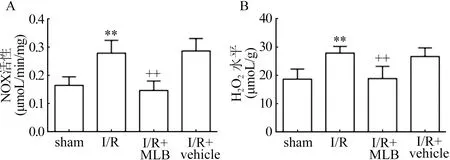
数据为均数标准差(n=8),与sham组比较**P0.01,与I/R组比较++P0.01图4 丹参乙酸镁对缺血/再灌注大鼠脑组织中NOX活性、H2O2水平的影响
3 讨论
缺血性脑卒中是心脑血管系统的常见疾病,通常是由脑血管畸形、狭窄或血栓堵塞血管而引起,在治疗窗内给予扩血管药或抗血栓药恢复供血后,部分患者出现更为严重的神经损伤情况,称为缺血/再灌注损伤。氧化应激是脑缺血/再灌注发生发展过程中一个很重要的机制,因为缺血引起氧和能量供应不足使线粒体功能紊乱,细胞内氧自由基生成增加和/或自由基清除能力不足,氧自由基在细胞内积聚,诱导细胞凋亡和坏死。对此,临床上会用自由基清除剂如依达拉奉等药物保护神经[9-10]。依达拉奉已在欧洲部分国家和日本上市,但其较严重的肝肾毒性限制了使用,因此寻找一个合适的抗氧化剂是十分必要的[11-12]。
丹参是我国中医中传统的活血化瘀药物,研究发现丹参的水溶性提取物丹参多酚酸盐和其主要成分丹参乙酸镁能够抑制血小板激活,并有广泛的抗炎、抗氧化应激的作用,可以在预后治疗阶段预防血栓的再次形成,又可以减少缺血/再灌注损伤,是理想的治疗缺血性脑卒中的潜在药物。我们前期研究中发现丹参乙酸镁能够通过抑制NOX生成,减少H2O2水平,有效保护脑缺血/再灌注模型大鼠的神经损伤、减小梗死区域、降低死亡率[4-5],本研究同样证明了该保护作用,但是其上游调控机制并不十分清楚。
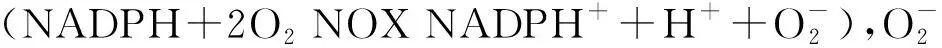
在脑缺血/再灌注模型中可以看到,I/R组大鼠经过缺血2 h、再灌注24 h后死亡率较高,存活大鼠的神经损伤严重,进行TTC染色后可见梗死体积较大,能够模拟临床缺血性脑卒中发病情况。在给予丹参乙酸镁干预后死亡率降低、神经损伤减轻、梗死体积明显减小,证明了丹参乙酸镁具有良好的抗缺血/再灌注损伤的作用,而该作用是通过什么机制实现的?作者发现I/R组的TGF-β1和其受体ALK5的水平都有所升高,TGF/ALK5通路核转录效应增强,使得SMAD2、SMAD3蛋白出现磷酸化,pSMAD2、pSMAD3水平显著提高,而磷酸化的pSMAD2、pSMAD3又使得NOX的表达增加,氧化活性增强,导致氧化应激,引起细胞凋亡、坏死。给予丹参乙酸镁干预后发现ALK5的表达依然较sham组有所升高,但TGF-β1的水平有所下降,I/R+MLB组减少TGF-β1生成后使得SMAD2/3磷酸化显著减少,其下游的NOX活性与H2O2水平均较I/R组有所下降。
综上所述,丹参乙酸镁可以通过减少TGF-β1的水平抑制TGF-β1/ALK5/SMAD2/3/NOX/H2O2通路,在脑缺血/再灌注损伤中发挥抗氧化应激的保护作用。
