TGF-β1与自噬基因Beclin1、LC3在椎间盘退变组织中的表达*
2019-02-17苏程果赵小艳刘华辉卢群文罗才贵朱明双
苏程果, 赵小艳,刘华辉,卢群文,袁 晔,罗才贵,朱明双△
1.成都中医药大学附属医院(成都 610075);2.四川宝石花医院 (成都 610213)
椎间盘退变是腰腿痛的重要诱因,而腰腿痛严重影响患者的生活质量,也为患者、患者家庭、社会带来严重的负担。目前椎间盘退变的机制和治疗方法仍需进一步研究。相关研究[1]表明,炎性反应、细胞外基质的分解、纤维环的破裂、椎间盘细胞的死亡等在椎间盘的退行性变过程中起关键作用。其中椎间盘髓核细胞数量的减少是椎间盘退变的关键因素,而细胞自噬对髓核细胞死亡有着重要的调控作用[2-3],Beclin1与LC3均为自噬相关基因,参与自噬体的形成[4]。TGF-β1为转化生长因子, 可调节细胞的生长和分化,与椎间盘退变关系密切。本研究主要观察兔椎间盘退变组织中TGF-β1与Beclin1、LC3的表达,亦进一步探讨椎间盘退变的机制。
1 材料与方法
1.1 实验动物
实验动物为4月龄新西兰大白兔20只,体重为2.0~2.5 kg,购买于成都达硕实验动物有限公司,动物许可证号为: SCXK(川) 2018-17,研究符合动物实验伦理许可。
1.2 主要实验试剂
RNA提取液(武汉Servicebio),三氯甲烷(上海国药集团);无水乙醇(上海国药集团);HyPure TMMolecular Biology Grade Water(美国HyClone) RevertAid First Strand cDNA Synthesis Kit(美国Thermo)FastStart Universal SYBR Green Master(美国Roche)引物(成都生工);新型脱钙液(北京索莱宝);氢氧化钠(上海沪试)。
1.3 主要实验器械
台式高速冷冻离心机(DragonLab);荧光定量PCR仪(ABI);超微量分光光度计(Thermo);标准试剂型纯水仪(青岛富勒姆);匀浆仪(AKI生物);超低温冰箱(海尔);TIP头(Axygen Biosciences);脱水机 (武汉俊杰电子有限公司) ;包埋机(武汉俊杰电子有限公司);冻台(武汉俊杰电子有限公司);搅拌(DRAGONLAB);恒温摇床(BLabotery);电子秤(Electronic);18 G穿刺针。
1.4 方法
1.4.1 造模 借鉴黄杰烽等[5]的穿刺纤维环法制作椎间盘退变模型。20只白兔随机分成两组,空白组和模型组,每组10只。兔腰椎节段共7节,L1至L7的椎体和其间的椎间盘渐渐变大,腰椎的横突与脊柱成锐角,向白兔头侧发出,且横突长度从L1至L7渐渐增大;兔腰椎间盘位于横突起点前上方2.0~3.0 mm处[6],呈乳白色。模型组按3 mL/kg耳缘静脉注射10%水合氯醛麻醉,俯卧位固定好,备皮消毒,髂棘高点平对 L6椎体,用笔依次标记各段腰椎。然后触摸L5、L6的横突,左手拇指定位在两横突末端连线中点,右手持针在定位点上方约1 cm处与地面水平破皮,然后针向头侧略倾斜即刺入 L4-5椎间盘,此时针下会有滞涩沉紧感。再穿刺L3-4、L5-6椎间盘,左右各1次。术后连续 3 d肌注青霉素40万U/只。空白组不予特殊处理。
1.4.2 标本采集 6周后截取白兔第L3至L6腰椎及其间的椎间盘组织,每组随机选6个椎间盘放入-80°冰箱保存;另外每组随机选8个椎间盘放入体积分数4%甲醛溶液中固定24 h,预备做石蜡切片。
1.4.3 观察与检测 1)苏木精-伊红(HE)染色检测椎间盘组织形态学变化。标本24 h固定后,用新型脱钙液脱钙2个月,脱钙液更换周期为2~3 d。然后依次梯度酒精进行脱水,75%酒精2 h,85%酒精2 h,90%酒精1.5 h,95%酒精2 h ,无水乙醇Ⅰ 2 h,无水乙醇Ⅱ 2 h,醇苯40 min,二甲苯Ⅰ 40 min,二甲苯Ⅱ 40 min,65°融化石蜡Ⅰ 0.5 h,65°融化石蜡Ⅱ 1 h,65°融化石蜡Ⅲ 2.75 h。再进行石蜡包埋、以4 μm厚度切片,切片在摊片机40 ℃ 温水上将组织展平,载玻片将组织捞起,60 ℃ 烘箱内烤干。水烤干蜡烤化后取出常温保存备用。然后在光镜下观察椎间盘组织形态学变化,根据Han等[7-8]从髓核形态、髓核中细胞和基质形态、纤维环形态、纤维环中细胞的基质形态、纤维环和髓核的分界来评价椎间盘退变程度,分值5~15分,5分为正常椎间盘,15分为严重退变椎间盘。2 )RT-PCR检测TGF-β1与beclin1、LC3的表达。先抽提总RNA,取100 mg组织加入到含有1 mL,离心的Trizol Reagent匀浆管中充分研磨,以转速12 000 r/min,离心半径5.5 cm,离心10 min,取上清;加入250 μL三氯甲烷后离心取上清,加入0.8倍体积的异丙醇离心10 min,管底的白色沉淀即为RNA;加入15 μL无RNA酶的水溶解RNA,55 ℃孵育5 min;使用Nanodrop 2000检测RNA浓度及纯度。取2 μg RNA按照试剂盒操作进行反转录和定量PCR,结果处理采用ΔΔCT法计算TGF-β1与beclin1、LC3的表达量。引物序列如下表(表1)。

表1 引物序列
1.5 统计学方法
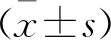
2 结果
2.1 各组椎间盘组织形态学评分
空白组椎间盘组织的软骨样基质中分布着形态一致的髓核细胞,细胞间质排列均匀,髓核与纤维环分界清晰,纤维环结构完整,排列清晰。模型组髓核细胞大量减少,髓核形状不规则,间质排列紊乱,局部纤维环结构紊乱;纤维环和髓核界限多不清晰。空白组和模型组组织形态学评分分别为(5.25±0.46)、(10.25±1.75)分,模型组高于空白组,差异有统计学意义(P<0.05),表明穿刺纤维环法促进了椎间盘的退变(图1)。

图1 HE染色结果
注: A:髓核细胞较少,髓核与纤维环界限不清(黑色箭头),纤维环内层可见少量嗜酸性小碎片(红色箭头);B:髓核内纤维结缔组织轻度增多(黄色箭头)。C、D:空白组大小形态相似的的圆形髓核细胞,细胞间质均匀一致,髓核与纤维环分界清晰,纤维环结构完整,排列清晰
2.2 椎间盘组织中TGF-β1、Beclin1、LC3的mRNA表达
RT-PCR结果显示,实验6周后,相对于空白组,模型组TGF-β1、Beclin1、LC3的mRNA表达量升高,差异有统计学意义(P<0.01)(表2)。


组别TGF-β1Beclin1CL3空白组1.78±0.471.03±0.411.70±1.44模型组26.22±10.7913.53±3.2116.86±8.26t5.549.454.43P<0.001<0.0010.006
3 讨论
TGF-β是一种具有多种生物功能的蛋白多肽细胞因子,由正常组织细胞及转化细胞产生,且TGF-β1有广泛的生物学作用,可调节多种细胞的活力与程序性细胞死亡[9]。TGF-β1具有促进椎间盘间充质细胞增殖和分化的作用,对机体脊柱中椎间盘的生长、发育及分化方面起重要作用。椎间盘退变与TGF-β1的表达有密切联系。Tolonen等[10]通过ELISA及PT-PCR实验证明了,TGF-β1可在椎间盘退变细胞高度表达,且TGF-β1与椎间盘退变程度呈显著正相关[11]。而椎间盘细胞的自噬和程序性细胞死亡与椎间盘的退变过程紧密关系,TGF-β1 作为调控脊柱发育及稳态维持的重要因子,可能参与椎间盘的自噬及退变过程[8]。
自噬目前被认为是与年龄有关的疾病或变性疾病的重要保护机制,是一种细胞分解代谢途径,导致溶酶体降解以及蛋白质和细胞器的再循环[12]。而LC3和Beclin 1为自噬小体标志物,常用以评价细胞自噬的程度[13]。LC3分Ⅰ型和Ⅱ型,当自噬发生,Ⅰ型 LC3经泛素样加工修饰过程与自噬膜表面的磷脂酰乙醇胺结合, 变成Ⅱ型 LC3,Ⅱ型 LC3蛋白结合并始终位于胞内自噬体的膜上,其含量与自噬泡数目呈正相关[4]。Beclin1为哺乳动物酵母Atg6基因的同源物,其通过与Ⅲ 型磷脂酰肌醇激形成复合物参与募集其他蛋白质,促进自噬体膜的形成,并引导其他Atg蛋白定位于自噬体膜[14]。LC3、Beclin1的表达可明确细胞内自噬水平。有研究[15]发现,自噬的活性随年龄和早期变性而降低。但也有相互矛盾的结果,非退行性成年大鼠的髓核细胞中可观察到低水平的自噬[16],而退行性大鼠髓核细胞中自噬水平显著增加[2]。几种可能的原因可解释自噬活性的组织差异。首先,实验椎间盘可能处于椎间盘退变过程的不同时期;再者,可能与干预措施有关,且自噬和程序性细胞死亡可并存[12]。
本研究HE染色结果显示,模型组的椎间盘组织形态发生一定的变化,表明穿刺纤维环促进了椎间盘的退变。RT-PCR结果表明,模型组椎间盘中TGF-β1、Beclin1、LC3的mRNA相对表达量均显著升高。正常椎间盘中TGF-β1的低含量表明,TGF-β1对正常的椎间盘有调节作用,而退变椎间盘中髓核细胞的改变可能刺激TGF-β1高表达,TGF-β1的增高可能与调节细胞活力、调节细胞外基质代谢和细胞自噬等相关。空白组中的椎间盘中有低水平自噬,亦表现了自噬在正常椎间盘髓核细胞中的生物学作用,而模型组椎间盘中退变椎间盘自噬基因Beclin1、LC3表达量均显著增高。而自噬作为Ⅱ型程序性细胞死亡发生在组织和器官的发育过程中,自噬既能发挥保护作用,也能促进细胞死亡,细胞自噬亦有助于防止髓核细胞退变[17]。
综上所述,本研究模型组退变椎间盘中TGF-β1、细胞自噬的表达增加,推测是对白兔退变椎间盘的一种调节机制。此次实验结果有助于进一步了解椎间盘退变的机制,TGF-β1与自噬基因Beclin1、LC3相互关系还需进一步研究。