四川省新生儿筛查中心新生儿先天性肾上腺皮质增生症筛查分析*
2019-02-17欧明才周婧瑶陈雪莲杨丽涓苏星月
胡 琦,欧明才,张 钰,周婧瑶,陈雪莲,杨丽涓,苏星月
四川省妇幼保健院 新生儿筛查科(成都 610045)
先天性肾上腺皮质增生症(congenital adrenalhyperplasia,CAH)为常染色体隐性遗传代谢病,由于类固醇激素在形成过程中,如21-羟化酶、11-羟化酶等先天性缺陷,使肾上腺皮质的作用减退,一些患儿还附带有电解质紊乱及性腺发育异常的症状[1]。21-羟化酶缺乏症(21-hydroxylase deficiency,21-OHD)是CAH里面较为常见的致病因子,在所有CAH中占90%以上[2]。21-OHD引起肾上腺皮质激素生物合成过程的代谢中前体17-羟孕酮(17-hydroxyprogesterone,17-OHP)升高,因此通过对血17-OHP含量的检测,可以作为诊断CAH的重要参考依据。
1 资料与方法
1.1 临床资料
四川省新筛中心2015年1月至2018年12月共对筛查片区接生单位271 283例活产新生儿进行了CAH筛查。
1.2 标本采集
标本采集严格遵守《新生儿疾病筛查采血技术规范》,在新生儿出生72 h以后,确保充分哺乳,然后从足跟内或外侧进行血液采集, 并将采集的血液滴于&903专用的采血滤纸之中,制作成干血斑。合格的干血斑每个标准为直径≥8 mm, 两面渗透。血斑在自然通风的条件下晾干,及时回收,并放置塑料袋内进行密封,随即放入4 ℃冰箱进行保存备用,同时必须确保样本在5个工作日内送检。
1.3 检测方法
芬兰雷博BioTek FLX-800荧光测定仪,17-OHP试剂盒(芬兰,雷博)。采用荧光酶免疫分析方法进行17-OHP浓度检测。实验操作过程按照试剂盒说明书进行。
1.4 质量控制
每批实验每块检测板均设标准曲线和低值、高值质控,保证检测结果的准确性和可靠性。每月上报卫生部临床检验中心室内质控数据,每年参加3次临床检验中心室间质评活动,成绩均合格。
1.5 结果判断
采用试剂盒厂家提供的17-OHP切值,正常体重足月儿(≥37 周)同一标本两次检测结果均≥30 nmol/L,早产儿(37 周)和低体重儿(2 500 g)初次结果≥30 nmol/L,召回重新采血,复查17-OHP,结果仍≥30 nmol/L,通知患儿抽血做生化及激素检测,必要时结合临床症状进行超声检查和基因诊断便于确诊。
1.6 统计学方法
采用SPSS 22.0统计学软件进行分析。经正态性检验,17-OHP水平呈偏态分布,17-OHP浓度水平以中位数(四分位数间距)描述,切值用99%位数法确定,组间比较用非参数多独立样本Kruskal Wallis检验,检验水准α除特殊说明外均设定为0.05。
2 结果
2.1 筛查情况
2015年1月至2018年12月,四川省新生儿筛查中心共开展CAH筛查271 283例, 因17-OHP阳性召回并确诊的患儿16例,其中失盐型14例,单纯男性化型2例(表1)。
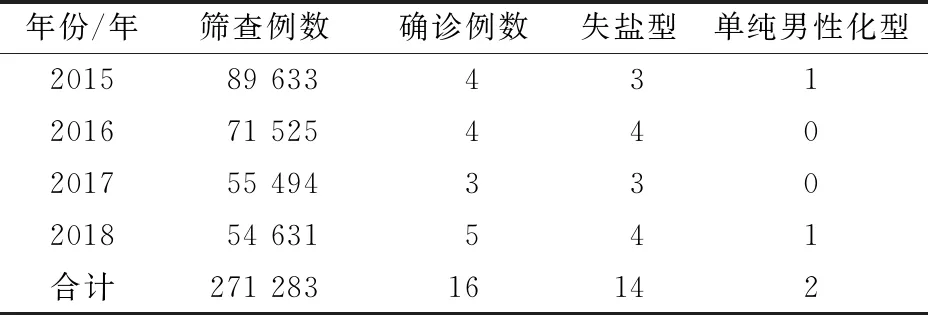
表1 2015-2018年四川省新生儿CAH筛查情况
2.2 召回流程的优化
剔除16例确诊新生儿,本研究将筛查样本中的早产儿和低体重儿的17-OHP浓度与正常体重足月新生儿的17-OHP浓度进行了比较,差异有统计学意义(P<0.05)。为了减少因新生儿早产和低体重引起的假阳性过高的问题,对于初次筛查结果17-OHP≥30 nmol/L的早产儿和低体重儿,取消原始血片复查环节,等纠正胎龄至足月,体重达到正常出生体重要求后再召回复查(表2)。

表2 早产儿、低体重儿和正常体重足月儿17-OHP浓度比较(nmol/L)
3 讨论
我院于2001年开展新生儿疾病筛查工作,对本院和本省部分地区出生的新生儿进行先天性甲状腺功能低下症和苯丙酮尿症的两病筛查,2005年1月四川省新生儿疾病筛查中心成立,我院即着手在全省范围内开展了新生儿的疾病筛查工作,并先后在全省范围内新建7个新筛分中心,截止2018年年底,全省的两病筛查率已达到95%。2015年我中心在省内率先开展了CAH的筛查,2015年1月至2018年12月已累计筛查CAH 271 283例,确诊16例。和传统两病筛查相比,目前CAH的筛查率仅有60%,主要原因是某些地区新筛管理机构筛查意识较弱和部分新筛分中心诊疗能力不足所致。在今后工作中会加强新生儿家长的健康教育,提高新筛分中心实验室检测和阳性儿的诊疗能力,早日提高筛查率。
新生儿17-OHP水平易受多种因素影响,多项研究[3-4]显示,早产和低体重是其中最重要的两个影响因素。早产儿和低体重儿因肾上腺皮质发育不成熟,导致17-OHP水平异常升高,而非酶的先天性缺陷[5]。本研究统计结果显示,早产儿17-OHP浓度99%分位数为82 nmol/L,低体重儿17-OHP浓度99%分位数为40 nmol/L,均远远大于试剂盒规定的30 nmol/L的切值。如果实验室使用单一的17-OHP≥30nmol/L者就召回复查的方法势必导致假阳性的增加。为了减少新生儿家长的担忧和试剂成本的浪费,本研究对早产儿和低体重儿减少了原始血片复查的环节,告知采血机构待足月和达到正常体重之后再采血复查。召回的早产儿和低体重儿17-OHP水平均降至正常,确诊的16例阳性儿均为足月正常体重新生儿。
21-OHD可以划分为典型与非典型两类,典型21-OHD又可以细分为失盐型与单纯男性化型。本项研究确诊的16例CAH患儿都属于经典型,其中包括14例的失盐型及2例单纯男性化型,未筛查出非典型,这可能与目前应用的筛查技术有关。相关报道[6]称,通过检测血片中17-OHP浓度筛查CAH只能检测出约70%的经典型21-OHD,对非典型21-OHD不敏感,有条件的实验室可以开展二级筛查技术,有可能提高筛查的特异性和阳性预测值,降低假阳性。
据报道[7-8],CAH发病率有明显的种族和地区差别,日本的发病率为1∶15 000,欧洲为1∶14 000~1∶10 000,北美为1∶15 000,我国上海发病率为1∶20 000,其发病率介于日本人和北美人之间。本项研究共计筛查新生儿271 283例,确诊CAH 16例,CAH发病率为1∶16 955。失盐型的21-OHD因为21-羟化酶的完全缺乏,患儿一般出生1~4周后发病,具体表现为脱水、呕吐和电解质絮乱,如果治疗不及时,极易死亡[9]。确诊的14例失盐型21-OHD中,有4例因严重的肾上腺危象合并其他先天性疾病,父母放弃治疗而死亡,其余均在治疗随访中,治疗效果良好。单纯男性化型21-OHD主要表现为雄激素升高,女性外生殖器男性化,因保留了部分酶活性,没有失盐症状[10]。确诊的1例单纯男性化型21-OHD的患儿已对外生殖器进行了矫形治疗,目前在随访中。
新生儿疾病筛查最重要的目的是在患儿出现临床症状前就进行确诊和治疗,最大程度减少疾病对患儿生长发育造成的影响。对新生儿进行CAH筛查,可以在发生严重的肾上腺危象之前就对确诊的患儿治疗,有效降低死亡率,是一项值得大力推广的新生儿疾病筛查项目。在努力提高四川省的CAH筛查率同时,CAH的患儿需要终身治疗和随访,治疗和管理都有较大的难度和挑战,提高实验室检测技术水平,积累数据,总结经验,才能更好地为广大新生儿服务。