2型糖尿病肾病患者血清趋化素与胱抑素C水平的相关性*
2019-02-17徐尚福
黄 琦,廖 鑫,王 攀,徐尚福
1.遵义医科大学附属医院 核医学科(遵义 563000);2.遵义医科大学附属医院 内分泌科(遵义 563000);3.遵义医科大学 基础药理教育部重点实验室(遵义 563000)
糖尿病肾病 (diabetic kidney disease, DKD)是2型糖尿病患者常见且严重的慢性血管并发症,中国住院糖尿病患者的DKD患病率为33.6%[1]。 DKD早期诊断并经治疗后多可缓解,延缓其发展成终末期肾病。因此,早期诊断DKD对糖尿病管理显得尤为重要。目前,临床早期筛查以尿微量白蛋白(microalbuminuria, MAU)或尿蛋白/肌酐比值作为诊断2型糖尿病肾损害的指标。近年来,血清胱抑素C(CysC)在DKD中的诊断价值逐渐得到认可,目前已应用于临床生化检测[2-3]。本研究拟观察2型糖尿病不同尿蛋白排泄状态下,患者血清趋化素(chemerin)和CysC水平,探讨血清chemerin与CysC水平的相关性,为临床应用血清chemerin检测协助诊断DKD提供理论依据。
1 资料与方法
1.1 临床资料
选取2017年1月至2018年9月于遵义医科大学附属医院内分泌科住院的2型糖尿病患者共104例,其中,男53例,平均年龄(54.5 ± 8.2)岁;女51例,平均年龄(52.6 ± 9.4)岁。2型糖尿病纳入标准:参照《中国2型糖尿病防治指南》2017版,采用1999 年世界卫生组织(WHO)诊断标准[4]。排除标准:1)1型糖尿病;2)慢性肾小球肾炎;3)尿路感染;4)高血压;5)心脏病;6)肝脏疾病;7)妊娠;8)近期服用血管紧张素转换酶抑制剂和(或)血管紧张素受体拮抗剂者。根据24 h尿微量白蛋白(urinary microalbuminuria, U-mAlb)量,将2型糖尿病患者分为3组:正常蛋白尿组(24 h U-mAlb<30 mg)(n=35)、微量蛋白尿组(24 h U-mAlb:30~300 mg)(n=35)和大量蛋白尿组(24 h U-mAlb>300 mg)(n=34)。另外,随机选择年龄、性别匹配的健康者35例作为对照组。
1.2 方法
1.2.1 临床资料收集 收集入组者相关临床资料,主要包括性别、年龄、身高、体重、体重指数(BMI)、既往病史等。
1.2.2 血生化指标及24 h U-mAlb检测 受试者禁食8~10 h后清晨采静脉血,应用Olympus (AU2700) 全自动分析仪分析测定空腹血糖(FBG)、血尿素氮(BUN)、血肌酐(Cr)、CysC。高压液相法检测糖化血红蛋白(HbA1c);收集24 h尿,应用美国Beckman Coulter IMMAGE 全自动免疫分析仪测定24 h U-mAlb量。
1.2.3 血清chemerin检测 采用酶联免疫吸附测定(ELISA)法测定血清chemerin浓度,试剂盒购自美国R&D公司;选择450 nm 波长用i-mark酶标仪(美国Bio-rad公司)测量各OD值,经计算换算得出血清浓度值。
1.3 统计学方法
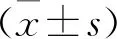
2 结果
2.1 各组间血生化指标比较
正常蛋白尿组、微量蛋白尿组、大量蛋白尿组HbA1c均高于对照组 (P<0.05);大量蛋白尿组BUN、Cr、CysC、chemerin和24 h U-mAlb均较对照组、正常蛋白尿组及微量蛋白尿组明显升高 (P<0.05);微量蛋白尿组chemerin较正常蛋白尿组及对照组明显升高 (P<0.05)(表1)。

表1 不同蛋白尿组及对照组生物标记物水平的比较
注:与对照组比较,*P< 0.05;与正常蛋白尿组比较,△P<0.05;与微量蛋白尿组比较,#P<0.05
2.2 chemerin、CysC 与其他变量的相关性
以CysC为因变量,与其他变量进行Pearson相关分析, CysC与BUN(r=0.848,P<0.05)、Cr(r=0.930,P<0.05)、chemerin(r=0.336,P<0.05)、24 h U-mAlb (r=0.390,P<0.05) 呈正相关。CysC与HbA1c无相关性 (r=-0.032,P>0.05)。以chemerin为因变量,与其他变量进行Pearson相关分析, chemerin与BUN(r=0.312,P<0.05)、Cr(r=0.359,P<0.05)、CysC (r=0.336,P<0.05)、 24 h U-mAlb (r=0.518,P<0.05) 呈正相关。chemerin与HbA1c无相关性 (r=0.244,P>0.05)。
2.3 多元线性回归分析
多元线性回归分析显示,血清chemerin水平与24 h U-mAlb独立相关(β=0.401,P=0.004)(表2)。

表2 多元线性回归分析结果
3 讨论
CysC于1979年首次被发现,1985年被提出作为肾小球滤过率标记物,它是由122个氨基酸组成的13.3 KD的非糖基化的碱性蛋白质,具有相对小的分子量和相对较高的等电位点,能够通过肾小球自由滤过,在肾小管上皮细胞被重吸收,然后分解、代谢。CysC基因及其启动子的结构分析显示,该基因是一种管家型基因,即使在炎症条件下也能稳定产生。血或尿中CysC是一种已应用与临床的评估肾功能的内源性标志物[5-8]。本研究也同样观察到在2型糖尿病肾病患者中,CysC不同程度增高,且与BUN、Cr、24 h U-mAlb呈正相关。
chemerin是Nagpal等于1997年治疗银屑病时发现的一种脂肪因子,主要在脂肪、胰腺、肝脏、肺脏、肾上腺、卵巢、肾脏等表达。研究[9-11]表明,chemerin通过募集炎性细胞、氧化应激、参与糖脂代谢及影响肾脏血流动力学等诸多效应参与DKD的发生和发展。回顾性分析4 082名受试者的研究[12]表明,血清chemerin水平与eGFR之间有呈密切的负相关,血清chemerin水平的升高与患病肾脏对chemerin的肾清除受损有关。在本研究中,同样观察到DKD患者微量蛋白尿组及大量蛋白尿组chemerin明显较对照组升高,且随着尿蛋白量增加而升高。进一步的相关分析显示,chemerin和CysC均与Cr、24 h U-mAlb密切相关;多元回归分析显示,血清chemerin水平与24 h U-mAlb独立相关。这表明chemerin水平的监测在DKD诊断中同样具有重要的临床诊断参考价值,可与CysC一样作为DKD诊断的生物学标志物。在DKD的诊断除了结合病史外,需动态联合监测U-mAlb、尿蛋白与肌酐比值、血Cr、血清CysC水平加以判断。联合诊断能更好的早期诊断DKD,从而使患者得到干预及治疗,延缓其进展至终末期肾病,减轻患者的痛苦及医疗负担。
本研究尚存在一定不足,由于受到住院时限影响,未能动态检测尿微量白蛋白及血清学指标,只是从横断面进行初步的临床观察研究。后续拟进一步扩大样本量进行动态观察。
综上所述,血清chemerin、CysC与DKD的24 h U-mAlb密切有关,两者均可作为DKD诊断的参考指标,血清chemerin可作为DKD诊断的新标志物。临床可选择联合检测血清chemerin、CysC、24 h U-mAlb和Cr,早期筛查、诊断DKD。