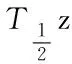给予盐酸氨基葡萄糖和硫酸氨基葡萄糖后的氨基葡萄糖药动学和生物利用度研究
2019-02-15刘卓群崔小兵
喻 斌,刘卓群,柴 川,崔小兵,阮 鸣
(1. 南京中医药大学药学院,江苏 南京 210023;2. 南京市栖霞区妇幼保健院医教科,江苏 南京 210028;3. 南京晓庄学院食品科学学院,江苏 南京 211117)
氨基葡萄糖(C6H13NO5,相对分子质量179.17)作为一种天然氨基单糖,被认为是机体合成蛋白聚糖和黏多糖的中间物,后者分布于胃肠黏膜、关节软骨基质和滑液中。美国FDA已将氨基葡萄糖归为骨关节炎患者的膳食补充剂[1]。氨基葡萄糖除了能缓解肠炎、骨关节炎外[2-3],还具有改善空间学习和记忆障碍[4]、刺激免疫、抗肿瘤、保护心脏和神经作用[5]。氨基葡萄糖可从甲壳类动物的壳聚糖和甲壳素外骨骼中提取,经过盐酸化或硫酸化后,变成稳定的可以口服的盐酸氨基葡萄糖(glucosamine hydrochloride,GH,相对分子质量215.63)和硫酸氨基葡萄糖(glucosamine sulfate,GS,相对分子质量277.25)[6-7]。虽然它们的总体药理作用相似,但也有研究发现存在一定的药效学差异[8]。而它们在药动学和生物利用度方面是否也存在差异,目前还未见报道。为了更好地指导临床用药,本课题以GS和GH中的氨基葡萄糖为研究对象,建立了灵敏度好、准确度高的 LC-MS/MS 定量分析方法,并对其在大鼠体内的药动学特征、绝对生物利用度和相对生物利用度进行了研究。
1 材料
1.1药物与试剂GH标准品(批号1206A023)、GS标准品(批号816A022)、茶碱标准品(批号310B021),均购自北京索莱宝科技有限公司;GH片剂(江苏正大清江制药有限公司,批号171009);GS胶囊(浙江海正药业股份有限公司,批号71707172);乙腈、甲酸为色谱级;其他试剂为分析纯。
1.2仪器Shimadzu LC-20AD XR型超快速液相色谱仪(UFLC),日本岛津公司,匹配SIL-20A自动进样器、DGU-20A3在线脱气机、CTO-20AC柱温箱;AB SCIEX QTRAP 5500型三重四级杆线性离子阱质谱仪,美国AB SCIEX公司;Analyst 1.5质谱工作站软件,美国AB SCIEX公司;Milli-Q纯水机,美国Millipore公司;Allegra 64R型台式高速冷冻离心机,美国贝克曼公司。
1.3实验动物清洁级SD大鼠,♂,体质量(200±20)g,购自上海杰思捷实验动物有限公司,动物合格证号:SCXK(沪)2013-0006。
2 方法
2.1溶液的配制
2.1.1标准工作液的配制 称取15.47 mg GS对照品(含氨基葡萄糖10 mg),置10 mL量瓶中,加纯水溶解,并稀释至刻度,配制成1 g·L-1的氨基葡萄糖储备液。
2.1.2内标溶液的配制 精密称取茶碱0.12 mg,用含质量分数0.1%甲酸的乙腈溶液配制成质量浓度为12 mg·L-1的储备液。再精密吸取上述储备液1 mL至50 mL量瓶,配制成质量浓度为0.24 mg·L-1的内标溶液。
2.2动物分组、给药方法和样本采集SD大鼠24只,随机分为4组,每组6只:GH灌胃组、GH注射组、GS灌胃组、GS注射组。灌胃组剂量均为125 mg·kg-1,故氨基葡萄糖实际给药量GH组为103.86 mg·kg-1,GS组为80.78 mg·kg-1。注射组采用尾静脉注射,GH和GS的剂量均为20 mg·kg-1,故氨基葡萄糖实际给药量GH组为16.62 mg·kg-1,GS组为12.92 mg·kg-1。灌胃组大鼠给予GH或GS后,于5、15、30、45、60、120、240、360、480、600 min眼眶取血0.5 mL于肝素化离心管中。静脉注射组取血时间点为给药后0、2、5、8、15、30、45、60、120、240、480 min,全血2 500 r·min-1离心10 min,取血浆用于后续处理。
2.3样本预处理取血浆150 μL,加入100 μL内标溶液,内标终浓度为96 μg·L-1。混匀,静置10 min,16 000 r·min-1离心10 min,收集上清液进样。
2.4LC-MS/MS条件色谱条件:色谱柱Hedera ODS-3(4.6 mm×250 mm,5 μm),乙腈 ∶0.1%甲酸=70 ∶30,流速0.3 mL·min-1,柱温30 ℃,进样体积3 μL。
质谱条件:采用电喷雾离子源正离子扫描模式(ESI+);多反应监测扫描模式(MRM);碰撞气压力(CAD):Medium;气帘气压力(CUR):35 PSI;电喷雾电压(IS):4 500 V;离子源温度(TEM):550 ℃;雾化器压力(GS1):50 PSI; 辅助气压力(GS2):50 PSI。 氨基葡萄糖:m/z 180.10→162.20;碰撞能量(CE):9 eV;去簇电压(DP):41 eV。茶碱(内标):m/z 181.07→124.06;CE:25 eV; DP:26 eV。
2.5数据分析所有时间点血药浓度测定值以均值表示,绘制血药浓度-时间曲线。用DAS 3.0软件进行数据处理,以非房室模型求出药代动力学参数。绝对生物利用度(F绝对)和相对生物利用度(F相对)计算公式如下[9-10]。
F绝对=(AUCig×Div)/(AUCiv×Dig)×100%,其中D为给予氨基葡萄糖的剂量,ig和iv分别为灌胃和注射给药。故本实验中FGH-absolute=(AUCig×16.62)/(AUCiv×103.86)×100%,FGS- absolute=(AUCig×12.92)/(AUCiv×80.78)×100%。
以GS为参比对照,根据Frelative=(AUCGH×DGS)/(AUCGS×DGH)×100%公式,本实验Fiv-relative=(AUCGH-iv×12.92)/(AUCGS-iv×16.62)×100%,Fig-relative=(AUCGH-ig×80.78)/(AUCGS-ig×103.86)×100%。
3 结果
3.1方法学考查
3.1.1专属性实验 取大鼠空白血浆、含有对照品的血浆及给药后血浆3种血浆样品,按“2.3”项下预处理,观察内源性成分对氨基葡萄糖和内标的影响。如Fig 1所示,氨基葡萄糖和内标的保留时间分别为1.69 min和2.43 min。血浆中的内源性物质不干扰这两种化合物的测定,表明该方法专属性良好。
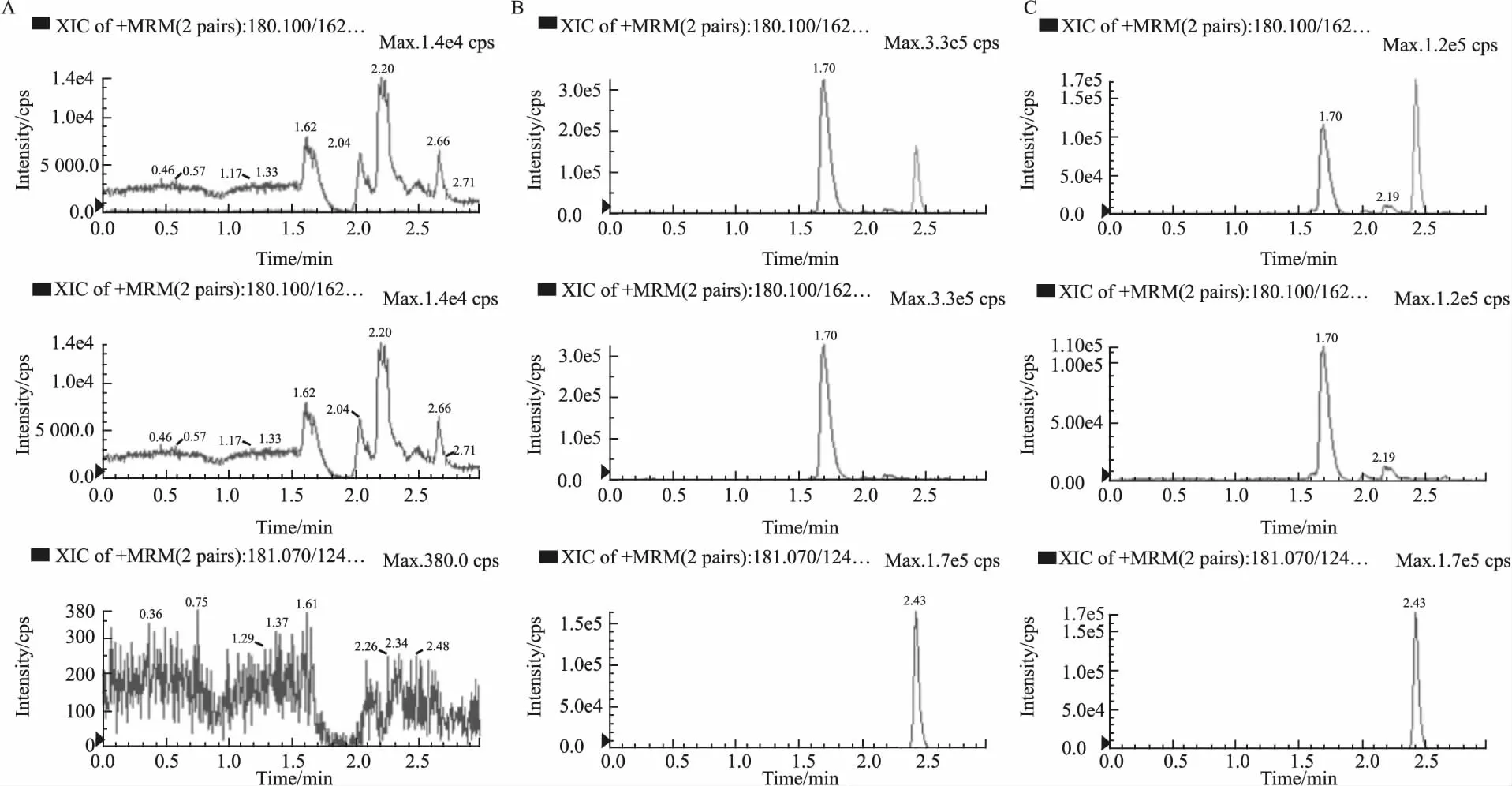
Fig 1 Representative extraction chromatograms of glucosamine in mode of MRM in rat plasma
A: Blank plasma sample; B: Blank plasma sample spiked with GH (3.125 mg·L-1) and IS (96 μg·L-1); C: Plasma sample. Glucosamine: m/z 180.10→162.20; IS: m/z 181.07→124.06.
3.1.2标准曲线的绘制 取大鼠空白血浆,加入氨基葡萄糖储备液和内标溶液,使血浆中氨基葡萄糖终浓度为50、25、12.5、3.125、1.56、0.78、0.078、0.007 8 mg·L-1,混匀,静置10 min,16 000 r·min-1离心10 min,收集上清液进样。以血浆中氨基葡萄糖的提取离子流图(XIC)峰面积和内标的峰面积之比为横坐标(x),以氨基葡萄糖浓度为纵坐标(y)绘制标准曲线,确定线性范围。另外取血浆标准品溶液逐级稀释,以信噪比S/N=3和S/N=10时的浓度,分别作为最低检测限和最低定量限。氨基葡萄糖的回归方程为Y=0.620X+0.008,r=0.999。线性范围为0.007 8~50 mg·L-1,最低定量限为0.007 8 mg·L-1,最低检测限为0.000 78 mg·L-1。
3.1.3提取回收率和基质效应 取空白大鼠血浆,加入氨基葡萄糖储备液和内标溶液,配制成氨基葡萄糖终浓度为12.5、1.56、0.078 mg·L-1的质量控制(QC)样本,每个浓度平行制备5份样本,按“2.3”项下方法处理后进样分析,得目标分析物峰面积为A。另取空白血浆,除不加标准品和内标外,其余同“2.3”项下进行除蛋白和高速离心预处理,向上清液中加入GS和内标,使氨基葡萄糖浓度为12.5、1.56、0.078 mg·L-1,进样分析,得目标分析物峰面积为B。最后,利用流动相制备终浓度为以上3种浓度的氨基葡萄糖及内标的混合溶液,进样分析,得目标分析物峰面积为C。计算提取回收率=A/B×100%,考察基质效应=B/C×100%。结果显示,氨基葡萄糖提取回收率为89.1%~91.4%,基质回收率为99.3%~100.3%。内标提取回收率为89.5%,基质回收率为89.6%。
3.1.4精密度和准确度 参照标准曲线与定量范围,利用空白血浆配制3种不同浓度的QC样本。按“2.3”项下进行样品处理,在1 d内不同时间进样,计算日内精密度(RSD)和准确度(RE)。另外,在5日内进样,计算日间RSD和RE,结果见Tab 1。
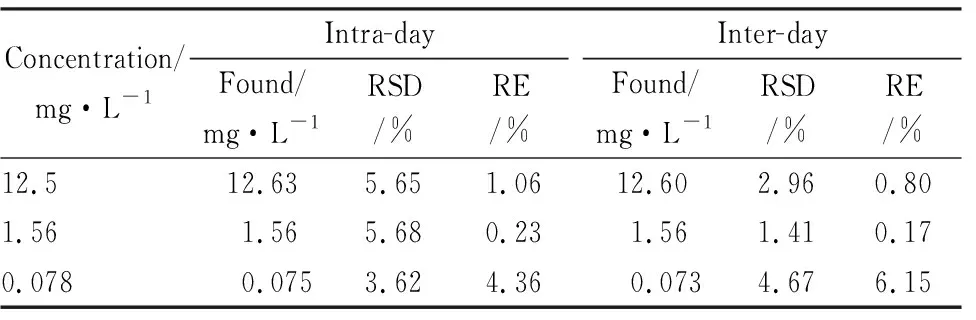
Tab 1 Intra-day and inter-day precision/ accuracy tests of glucosamine(n=5)
3.1.5稳定性考察 对3种不同浓度的QC溶液在室温(20 ℃)24 h、-20 ℃冰冻30 d,以及反复冻融3次后,观察回收率。结果见Tab 2。

Tab 2 Stability tests of glucosamine(n=5)
3.2药动学特征及生物利用度评价大鼠经口服和注射给药后,GH和GS中氨基葡萄糖的平均血药浓度-时间曲线见Fig 2。采用DAS 3.0软件,以非房室模型统计分析其药代动力学参数,结果见Tab 3。
4 讨论
在优化质谱参数的过程中,氨基葡萄糖起初选用和文献报道一样的离子碎片(m/z 180.10→72)[11],但结果发现子离子响应较差(检测限约为5 μg·L-1),而子离子采用162.20后,灵敏度明显提高,检测限达到目前的0.78 μg·L-1,且稳定性很好。本次实验采用的UFLC-MS/MS方法,质谱电喷雾电离源(ESI+)将样品离子化,多反应离子监测(MRM)准分子离子峰,具有选择性好、灵敏度高、分析时间短等优点,能够迅速、灵敏地检测氨基葡萄糖的血药浓度。
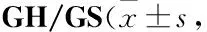
Tab 3 Pharmacokinetical parameters of glucosamine after ig/iv administration of n=6)
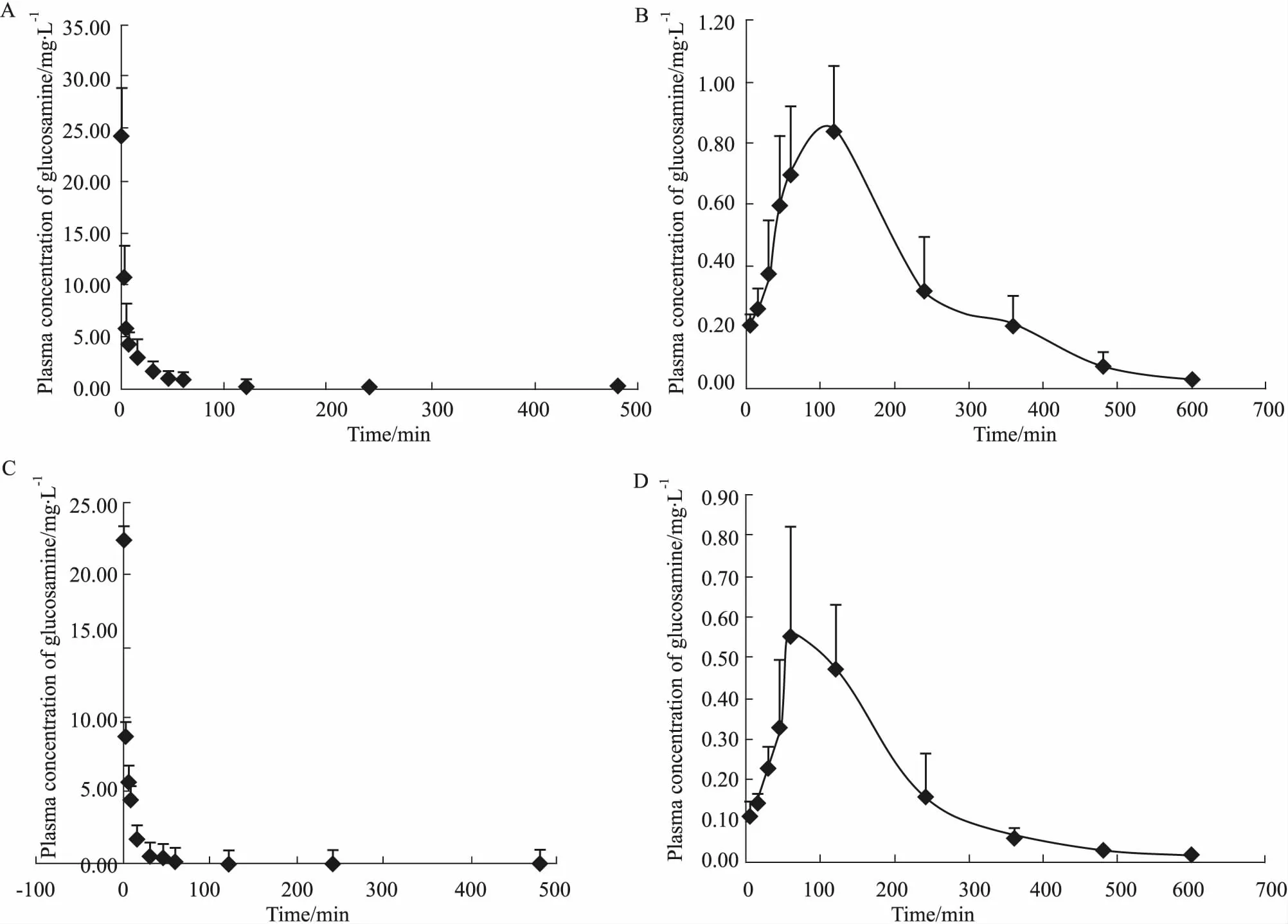
Fig 2 Mean plasma concentration-time curves of glucosamine after administration of GH or GS in n=6)
A: Group of injective GH (20 mg·kg-1); B: Group of oral GH (125 mg·kg-1); C: Group of injective GS (20 mg·kg-1); D: Group of oral GS (125 mg·kg-1).