猪尿中氟喹诺酮类药物残留的ELISA检测
2019-02-14陈浩洪体玉
陈浩 洪体玉


摘要:利用氟喹诺酮类残留酶联免疫检测试剂盒,测定猪尿中氟喹诺酮类药物的残留量。研究了猪尿样品本底颜色,蛋白含量以及样品离心对测定结果的影响,获得猪尿样品中氟喹诺酮类药物残留检测的前处理方法,并通过加标回收实验及猪尿样品特异性实验对实验方法进行了确定。
关键词:氟喹诺酮类药物;残留;酶联免疫;猪尿
氟喹诺酮类(Fluoroquinolones,FQNS)药物是近二十年来快速发展起来的一类高效抗菌药。具有抗菌谱广,高药效,低毒性,穿透组织能力强等优点,能有效抑制细菌DNA螺旋酶的合成[1],因此近年来在兽医临床诊疗和水产养殖中作为一种不可多得的高效抗感染类药物得到广泛应用。在大量用于预防、治疗和促进个体生长的同时,这类药物的残留问题也引起了国内外有关方面的高度关注,其残留的危害性除了对人类的直接毒副作用和潜在致癌作用外主要报道为该类药物容易诱导人类致病菌产生耐药性,从而不利于该类药物对人类相关疾病的治疗作用[2]。在美国目前FQNS在食品动物中是禁止使用的,为保障食品安全,我国FQNS残留也已经列为动物性食品的一个重点风险监测项目,并制定了严格的相关限量标准。广西检验检疫局按照国家质检总局的部署,针对供港澳活猪的兽药残留监管做了大量卓有成效的工作,制定了详细的工作方案,并将供港猪猪尿兽药残留作为日常监测的主要内容,其中FQNS是主要监测项目之一。
目前,FQNS残留主要的检测方法有:微生物法、液相色谱法(LC)、高效液相色谱法(HPLC)、薄层色谱法、液相色谱-质谱联用法(LC-MS)、免疫分析法、高效毛细管电泳法(HPCE)等[3-5]。这些方法虽各有优点,但也存在样品前处理比较复杂,操作过程繁琐,时间长,所需仪器要求高等不足,对于畜牧部门的大批量检测并不适用,而间接竞争ELISA方法具有较高的灵敏度,较强的特异性,样品测定前处理简单,操作过程只需50分钟,简单快速,能最大程度减少工作量,适合大批量样品的筛选,尤其便于基层实验室推广应用。目前市场上销售的氟喹诺酮类ELISA试剂盒主要针对组织样本如鸡肉、猪肉、鱼、虾等和牛奶、奶粉、鸡蛋等,没有明确标示猪尿中氟喹诺酮类残留的检测。因此我们通过实验对猪尿样品前处理的影响因素进行了分析,得到了猪尿中氟喹诺酮类残留的检测方法。
1 材料和方法
1.1 材料与仪器
1.1.1 材料
猪尿(采自辖区内养殖场);氟喹诺酮类残留酶联免疫检测试剂盒(北京勤邦生物技术有限公司);氟喹诺酮类药物、氯霉素、磺胺二甲基嘧啶、β兴奋剂、红霉素、林可霉素、沙丁胺醇、克伦特罗、莱克多巴胺标准品(RANDOX.公司);其余试剂均采用国产分析纯(AR)试剂。
1.1.2 实验仪器
Thermo Multiskan MK3 全自动酶标仪,美国;贝克曼Microfuge 22R台式微量冷冻离心机,美国;VORTEX-GENIE2 漩涡混合器,美国;dragonlab移液器(10—100μL);Finnpipette精密8道可调移液器(30—300μL);日本三洋MIR-254低温恒温箱。
1.2 实验方法:将所需试剂回温至室温(20—25℃),取出所需数量的微孔板,将样本和标准品对应微孔按序編号,每个样本和标准品做2孔平行。加样:加入标准品和样本50μL/孔到对应的微孔中。随即加抗体工作液和酶标二抗浓缩液的混合液50μL/孔到所有微孔中(将抗体工作液和酶标二抗浓缩液按10:1体积比混合,此混合液不能保存,混匀后立刻进行加样),用盖板膜盖板后置25℃避光环境反应30min。洗板:将孔内液体甩干,加入洗涤工作液250μL/孔,充分洗涤4—5次,每次间隔10s,将板孔拍干。显色:加入底物A液50μL/孔,再加入底物B液50μL/孔,混匀,用盖板膜盖板后置25℃避光环境中反应15min。测定:加入终止液50μL/孔,混匀,于双波长450/630nm处测定每孔OD值。标准曲线的绘制与计算:以标准品百分吸光率为纵坐标,以氟喹诺酮类药物标准品浓度的对数为横坐标,绘制标准曲线图。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的浓度,乘以对应的稀释倍数即为样本中氟喹诺酮类药物的实际浓度。
1.2.1 猪尿样品本底颜色对测定结果的影响
取猪尿样品两份,一份直接测定,另一份样品以相同体积纯水代替显色液底物液B液,其余按照相同步骤进行测定。
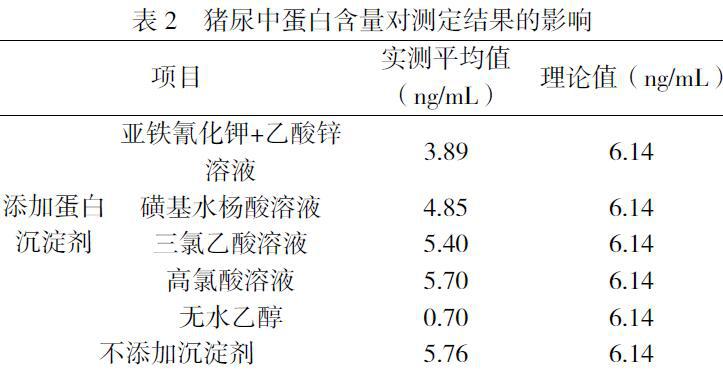
1.2.2、猪尿中蛋白含量对测定结果的影响
取5份尿液,其中4份分别加入亚铁氰化钾(106g/L)+乙酸锌溶液(220g/L)、磺基水杨酸(4%)溶液、三氯乙酸(5%)溶液、高氯酸溶液(5%)、无水乙醇沉淀样品中的蛋白,混匀后静置10min,离心,取上清液进行测定,另一份样品加入同体积纯水代替蛋白沉淀剂同时进行测定。每份尿液做四个平行,结果取平均值。
1.2.3、猪尿样品离心对测定结果的影响
取猪尿样品两份,一份样品不进行离心,另一份离心,其余按照相同步骤进行测定。
1.2.4、加标回收实验
取4份已知FQNS残留含量的猪尿样品,分别加入1ng/mL、2ng/mL、3ng/mL、4ng/mL氟喹诺酮类药物标准品,按照相同步骤进行测定。
1.2.5、猪尿样品氟喹诺酮类残留特异性实验
取8份猪尿样品,分别加入氯霉素、磺胺二甲基嘧啶、β兴奋剂、红霉素、林可霉素、沙丁胺醇、克伦特罗、莱克多巴胺标准品,按照相同步骤进行测定。
2 实验结果
2.1.1猪尿样品本底颜色对测定结果的影响
通过在实验过程中以相同体积纯水代替显色液底物液B液,研究猪尿样品本底颜色对测定结果的影响(如表1所示),结果表明猪尿本底颜色对检测结果影响甚微。
2.1.2猪尿中蛋白含量对测定结果的影响
通过在猪尿前处理环节中添加不同的蛋白沉淀剂,研究猪尿样品中蛋白对测定结果的影响(如表2所示),结果表明加入蛋白沉淀剂均会不同程度影响样品含量,其中加入无水乙醇对结果影响较大,加入沉淀剂高氯酸溶液、三氯乙酸溶液对结果影响较小。
2.1.3猪尿样品离心对测定结果的影响
通过在猪尿前处理环节中对样品进行离心预处理,研究猪尿样品离心对测定结果的影响(如表3所示),结果表明,作离心处理样品结果比不作离心处理精密度更好。
2.1.4加标回收实验
在已知猪尿中FQNS残留含量的样品中加入不同浓度FQNS标准品,进行加标回收实验,计算检测回收率,结果如表4所示。
2.1.5 FQNS残留在猪尿样品中的特异性实验
通过在已知FQNS残留含量(1.6ng/mL)的猪尿样品中加入一定浓度的氯霉素、磺胺二甲基嘧啶、β兴奋剂、红霉素、林可霉素、沙丁胺醇、克伦特罗、莱克多巴胺标准品,研究FQNS残留在猪尿样品中的特异性,结果如表5所示。
3 讨论
3.1猪尿样品本底颜色对测定的影响
在检验检疫日常的监测中发现,采集自不同猪场的不同猪尿样品其颜色深浅不一,大体是黄色至棕黄色,实验结果显示不添加显色剂的猪尿样品尽管其本底颜色较深,经测定扣除样品本底颜色结果和不扣除样品本底颜色结果基本一致,可见样品本底颜色对实验结果的影响较小,在样品前处理的过程中无需采取除色处理等步骤,减少了实验时间和步骤。
3.2蛋白质沉淀常用的方法有盐析、等电点沉淀、有机溶剂沉淀、生物碱试剂与某些酸(如三氯醋酸)沉淀,重金属盐沉淀等。猪尿是一种生理体液,含有氨基酸及蛋白质等物质,我们通过添加亚铁氰化钾+乙酸锌溶液、磺基水杨酸溶液、三氯乙酸溶液、高氯酸溶液、无水乙醇处理猪尿中的蛋白质,通过空白对照,我们发现,样品前处理中加入蛋白沉淀剂均会不同程度影响样品含量,其中加入无水乙醇对结果影响较大,可能与FQNS在无水乙醇的溶解性有关,而加入高氯酸溶液、三氯乙酸溶液影响较小。
3.3猪尿样品离心对测定的影响
实验所添加猪尿样品无肉眼可见悬浮物、沉淀物,结果表明作离心处理猪尿与不经过离心处理尿液结果相比,结果基本一致,作离心处理猪尿样品结果精密度稍高。一般猪尿样品久置后经微生物分解猪尿释放含氮或含硫等有机成分气体物质,如氨气、硫化氢、硫醇、粪臭素等,在相互作用下产生尿酸盐等沉积,形成悬浮物和沉淀,这将会影响我们取样的准确,因此我们建议如果发现尿液有悬浮物及沉淀,在检测之前应进行离心处理,确保数据的准确。
3.4加标回收实验
通过在已知猪尿FQNS残留含量的样品中加入FQNS标准品,发现在加标量1—4ng/mL时,回收率随添加浓度增加而升高,其回收率在73%—125%之间,平均回收率达到104%,操作中宜使样品浓度范围在2—3ng/mL之间,结果较为准确。
3.5通过在已知FQNS残留含量的猪尿样品中加入一定浓度的氯霉素、磺胺二甲基嘧啶、β兴奋剂、红霉素、林可霉素、克伦特罗、莱克多巴胺标准品,研究FQNS残留在猪尿样品中的特异性,结果发现氯霉素、磺胺二甲基嘧啶、β兴奋剂、红霉素、林可霉素、克伦特罗、莱克多巴胺等标准品基本不反应,特异性满足实验要求。而沙丁胺醇存在一定交叉反应,这也体现了试剂盒的局限性,故FQNS残留确证还需配合HPLC等方法。
4 小结
开展供港活猪等农产品的兽药残留安全风险监控工作,不仅是产品安全风险管理的重要基础和质量把关的主要手段,更是一项重大的政治任务,是关系到国家稳定,人民健康以及经济社会发展的大问题。因此,掌握研究供港活猪兽药残留的现状,不仅对发展壮大辖区供港澳活猪养殖企业意义重大,而且能为检验检疫部门的进出口检疫与常规监管提供可靠参考。
动物服用药物以后其原形药物和代谢物主要以尿液的形式排泄。可通过检测猪尿中氟喹诺酮类药物残留掌握该类药物在猪个体和养殖场的使用情况[6]。我们通过研究猪尿样品本底颜色,蛋白含量以及样品离心对测定结果的影响,获得猪尿样品中氟喹诺酮类药物残留检测的前处理方法为:猪尿本底颜色对结果影响较小,如果发现尿液有悬浮物及沉淀,建议在检测之前应进行离心处理,确保数据的准确。并通过加标回收实验及猪尿样品特异性试验对实验方法进行了确定。
参考文献
[1]蒋兴东,祁克宗,涂健,等.动物性食品中氟喹诺酮兽药残留分析方法的研究进展[J].上海畜牧兽医通讯.2008,(1):10-12.
[2]穆国东,谭建华.动物性食品中氟喹诺酮类兽药残留检测技术研究进展[J].动物医学进展.2007,28(1):68-72.
[3]汪雪雁,祁克宗,朱良强.氟喹诺酮类药物残留分析研究进展[J].安徽农业科学.2004,32(5):1021-1023.
[4]钟映梅,张秀英,张峻峰.动物性食品中氟喹诺酮类药物的残留分析[J].中国兽药杂志.2004,38(8):29-32.
[5]李新朋,姜金庆,钱爱东,等.动物性食品中氟喹诺酮类药物多残留检测研究进展[J].动物医学进展.2013,34(9):99-103.
[6]张鑫,吴剑平,顾欣,等.ELISA试剂盒用于检测猪尿中赛庚啶残留的考察[J].中國兽药杂志.2013,47(4):35-37.
作者简介:陈浩(1988.4-),男,汉族,广西南宁人,本科,助理工程师,主要从事微生物及理化检测。
洪体玉(1983),男,汉族,广西南宁人,研究生,工程师,主要从事微生物及理化检测。
