女运动员三联征研究进展与共识
2019-02-12付德荣李豪杰廖八根
付德荣 李豪杰 廖八根
1广东体育职业技术学院(广东广州 510630)
2吉林体育学院(吉林长春 130022)
3广州体育学院(广东广州 510630)
女运动员三联征(female athlete triad,FAT)是指女运动员的能量利用、骨骼健康和月经失调之间相互关联、相互影响的一种医学症候群。1992年美国运动医学会(American College of Sports Medicine,ACSM)首次提出,经典术语包括“饮食失调、闭经和骨质疏松”[1-3]。随时间推移,FAT的定义在发生改变。2007年ACSM用“伴有或不伴有饮食失调的低能量利用”替代了“饮食失调”。2014年国际FAT联盟(Female Athlete Triad Coalition,FATC)申明,FAT是在女性运动人群中常观察到涉及下列三个征象中任何一个的医学问题:伴有或不伴有饮食失调(disordered eating,DE)的低能量利用(low energy availability,LEA)、月经失调(menstrual dysfunction,MD)、低骨密度(bone mineral density,BMD)[1]。目前FAT诊断的最大误区在于错误地理解运动员FAT必须同时具有三个征象[4],但普遍现象是早期阶段只有1 或 2 个征象[1,2,4,5],且男性运动员中有类似表现[1,2,6-10]。因此,早期识别和干预是防止 FAT进展的关键[1-4]。本文从FAT的发生、风险筛查与评估、预防和治疗等方面进行阐述,为FAT的防治提供参考。
1 FAT三个征象的相互关系
LEA[EA=(能量摄入-能量支出)/瘦体重(fat-free mass,FFM)]是FAT的核心问题。LEA是MD的始发因素,后者引起的代谢和内分泌紊乱干扰骨健康[1-5]。虽被称为三联征,但并非三个征象均同时出现,只要有FAT的任何一个征象,运动员即处于长期严重危险中[1,2,4]。LEA、MD和低BMD三个征象相互联系、相互演变,在健康与疾病状态之间有一个频谱变化过程(图1)[1,3]。LEA首先扰乱下丘脑的促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)的脉冲频率,随之引起垂体黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicle-stimulating hormone,FSH)释放异常,继而导致卵巢分泌雌激素与孕激素异常,这种级联效应最终表现为MD[1-4,11]。LEA和MD状态下,骨沉积减少,骨吸收增加,骨矿物质流失增多。如果FAT出现在青少年时期,还将严重影响峰值骨量的形成,而这种影响是不可逆的,其后果便是骨质疏松和应力性骨折的增加[1-6,9,12]。
低能量利用直接影响月经,继而能量利用和月经状态直接影响骨健康。最佳健康状态是最佳能量利用、正常月经和最佳骨健康,反之,最差情况是伴或不伴进食障碍(eating disorder,ED)的低能量利用、功能性下丘脑闭经(functional hypothalamic amenorrhoea,FHA)和骨质疏松。运动员健康在两端之间波动的状态,取决于其饮食和运动行为[1]。
为了更准确地描述FAT的临床症状,2014年国际奥委会引入一个更全面更广泛的术语即运动的相对能量不足(relative energy deficiency in sport,RED-S)来说明能量利用的负平衡,用RED-S综合征来代替FAT。RED-S导致的功能受损包括但不限于代谢率、月经功能、骨骼健康、免疫、蛋白质合成和心血管健康等方面[6]。男性运动员RED-S导致的LEA、低性腺激素和低BMD现象同样十分常见[6-10,13,14],尤其是强调瘦体重为主的项目以及体重级别或耐力性项目,这种状态被描述为“男性运动性腺功能减退”(exercise-hypogonadal male condition,EHMC)或男运动员三联征(male athlete triad,MAT)[13,14],但其临床表现没有女性运动员明显而常被忽视[6-9]。RED-S综合征不仅扩大了定义范围,且将两性均包括在内[6-9],这对所有运动员或从事运动的人群均有极大帮助作用。
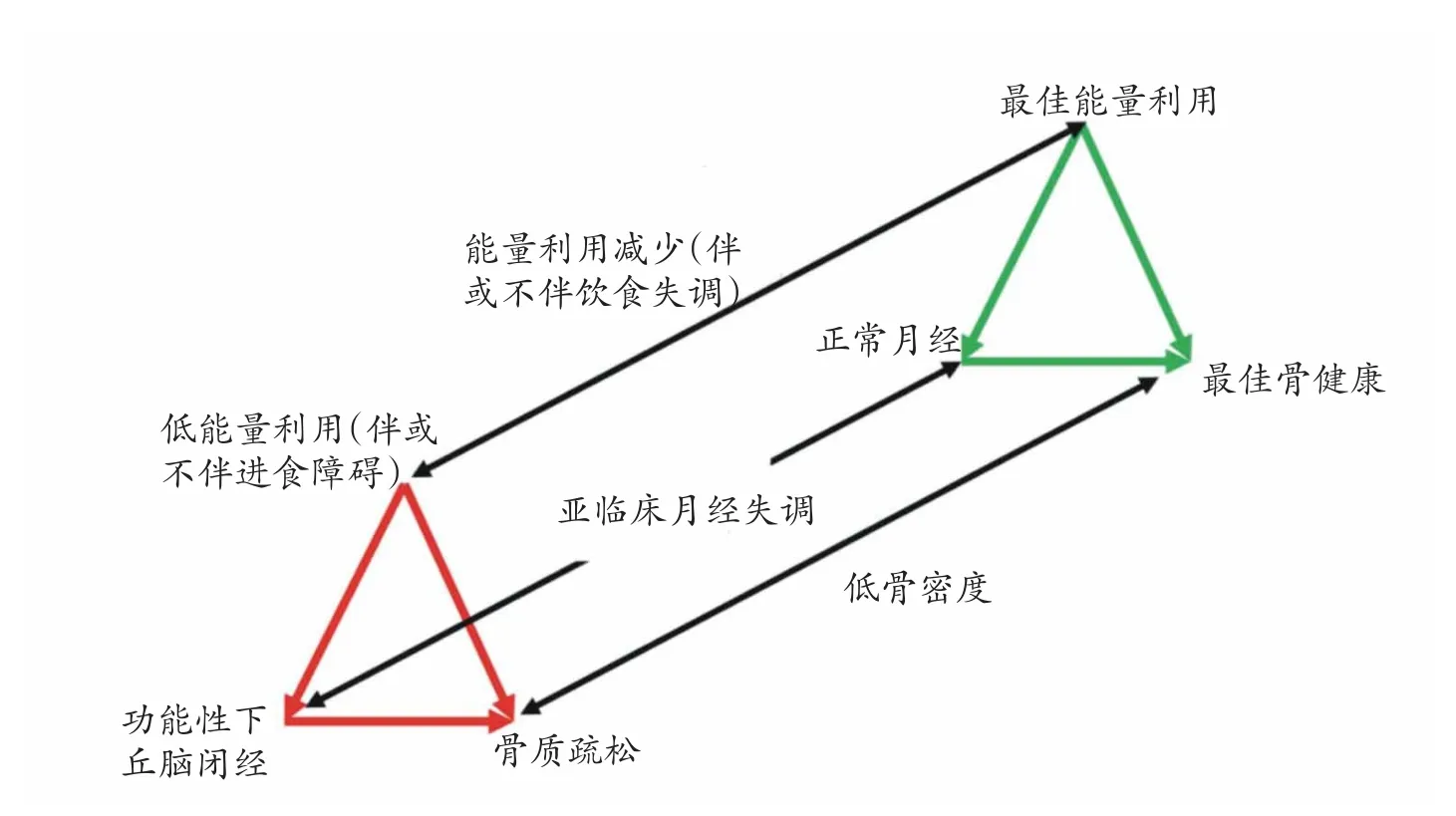
图1 女运动员FAT 能量利用、月经状态和骨健康三因素相互关联[1]
1.1 低能量利用
能量利用(energy availability,EA)是指维持人体正常生理功能的能量利用,如心血管功能、组织愈合、生长发育、生殖功能等[3,15]。EA指数与生殖功能、代谢激素浓度和骨形成与吸收标志物明显相关[1,6,8,9,11,12]。个体EA状态可从最佳EA到LEA之间发生变化(图1)。LEA 被定义为每天不超过 30 kcal/kg FFM[1,6,8,9]。LEA情况下,机体将牺牲对细胞修复、热调节、生殖健康、骨骼以及生长发育的能量供应,以恢复能量平衡和促进生存[3]。低于30 kal/kg FFM,月经失调和骨健康问题开始显著增加[1,3,9,16]。健康成人每天 45 kcal/kg FFM相当于能量平衡,对于从事体育活动的女性,建议每天至少45 kcal/kg FFM的能量摄入以确保身体所有生理功能[1-6,8,10,16]。
LEA可发生于有或没有DE的情况下。非故意LEA常源于运动员缺乏饮食知识,不知日需多少能量能满足生理功能和训练需求,或没意识到随运动水平提高和运动负荷上升而需相应增加能量摄入。主观所为LEA常由故意大幅降低热量摄入、过度运动消耗、或二者联合所致[3,15]。故意热量限制常表现为临床 ED[1,3],包括限制饮食摄入、取消特定食物群、禁食、少餐、或使用减肥药、泻药、利尿剂,或暴饮暴食[1,3]。近年精神障碍诊断与统计手册(diagnostic and statistical manual of mental disorders V,DSM-V)确定ED的亚类包括神经性厌食症(anorexia nervosa,AN)、神经性贪食症(bulimia nervosa,BN)和非特异性进食障碍(eating disorder not otherwise specified,ED-NOS)[3,15,17]。AN 是指体重低于预期体重的85%(相对于身高和年龄而推算的体重),以及对体重增加的极度恐惧,身体变形和闭经[15,17]。在AN人群中,其死亡率增加了6倍,其中20%死于自杀,能完全康复者不足一半,20%患者仍长期受困于AN的影响[3]。BN包括反复暴饮暴食(至少每周两次,持续三个月),并伴有反复不适当的代偿行为(即自我诱发呕吐、使用泻药、禁食和过度运动),以防止体重增加。BN常发生在正常体重范围内,其自我评价常受体形和体重的严重影响[3,15,17]。ED-NOS 是最常见的亚类,个体表现ED的某些行为特征(表1),但不符合AN或BN的标准[15,17]。ED都有严重的临床精神疾患,对健康有诸多潜在不良影响,包括多系统器官损害甚至死亡。这些患者常与其它精神疾病有关,包括抑郁、焦虑和药物滥用[1,3,15,17]。

表1 进食障碍者常见症状与体征
LEA的其它风险因素还包括运动时间延长、素食、早期专项训练、参加以瘦体重为主的项目、突然增加训练强度和受伤等。心理的应激和/或抑郁亦可导致LEA和 ED,反之亦然[1,3,6,15]。研究显示,青春期是形成不健康饮食态度与行为的关键时期[18]。当青少年的身体指数(body mass index,BMI)低于17.5 kg/m2或低于预期的85%体重时,LEA已非常明显。当LEA的症状缺乏时,确定EA是比较复杂的,但可通过计算能量来判断[1]。长期LEA可致营养缺乏、慢性疲劳、感染和疾病风险增加,并发症涉及心血管、胃肠道、内分泌、生殖、骨骼、肾脏和中枢神经系统,对健康和运动表现均造成严重损害[1,6,15]。
1.2 月经失调
与EA相似,MD沿正常月经到闭经的频谱发生(图1)[1,15]。MD包括原发性闭经、继发性闭经、月经稀发、无排卵月经、黄体功能失调等。正常月经是指在21至35天间隔内发生的有规律的月经周期。在青少年中,月经周期从21天到45天不等。原发性闭经是指15岁时仍无月经初潮。继发性闭经指月经初潮后连续三个周期无月经来潮。月经稀发为月经周期大于35天。黄体功能不全通常是黄体期持续时间低于11天或黄体期孕激素水平较低。黄体功能不全和无排卵月经常无临床症状,但仍对运动员的生殖功能和骨密度有不利影响[3]。
确定MD的发生率比较困难,尤其是青少年人群。由于初潮后一段时间内月经不规律的情况十分常见,90%女性于2年内会逐渐正常,因此,诊断MD时要排除月经初潮最初2年内月经不规律者[15]。研究显示,MD发生率从12%到79%不等,尤以瘦体重为主的运动项目如体操、跳水等,MD的发生率显著高于其它人群[3,15,19,20]。MD通常是女性运动员能量危机的首要线索之一。恢复正常月经可能在EA改善后仍需一年以上的时间[2]。
1.3 低骨密度
骨密度频谱发生在最佳骨健康到骨质疏松之间(图1)[1,15]。ACSM将低骨密度定义为Z评分-1.0至-2.0间,骨质疏松为Z评分≤-2.0,二者均会增加骨折风险[1-3]。参加负重运动的健康年轻女运动员的骨密度通常比同龄运动员高5%至15%[3]。LEA状态下,骨形成减少,骨吸收增加,骨质量受到明显影响。MD如不进行治疗,将以每年2%~3%的速度丢失骨量。对AN研究发现,当体重增加和月经恢复后,骨量增加1%~10%,而没有恢复月经者,骨量持续减少。当出现FAT的一个征象时,应力性骨折发生率为15%~21%,出现2个征象时,骨折发生率为21%~30%,而三个征象同时出现时,应力骨折达29%~50%[21]。
2 FAT的风险筛查
早期发现FAT的风险因素是FAT防治的关键,建议每年对女运动员进行筛查。此外,当女性出现疲劳、运动表现下降、反复受伤等相关问题时就应筛查,常使用国际FATC的筛查问卷(表2)[1,15]。

表2 FAT筛查问卷
3 FAT的评估
准确识别FAT取决于经验丰富的多学科健康管理团队(包括医生、运动营养师、心理健康专家、运动生理学家、体能训练师等)对运动员的完整评估。已有FAT症状和体征的运动员,应做实验室、心电图和影像学的检查[1-4,15]。
3.1 实验室检查
运动员存在月经失调、饮食障碍或FAT的其它危险因素,应接受实验室检测(表3),以评估潜在的病因及并发症问题[1-4]。

表3 实验室测试
3.2 心电图检查
推荐FAT运动员做心电图检查,因为代谢失调可增加运动员室性心律失常的风险[2]。
3.3 影像学检查
双能X射线(dual-energy x-ray absorptiometry,DXA)是测量骨密度的金标准。2014年国际FATC一致认为,以下三类运动员人群需进行DXA扫描:高风险人群、中风险人群和有骨折史的人群(表4)[1,2,15]。

表4 需要进行DXA检查骨密度的人群[1]
4 FAT的非药物治疗
LEA是导致FAT的关键,增加EA和恢复能量正平衡,使体重恢复或正常化,是成功恢复月经和改善骨健康的最佳策略。运动员能否积极主动参与治疗是恢复充足EA的一个挑战。任何治疗方案的进展,都应考虑运动员的目标、饮食特点、训练方法以及其它可能影响的条件。当DE明显时,修正与饮食和体型相关的不健康的态度、行为和情绪是重点,这些因素可导致DE长期存在[1-5,9]。
4.1 LEA的非药物治疗建议
具体治疗建议取决于运动员LEA发展的程度。针对导致LEA发生的四条途径,FATC给出了针对性的建议[1]:
(1)如果引起LEA的原因是无意识导致的膳食不足,对其进行营养教育即可。理想的营养教育中应有一名运动营养师。运动生理学家也可完成对能量支出和EA的评估。
(2)如果LEA是DE导致的,应将其转介给医生,并与运动营养专家一起商讨膳食营养问题。
(3)如果LEA是故意减体重导致的,无DE,进行营养教育即可。
(4)如果LEA的原因涉及临床上的ED,治疗应包括医师的评估与管理,运动营养师的营养咨询、心理治疗师的心理治疗。这种情况,如没有心理治疗,逆转LEA是不可能的。
LEA非药物治疗的目标各不相同,视具体情况而定。特定目标可包括以下一个或多个[1]:
(1)恢复近期丢失的体重。
(2)恢复到与正常月经相关的体重。
(3)体重的恢复应达到BMI≥18.5 kg/m2,或≥90%的预期体重。
(4)能量摄取每日至少2000kcal,或者依据运动的支出,摄取更多的能量。
能量摄取的增加应逐渐递增,开始时可在能量需求的基线水平上增加20%~30%,或能量摄取的增加能满足每7~10天体重增加0.5 kg的需要。如一个每天消耗2000 kcal的运动员,需每天增加200~600 kcal,共要几个月的时间来达到目标[1]。
4.2 低骨密度的非药物治疗建议
导致能量缺乏的相关因素及雌激素低落是妇女骨量丢失的主要原因[22]。体重增加和随后的月经恢复是防治骨量进一步流失的关键[1-3]。负重运动是增加和维持BMD及其几何形状的一种主要的非药物策略。骨组织对动态的高强度、高冲击负荷和阻力训练有较大反应。研究显示,结合高冲击负荷和阻力训练,是优化绝经前女性骨健康的一个有效方法。瘦体重的百分比变化与BMD明显正相关,故增加瘦体重是体重恢复的重要部分,这不仅改善BMD,还增加骨的大小,改善骨的力量,降低骨折的风险,提升运动表现[1,2]。但需注意高冲击性的运动对低BMD女性有导致骨折风险的可能[1,2],因此,运动方式和强度的制定要综合分析,权衡利弊,并做好防护措施。
4.3 心理治疗
对有严重DE或者ED者及不能遵从治疗建议的运动员,应进行心理治疗[1,9,22,23]。已证明个体化治疗、认知行为治疗和家庭疗法有利于FAT的恢复,家庭疗法特别适合年轻运动员。忍受急性神经性厌食症的运动员常伴有抑郁、固执、对体重的恐惧以及对相关食物和饮食的偏见,这使治疗变得困难,为确保他们遵从治疗指导,让运动员签一份书面合同是必要的。合同要明确治疗的目的,同时规定运动员参加治疗期间的责任[23]。
4.4 运动方案的调整
力量训练对骨健康有良好效应。美国物理治疗协会建议用抗阻训练代替心肺耐力训练,以减少能量消耗,提高BMD。推荐以80%1RM的强度,重复8~12次,运动3组,组间间隔1~2分钟,每周3次,逐渐递增训练强度[1,15,22]。
增强式训练的特点是高强度、爆发性肌肉收缩,是可替代常规运动来改善骨健康的另一种运动形式,包括已被证明可改善女性髋和脊柱健康的各种跳跃性运动。但跳跃性运动对非承重骨没有作用,故上肢增强式训练可采用投掷等方式。增强式训练结合抗阻练习可最大程度地提高骨健康效益,但应力性骨折恢复过程中应避免增强式训练[15]。
5 FAT的药物治疗
没有任何药物对FAT的治疗能持续有效。FATC建议,非药物治疗至少一年以上而缺乏反应者或在非药物治疗期间出现新的骨折,可考虑药物治疗[1,2]。
5.1 月经周期的激素替代治疗
激素替代治疗的目的是恢复规律月经周期,但其不能使损害骨健康的代谢因素正常化,故口服雌孕激素联合治疗对低体重闭经运动员BMD的逆转没有效果,且其造成月经恢复的假象可使潜在的低能量状态持续损害骨健康。但年龄超过16岁的原发性或继发性闭经运动员,其能量摄入充足,仍有BMD下降,可考虑使用[1,2]。
5.2 低BMD的药物治疗
当运动员有以下情况时可考虑药物治疗[1]:
①BMD的Z-评分≤-2.0,伴临床明显的骨折史,并且对至少一年的非药物治疗缺乏反应。
②BMD的Z-评分-1.0~-2.0,伴临床明显的骨折史,和≥2个FAT的其它风险因素,并且对至少一年的非药物治疗缺乏反应。
③在≥16岁和<21岁的功能性下丘脑闭经年轻运动员中,如BMD的Z-评分≤-2.0,没有临床明显的骨折,有至少一个FAT的其它风险因素,并且对至少一年的非药物治疗缺乏反应,可考虑雌孕激素周期疗法,以防在最佳骨量形成的窗口期进一步丢失骨量。
对临床缺乏反应被定义为:至少一年的非药物治疗后,临床出现明显BMD的Z-评分减少;或者在一年以上非药物治疗过程中出现了临床上明显的新骨折。
应鼓励和优化富含钙的食物和维生素D的摄入,ACSM推荐最佳钙摄入量为每天1000~1300 mg。维生素D的摄入每日至少600 IU。如果维生素D缺乏或不足,则可能需要更高剂量的维生素D,建议人体内维生素D维持在32~50 ng/ml的水平[1]。
6 返场训练和比赛的建议
基于FAT风险因子与运动员低BMD和/或应力性骨折的不良结局密切正相关,且严重影响运动员返场训练或比赛(return-to-play,RTP)的时间,国际FATC采用风险分层的方法对FAT风险因子进行高中低严重程度的风险评估和管理(表5),并要求FAT运动员返场前需通过FAT风险分层的返场运动指导和医疗许可(表6)的评估,以确认能否返场训练或比赛,以保证降低FAT运动员伤病的发生,并优化其健康[1]。
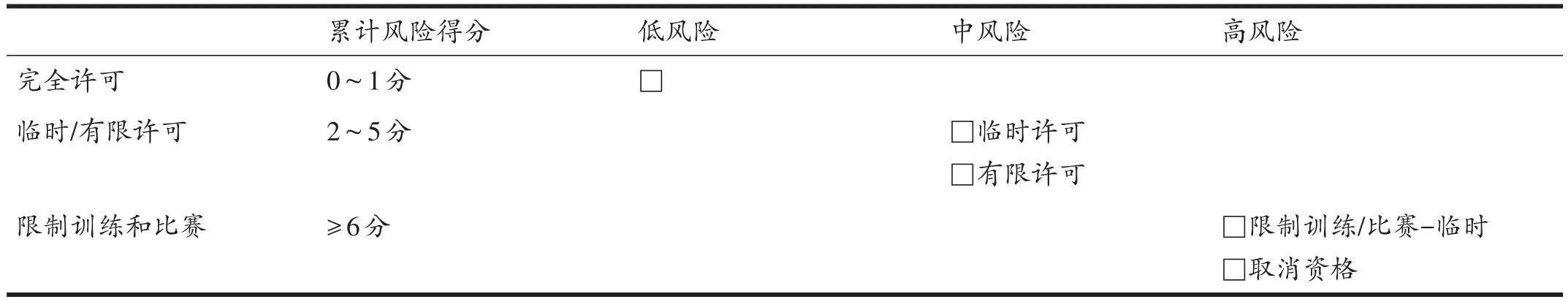
表6 FAT风险分层的返场运动指导和医疗许可[1]
7 小结
FAT是涉及能量利用、月经功能和骨健康之间相互关联、相互影响的一组医学症候群,伴有或不伴有DE的LEA是FAT发生的首要因素。FAT造成机体多系统的功能损害,早期认识和预防是防止FAT进展的关键。FATC建议对女运动员需每年进行FAT的风险筛查,准确评估FAT需要多学科团队的联合,并根据情况进行实验室、影像学检查,以判断运动员的身体机能状态。治疗的重点是增加EA和恢复能量正平衡,使体重正常化。当对非药物治疗一年以上无反应或期间出现新的骨折时,可考虑药物治疗。如若返场训练或比赛,需进行风险分层评估,并按照风险分层的返场指导和许可执行。
