不同负荷运动训练对慢性心力衰竭大鼠心功能及自噬相关蛋白表达的影响
2019-02-12潘月顺仇琪
潘月顺 仇琪
1天津商业大学体卫部(天津300134)
2首都医科大学附属北京安贞医院临床药理中心(北京 100029)
慢性心力衰竭(chronic heart failure,CHF)是心肌病和冠心病等多种心血管疾病的终末阶段。患者运动能力显著下降是CHF的重要临床表现。随着心血管康复运动的不断发展,越来越多的临床研究表明,运动康复能够显著改善轻、中度心功能不全患者[左心室射血分数(left ventricular ejection fraction,LVEF)>30%]症状[1],但其具体机制尚未明确。有研究认为,自噬参与了心力衰竭的发生和发展过程[2]。也有研究发现,适当强度的运动训练对自噬的激活有助于运动能力的提高[3]。自噬在心力衰竭患者运动康复过程中似乎起到了双刃剑的作用。因此,研究不同运动负荷下,心力衰竭模型动物心功能的改善幅度和自噬相关细胞因子的表达变化情况,对于心力衰竭患者运动强度的选择和相关机制探讨均具有重要的临床价值。本研究以左冠状动脉前降支(left anteriordescending coronary artery,LAD)结扎法复制大鼠CHF模型,观察运动疗法对模型动物心功能的影响,并从细胞自噬角度探讨其机制,为CHF运动疗法的负荷选择提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物
清洁级健康雄性SD大鼠40只,体重220±10 g,购于北京维通利华实验技术有限公司,许可证编号:SCXK(京)2012-0001。饲养地点北京中医药大学科研实验中心,饲养温度23℃ ±2℃,环境相对湿度40%±5%,通风良好,12 h昼夜交替,常规饲料饲养,自由饮水。实验符合《北京市实验动物管理条例》要求。
1.1.2 试剂和仪器
戊巴比妥钠(Sigma公司,分析纯);BCA 法蛋白定量试剂盒、Western-blot相关试剂(北京普利莱基因技术有限公司)[4];组织样本处理所需蛋白酶抑制剂(南京凯基生物科技发展有限公司);Anti-mTOR antibody(abcam,USA.Ab2732);Anti-mTOR (phospho S2481) antibody[EPR427(N)](ab137133);Anti-LC3B antibody(ab48394);Anti-GAPDH antibody(abcam,USA.ab9485)。
小动物呼吸机(Kent Scientific 325);十二道自动分析心电图机(FX-8322);电子天平(CP225D 型);小动物高分辨率超声成像系统(Vevo2100,加拿大 VisualSonic公司,30MHz探头,固定聚焦深度12.7 mm,配备VIVO STRAIN分析软件);图像分析系统(Olympus);恒温水浴系统(Multi Temp Ⅲ cooling,Pharmacia Biotech);蛋白电泳及电转系统(Bio-RadMiniIII);振荡器(HY-5 型);平板式扫描仪(Umax2100L);动物跑步机(DB030)。
1.2 造模方法
LAD致CHF大鼠模型的建立方法同课题组前期发表文章[4]。腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉大鼠,备皮。呼吸机参数为:呼吸频率80次/min,潮气量3 ml/kg,吸呼比1∶2。沿第3、4肋间开口,暴露心脏后,于左心耳边缘下1 mm进针,行LAD术。结扎后,利多卡因注射液心肌表面给药1~2滴,呋塞米注射液腹腔给药0.1~0.2 ml后逐层关胸。术后青霉素注射液腹腔给药,800万单位,每日3次,连续3天。根据《中国心力衰竭诊断和治疗指南2018》,射血分数<50%是诊断心力衰竭的重要指标之一[6]。本研究在LAD术后4周末,行心电图和超声心动检查,标准12导联心电图中出现6~8个导联Q波、且LVEF 30%~50%的32只模型大鼠入选后续实验。
1.3 分组及运动方案
分组及跑台训练方案参照Bedford[5]的运动负荷标准制定,与本研究前期发表文章相同[4]。随机分为4组,每组8只,具体如下:(1)C+LAD组为模型对照组,不叠加运动训练;(2)模型+低强度运动训练(LE+LAD)组:70%VO2max:跑台坡度3°,30 m/min×12 min/次×3次;(3)模型+中等强度运动训练(ME+LAD)组:80%VO2max:跑台坡度6°,32 m/min ×12 min/次×3 次;(4)模型+高强度运动训练(HE+LAD)组:90%VO2max:跑台坡度6°,36 m/min×12 min/次×3次。所有运动组动物于术后第5周开始运动,12 min/次,每次间歇30 min,3次/日,每周运动5天。所有动物于运动训练开始后第8周末取材。
1.4 超声心动评价各组大鼠心功能
为评价运动训练对大鼠心功能的影响,各组大鼠在接受不同强度运动训练8周后进行心脏超声检查。大鼠超声检查采用Vevo 2100小动物高分辨率超声成像系统(Visualsonics公司,加拿大),大鼠探头MS-250,频率30 MHz,固定聚焦深度12.7 mm,数据分析采用配套VIVO STRAIN软件。所有动物均空腹状态检查,麻醉后左侧卧位,动态图像观测与瞬时停祯结合,采集二维、M型及多普勒超声心动图。检测左室射血分数(ejection fraction,EF)和短轴收缩率(fraction shortening,FS),评价心肌收缩、舒张功能。
1.5 Western-blot实验
方法与课题组前期发表文章相同[4]。简述如下,取左心室梗死边缘区0.5mm以内心肌组织50 mg,提取总蛋白,BCA法进行蛋白含量测定后,每孔上样50 μg,采用浓缩胶5%~7%,分离胶10%或12.5%。电泳条件:100 V,1.5 h。转膜条件:300 mA,1~1.5 h,5%脱脂奶粉4℃封闭1h。一抗条件:兔抗大鼠雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)多克隆抗体1∶1000;兔抗大鼠磷酸化雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)单克隆抗体1∶1000;兔抗自噬相关蛋白LC3B(microtubuleassociated protein light chain 3B,LC3B)多克隆抗体1∶1000;兔抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体1∶1000。孵育过夜后0.1%TBST漂洗NC膜3×15 min。二抗条件:辣根过氧化物酶标记的羊抗兔二抗(1∶5000),37℃孵育1.5 h,TBST漂洗3×15 min。滴加ECL发光液,曝光。扫描胶片后,使用Image J软件分析目标条带的光密度值,与内参(GAPDH)条带光密度值进行比较后,得到目的蛋白表达的相对光密度。
1.6 统计学方法
所有数据采用Spss22.0软件进行统计分析。分析结果以均数±标准差(±s)表示,两组间比较采用独立样本t检验,P<0.05为差异显著,P<0.01为差异非常显著。
2 结果
2.1 超声心动评价结果
与C+LAD组比较,ME+LAD组大鼠FS和EF均显著升高(P<0.01),LE+LAD组FS显著改善(P<0.05);ME+LAD组大鼠FS值显著高于HE+LAD组(P<0.01),EF值显著高于HE+LAD组(P<0.01)。
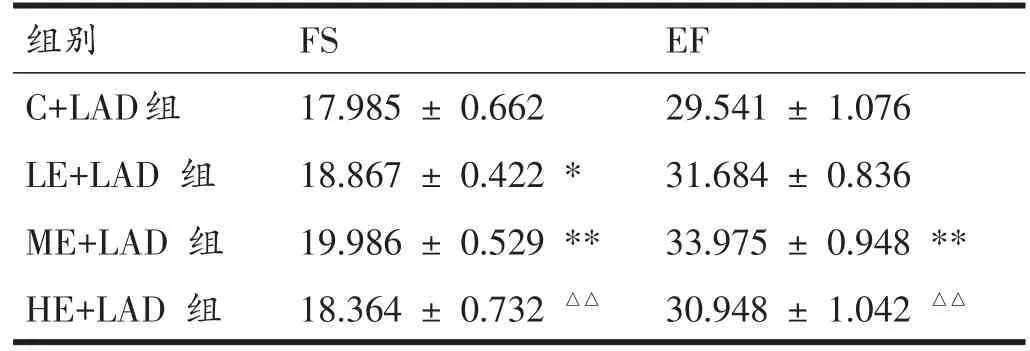
表1 各组大鼠运动后8周心功能比较(n=8,%)
2.2 心肌细胞自噬相关蛋白表达情况
与C+LAD组比较,LE+LAD组和ME+LAD组大鼠心肌组织mTOR表达降低(P<0.05,P<0.01),ME+LAD组和HE+LAD组大鼠心肌组织p-mTOR表达降低(P<0.01),LC3B-Ⅱ表达升高(P<0.01)。与 LE+LAD组相比,ME+LAD组和HE+LAD组大鼠心肌组织p-mTOR表达降低、LC3B-Ⅱ表达升高(P<0.01)。
图1 各组大鼠心肌组织自噬相关蛋白表达水平
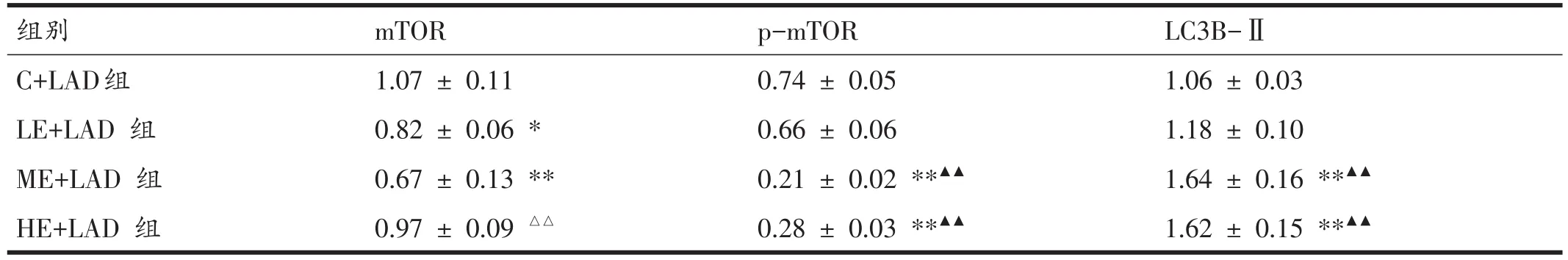
表2 各组大鼠心肌组织自噬相关蛋白条带分析结果
3 讨论
心衰是各种心脏疾病的严重表现或晚期阶段,死亡率和再住院率居高不下[6]。冠心病导致的心肌缺血是CHF最主要的诱因。在CHF的临床治疗和康复过程中,心功能改善程度是判断治疗效果的重要指标。国内相关临床研究表明,运动疗法能通过减轻患者心脏负荷、降低外周血管阻力,减少心肌耗氧量,增强心肌收缩力,提高心排出量,有效促进CHF患者心功能和生活质量的改善[7-9]。国外学者也发现,运动训练能够激活骨骼肌自噬水平,改善心梗大鼠心功能[10]。本研究结果显示,与C+LAD组大鼠心功能相比,不同负荷训练对模型动物的心功能表现为EF和FS值的不同程度改善。其中,以ME+LAD组大鼠EF和FS值升高最为显著。上述动物在体实验结果进一步验证了运动疗法对心力衰竭动物心功能的改善作用。与此同时,心力衰竭模型的成功复制为运动疗法的机制研究提供了可能。为探讨运动疗法实现心功能改善的可能机制,本研究以心肌细胞自噬相关细胞因子的表达为靶点,进行了较为深入的研究。
自噬是真核细胞通过溶酶体机制降解自身成分的一种代谢途径。细胞通过自噬降解损坏的细胞器和大分子延长细胞寿命。依赖于激活的时间、幅度和细胞类型,自噬过程在多种心血管疾病中表现出双重作用[11]。有研究发现,适宜强度的运动可能会上调心肌细胞自噬水平,促进细胞内代谢废物降解,引起心肌组织细胞良好的适应性重塑,帮助维持心肌细胞自身稳态[12]。但大强度长时间的耐力训练可能会引起心肌细胞形态异常,它可能导致线粒体巨变和自噬体增多、细胞内成分过度降解,进而导致心肌细胞死亡,从而形成心肌损伤的结构基础[13]。本研究根据不同运动负荷对心衰模型动物进行分组训练,希望能够发现不同负荷运动对大鼠心肌细胞自噬水平的影响。
mTOR已被明确为自噬的负性调控因子。有研究认为,在病理性心肌肥厚形成及心力衰竭进展过程中,通过抑制 mTOR信号通路,阻断其调节的蛋白质合成,提高自噬水平,可以减弱心肌肥厚,延缓心力衰竭进展[14]。LC3B也是自噬的关键蛋白,在自噬泡形成过程中参与两种泛素样蛋白系统的加工过程,被认为是自噬活动的特异性标志物,缺血区域周围的心肌细胞LC3B-Ⅱ水平的显著升高也表明了该区域心肌细胞自噬的激活[15,16]。Moradi等研究发现,规律运动联合饮食控制能够上调LC3B-Ⅱ水平,抑制心衰大鼠的左心室重构[17]。但目前针对心衰模型动物心肌细胞自噬水平与不同负荷运动训练之间关系的研究,尚未见报道。因此,本研究将上述指标相结合,对不同负荷运动后大鼠心肌细胞的自噬水平进行判断。结果表明,LE+LAD组的运动负荷程度不足以激活心肌细胞自噬,ME+LAD组和HE+LAD组训练均能够显著抑制mTOR及其磷酸化水平,同时,LC3B-Ⅱ/GAPDH 水平也发生了不同程度的提高。可见,中、高负荷的运动训练能够激活心衰大鼠心肌细胞自噬水平,而且运动负荷越大,心肌细胞自噬水平越高。
然而,本研究发现,自噬激活水平最高的HE+LAD组大鼠心功能并未得到显著改善。结合前期文献报道和本课题前期研究结果[4]分析原因认为,高负荷运动训练可能导致了心肌细胞自噬的过度激活,同时导致了心肌细胞凋亡水平的升高,而中等负荷的运动训练则在心肌细胞的自噬与凋亡之间形成了良好的平衡,从而对心功能的恢复起到了积极作用,进一步证实了心衰的运动康复过程中运动负荷选择的重要性。
4 结论
适度运动能够改善心力衰竭大鼠心功能,这种心功能的改善可能与抑制mTOR和其磷酸化水平,提高LC3B-Ⅱ水平,适度激活心肌细胞自噬有关。
