ECMO持续治疗下肝素诱导的血小板减少症1例
2019-02-10陈洁盖娇娇李志杰蔺甜甜闫鹏
陈洁 盖娇娇 李志杰 蔺甜甜 闫鹏
【关键词】肝素;肝素诱导的血小板减少症;血栓形成
【中图分类号】R542 【文献标识码】A 【文章编号】ISSN.2095.6681.2019.29..02
1 病例资料
患者,男,77岁,9年前患“冠心病/急性心肌梗死”,行“冠脉支架植入术”。
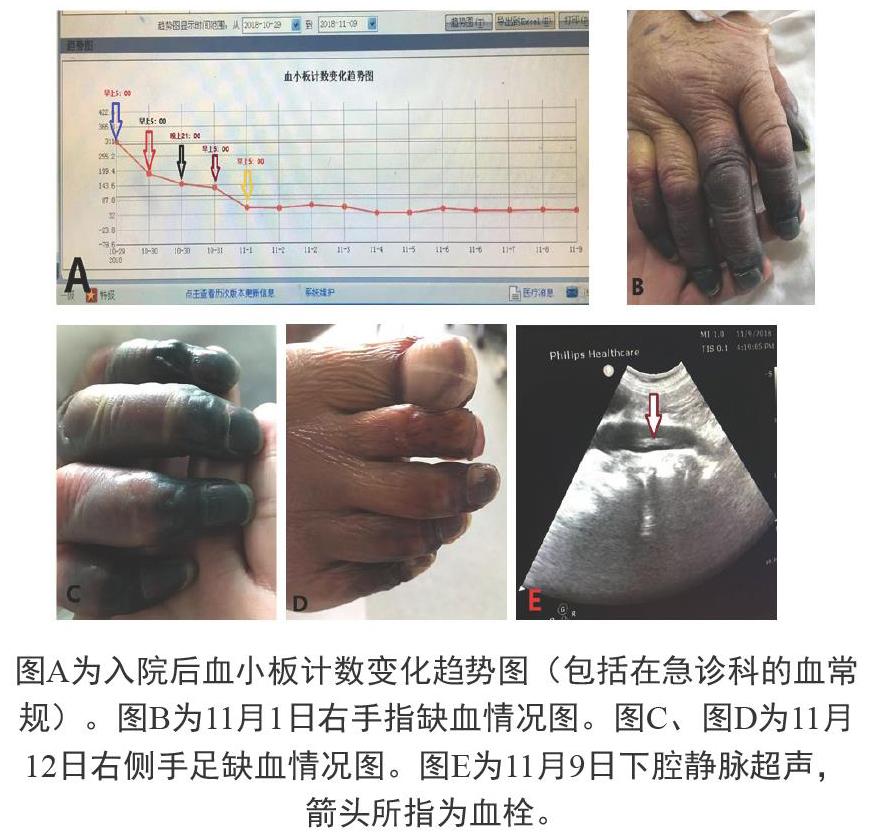
主诉:间断低热25天,胸闷、气短21天,加重3天。患者于2018年10月4日受凉后出现发热,体温最高达39.0°C,不伴有其它症状,未治疗。10月6日开始自服“感冒药”后体温无好转。10月8日出现气短、胸闷,活动后加重,当地医院输液治疗,具体用药不详,无好转。10月10日胸闷、气短加重,手指青紫,仍有发热,就诊于当地医院急诊科,测指脉氧36%,胸部CT平扫示右肺大片间质性肺炎、右侧胸腔积液、双侧胸膜增厚、双侧肺气肿,收入ICU后给予莫西沙星、比阿培南抗感染,那曲肝素钙(6150iu/次,q12h)抗凝治疗,体温降至正常,胸闷、喘憋无好转。10月16日胸部增强CT示右肺病变加重、肺栓塞,改用万古霉素联合莫西沙星抗感染治疗,加用利伐沙班(15 mg,2次/d)抗凝治疗,症状好转,转入普通病房治疗。10月27日再次出现发热,胸闷、喘憋加重,伴咳嗽、咯血,为痰中带血,停用抗凝药物,再次入住当地医院ICU,住院期间查血常规未发现血小板减少。10月29日转入北京中国人民解放军总医院急诊科查血常规示:血小板计数311×109/L,床旁超声示右下肢肌间静脉血栓形成,因病情危重行气管插管、机械通气,当时吸氧浓度100%,氧合指数为46 mmHg,当天下午经右侧颈内静脉和右侧股静脉留置导管行ECMO治疗,肝素钠负荷剂量静推,之后转入北京中国人民解放军总医院RICU,应用泰能、利奈唑胺抗感染治疗,持续床旁CRRT治疗,ECMO治疗期间四肢末端无发绀。10月30日未用肝素钠抗凝,早上5:00查血常规:血小板计数190×109/L,10月30日晚上21:00查查血常规:血小板计数150×109/L,于10月31日应用肝素钠6225 IU+生理盐水50 mL持续泵入抗凝,早上5:00查血常规:血小板计数133×109/L,当天上午出现血压下降,快速型房颤,持续大剂量去甲肾上腺素、多巴胺升压治疗,当时双上肢指端出现青紫,经扩容、纠正房颤等治疗后血压趋于稳定,升压药物逐渐停用。11月1日患者双上肢指端青紫症状无缓解,且逐渐加重,波及至双下肢趾端,桡动脉、足背动脉搏动正常,复查血常规示血小板计数显著下降,为59×109/L,查动脉血气乳酸水平正常范围内,随即停用肝素钠抗凝,持续泵入阿加曲班抗凝,维持APTT 60 s左右,给予输注血浆、血小板治疗。患者四肢指(趾)端青紫进一步加重,逐渐出现四肢指(趾)端出现坏疽。患者于11月6日ECMO撤机,拔除右侧颈内静脉及右侧股静脉置管,行床旁超声未见有静脉血栓形成。住院期间多次行床旁超声示:右侧锁骨下静脉、右侧腋静脉、右侧股深静脉、右下肢肌间静脉、左下肢肌间静脉、下腔静脉均可见血栓形成。
2 讨 论
肝素诱导的血小板减少症(Heparin-induced Thrombocytopenia,HIT)是肝素(普通肝素及其衍生物低分子肝素)与临床最相关的非出血性并发症,以血小板计数降低为主要表现,可引发静脉、动脉血栓形成,严重者甚至导致死亡。HIT是通过形成抗血小板因子4-肝素复合物的IgG抗体介导的免疫并发症。虽然免疫反应很常见(8%~50%)[1-3],但是血小板减少和血栓形成的临床并发症远不常见,在不同临床环境中暴露于该药的病人中有0.2~3%受此影响[1-5]。
图A为入院后血小板计数变化趋势图(包括在急诊科的血常规)。图B为11月1日右手指缺血情况图。图C、图D为11月12日右侧手足缺血情况图。图E为11月9日下腔静脉超声,箭头所指为血栓。
参照《肝素诱导的血小板减少症中国专家共识(2017)》[6],HIT最重要的诊断依据是肝素治疗相关并发症出现的时机,即既往100天之内(特别是30天内)应用过肝素的患者再次使用肝素24小时内会出现血小板计数降低。该患者在外院应用那曲肝素钙抗凝治疗10余天后停用2天,在本院急诊科10月29日早上5:00血常规示血小板计数311×109/L,下午5点左右ECMO治疗时静推负荷剂量肝素钠,当时血常规未查。在10月30日早上5点血常规出现血小板计数为190×109/L,当天晚上血小板计数为150×109/L,图A可以看出血小板计数呈持续性下降趋势,至11月1日早上5:00血小板计数59×109/L,对患者进行4Ts评分为7分。本院急诊科应用肝素前血常规提示血小板计数正常,可排除血小板减少性紫癜、免疫性血小板减少性紫癜等血小板减少性疾病。患者入院后存在感染、应用利奈唑胺、呼吸机辅助通气,虽然这些有可能影响血小板计数,但时间上不足以致血小板快速下降。依據这些表现可以诊断为HIT。HIT按照血小板计数下降的时间顺序可分为三种类型,其中II型HIT主要临床表现为广泛的动、静脉血栓形成,引起四肢血管闭塞或危及生命,亦可引起严重的纤维蛋白原耗竭及DIC,即HIT伴血栓形成综合征[7]。本例患者既往30天内有肝素使用史,再次应用肝素后24小时内出现血小板减少,以及ECMO撤机数天后床旁超声显示多发静脉血栓形成,四肢指(趾)端缺血性表现逐渐加重以至于出现动脉栓塞导致的干性坏疽(见图B、C、D),符合II型HIT的表现。
Greinacher A[8]等人对408例应用肝素治疗的患者进行回顾性分析发现在大多数患者中,发生血栓性并发症同时伴发血小板减少。本例病人持续ECMO治疗期间以及拔管后3天内多次床旁超声均未发现静脉血栓形成,于11月9日以后多次床旁超声检查发现有右侧锁骨下静脉、右侧颈内静脉、右侧腋静脉、右侧股浅静脉、右侧股深静脉、右下肢肌间静脉、左下肢肌间静脉及下腔静脉血栓形成(见图E),同时伴有血小板减少,符合此类病人的临床特征。Hong AP[9]等人研究发现所有14例HIT患者上肢DVT均发生在放置中心静脉导管的同一肢体,这些数据表明中心静脉导管与HIT静脉血栓形成关系密切,尤其是导管损伤的血管更多见静脉血栓形成。本例患者ECMO治疗时是经右侧颈内静脉、右侧股深静脉置管,撤机拔除静脉置管数天后床旁超声显示右侧锁骨下静脉、颈内静脉及下腔静脉、右侧股深静脉、右侧股浅静脉均可见血栓形成,这些受累及的血管均在置管侧肢体,显示几乎所有血栓形成的血管均在ECMO治疗时导管置管部位,提示血栓与导管损伤密切相关。有文献报道[10],急性HIT患者下肢大血管和肺栓塞的静脉血栓形成是最常见的并发症。本例患者床旁超声已经证实存在下肢大血管静脉血栓形成,患者经治疗后ECMO成功撤机,多次胸片提示未见肺实变,超声未发现大量胸腔积液,但患者呼吸机支持参数非常高,氧合指数150以下,我们推测存在肺血栓栓塞症。遗憾的是,因患者病情危重,未能外出行肺动脉增强CT证实。
HIT患者血液中血小板4因子-肝素复合物抗体IgG的主要靶点是表达FcγRIIa受体的血小板[11],两者结合后活化血小板,伴随着强烈的凝血酶生成[12],在此过程中导致血小板减少和血栓形成。一旦发生免疫应答,一部分患者经历血小板减少并进展为威胁生命的血栓形成并发症[13]。血栓形成是HIT最严重的并发症,增加疾病的病死率[14],对患者造成严重的危害。基于此,作为临床医师要有高度的认识和警惕。一旦怀疑或诊断HIT,第一步需立即停用肝素,同时应用一种对血小板无影响的抗凝剂抗凝[15,16],甚至需行血浆置换治疗。
参考文献
[1] Pouplard C, May MA, Iochmann S, et al. Antibodies to platelet factor 4-heparin after cardiopulmonary bypass in patients anticoagulated with unfractionated heparin or a lowmolecular-weight heparin:clinical implications for heparin-induced thrombocytopenia.Circulation 1999;99(19):2530-2536.
[2] Smythe MA, Koerber JM, Mattson JC. The Incidence of Recognized Heparin-Induced Thrombocytopenia in a Large Tertiary Care, Teaching Hospital. Chest 2007;131(6):1620-1622.
[3] Warkentin TE, Sheppard JA, Horsewood P, et al. Impact of the patient population on the risk for heparin-induced thrombocytopenia. Blood 2000;96(5):1703-1708.
[4] Copley AL, Robb TP. III. The Effect of Heparin in Vivo on the Platelet Count in Mice and Dogs. Am J Clin Pathol 1942;12:563-570.
[5] Fidlar E, Jaques LB. The effect of commercial heparin on the platelet count. J Lab Clin Med 1948;33(11):1410-1423.
[6] 肝素誘导的血小板减少症中国专家共识(2017)[J].中华医学杂志,2018,98(6):408-417.
[7] Gurbuz AT, Elliott WG,Zia AA.Heparin-induced thrombocytopenia in the cardiovascular patient:diagnostic and treatment guidelines[J]. European Journal of Cardio-thoracic Surgery 2005,27:138–149.
[8] Greinacher A, Farner B, Kroll H, et al. Clinical features of heparin-induced thrombocytopenia including risk factors for thrombosis. A retrospective analysis of 408 patients. Thromb Haemost 2005;94(1):132-5.
[9] Hong AP, Cook DJ, Sigouin CS, et al. Central venous catheters and upperextremity deep-vein thrombosis complicating immune heparin-induced thrombocytopenia. Blood 2003;101(8):3049-51.
[10] Cosmi B. Current management of heparin-induced thrombocytopenia[J]. Expert Review of Hematology.2015;8(6):837-849.
[11] Kelton JG, Sheridan D, Santos A, et al. Heparin-induced thrombocytopenia: laboratory studies. Blood 1988;72(3):925-30.
[12] Greinacher A, Eichler P, Lubenow N, et al. Heparin-induced thrombocytopenia with thromboembolic complications: meta-analysis of 2 prospective trials to assess the value of parenteral treatment with lepirudin and its therapeutic aPTT range. Blood 2000;96(3):846-51.
[13] Arepally GM.Heparin-induced thrombocytopenia[J].Blood 2017;129(21):2864-2872.
[14] Ban-Hoefen M, Francis C. Heparin induced thrombocytopenia and thrombosis in atertiary care hospital. Thromb Res 2009; 124 (2):189-192.
[15] Warkentin TE, Greinacher A, Koster A, et al. Treatment and prevention of heparin-induced thrombocytopenia: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition)[J]. Chest, 2008, 133(6 Suppl):340S-380S.
[16] Sharifi M, Bay C, Vajo Z, et al. New oral anticoagulants in the treatment of heparin-induced thrombocytopenia[J]. Thromb Res, 2015, 135(4):607-609.
本文编辑:刘欣悦
