山东省番茄尖孢镰刀菌的分离及鉴定
2019-02-10张秀刘蕾王辉李文丽王富
张秀 刘蕾 王辉 李文丽 王富
摘要:本研究以山东省单县番茄枯萎病及临淄、寿光、胶州、即墨、海阳、莱阳等地区的番茄颈腐、根腐病发病植株为主要试验材料,对病原菌进行分離、纯化及培养,并利用分子检测技术对供试菌株进行生理小种鉴定。结果显示,山东单县番茄枯萎病的致病菌为番茄枯萎病菌生理小种1,其他地区番茄颈腐、根腐病致病菌为番茄枯萎病菌生理小种3。
关键词:山东省;番茄;分子检测;尖孢镰刀菌
中图分类号:S432.4+4 文献标识号:A 文章编号:1001-4942(2019)12-0078-04
Abstract In the study, tomato plants infected fusarium from Shanxian and happened neck rot and root rot in Linzi, Shouguang, Jiaozhou, Jimo, Haiyang and Laiyang areas were selected as research materials. The pathogen was isolated, purified and cultured. The physiological race of the samples were identified by molecular markers. The results showed that the pathogenic fungus of tomato fusarium wilt in Shanxian was Fusarium oxysporum f. sp. lycopersici race 1, while that of tomato neck rot and root rot in other areas was Fusarium oxysporum f. sp. lycopersici race 3.
Keywords Shandong Province; Tomato; Molecular markers; Fusarium oxysporum
番茄枯萎病和番茄颈腐病是危害番茄生产的主要土传病害,尤其在华北、东北地区发病较为严重[1]。有研究表明,引起番茄枯萎病和颈腐病的病原菌均为尖孢镰刀菌[2],尖孢镰刀菌不同生理小种在不同植株上具有特定的致病性[3-7]。不同专化型和生理小种引起的病害需要不同的防治方法,所以准确确定专化型和生理小种对预防治理由尖孢镰刀菌引起的病害尤其重要。
虽然尖孢镰刀菌的类型可以通过选择性培养基上表现的形态特征来确定[8,9],但是尖孢镰刀菌的致病类型、专化型和种族却不能由此鉴定。目前最普遍的鉴定方法是利用试验接种法确定尖孢镰刀菌的专化型和相应生理小种,但是这种方法耗时长[10,11]。本研究借助分子检测手段对分离的病原物进行鉴定,从而明确山东省枯萎病和颈腐、根腐病病原菌的生理小种。
1 材料与方法
1.1 试验材料
采自山东省单县、临淄、寿光、胶州、即墨、海阳、莱阳地区番茄植株发病的根或茎。
1.2 试验方法
1.2.1 真菌的分离、纯化及培养 选用新近发病的番茄植株作为分离材料,使用之前表面喷70%乙醇。将表皮组织用灭菌解剖刀削去,在病健交界处取材,切取其中小块变色的维管束组织,升汞灭菌后用无菌水冲洗数次,放于PDA培养基上,每个培养基放1~3块,25℃培养5 d即可长出菌落。参照孙飞龙[12]的方法进行单孢分离。将纯化的单菌落接种到PDA培养基上培养5 d,观察菌落形态、大小和颜色等。
用移液枪吸取PDB液体培养基反复冲洗吹打菌落,将冲洗下来的孢子和菌丝加入150 mL马铃薯葡萄糖液体培养基中,于180 r/min的摇床上振荡培养5 d,收集菌丝用于DNA提取。
1.2.2 DNA提取 将液体培养的真菌用三层纱布过滤后1 000 r/min离心10 min,弃掉上清液保留沉淀,在烘箱中35℃下烘12 h,即可得到干燥的菌丝。使用真菌基因组DNA提取试剂盒(Solarbio)提取真菌样品DNA。
1.2.3 DNA浓度的检测 取5 μL DNA样品,采用1%的琼脂糖凝胶电泳进行检测(120 V,110 A,30 min),于Bio-RAD自动凝胶成像系统观察条带亮度,并使用紫外分光光度计检测样品DNA浓度。
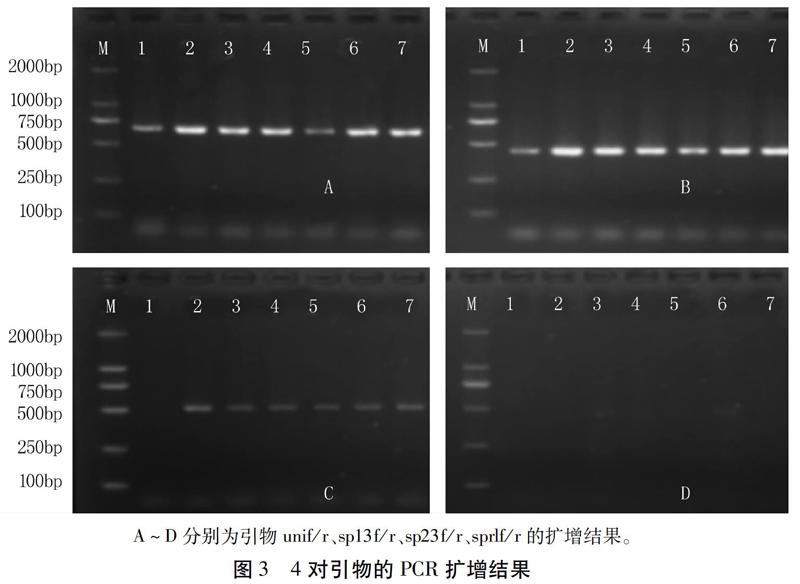
1.2.4 分子检测 用四种引物[13](表1)分别进行PCR扩增。PCR反应体系: 模板 DNA(20~80ng/μL)2.0 μL,2× PCR Mix(含Mg2+,dNTPs,Taq DNA Polymerase等)10.0 μL,引物(10 μmol/L)各1.0 μL,灭菌超纯水6.0 μL。PCR反应程序:94℃ 5 min;94℃ 30 s,56℃ (Uni)、58℃ (sp13,sp23,sprl) 30 s,72℃ 30 s,35个循环;72℃ 10 min。PCR反应结束后,取7 μL扩增产物用1.5%琼脂糖凝胶电泳进行检测,采用Bio-RAD自动凝胶成像系统观察并拍照,记录扩增结果。
2 结果与分析
2.1 真菌的菌落形态
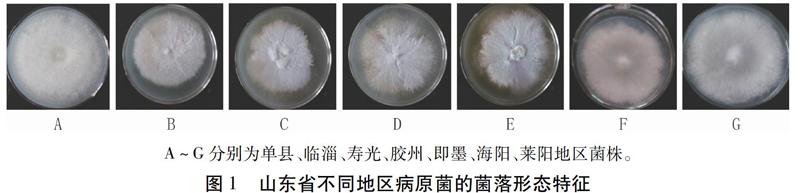
病原菌在PDA培养基上25℃培养5 d后,临淄、寿光、胶州、即墨、海阳、莱阳地区的病原菌形态基本一致,菌落颜色呈淡白灰色,圆形,菌丝为绒毛状,直径大致60 mm;单县分离的菌株与其它几个地区存在明显区别,菌落颜色呈淡粉白色,圆形,菌丝绒毛状,长且密集,菌丝量大(图1)。
2.2 DNA的质量与浓度检测
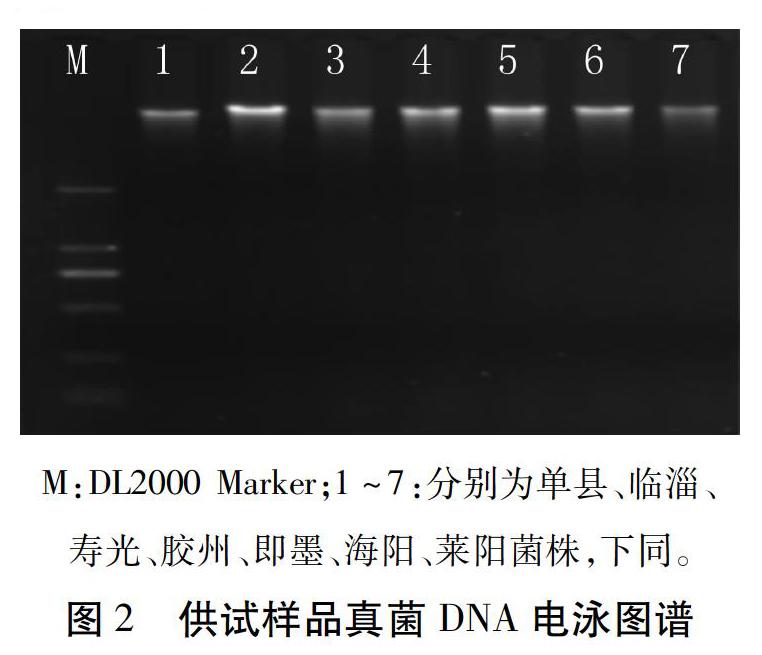
经紫外分光光度计检测,样品DNA的OD260/OD280值在1.8 ~ 2.0范围内,说明真菌DNA样品质量良好。用1%的琼脂糖凝胶电泳检测,电泳条带明亮且整齐无拖带(图2),均可用于PCR扩增。
2.3 分子标记检测
引物unif/r和sp13f/r在所有菌株DNA中均可分别扩增出670 bp和445 bp的特异片段;引物sprlf/r在所有样品中均未扩增出947 bp的特异片段;引物sp23f/r在除单县外的其它地区菌株DNA中均扩增出518 bp的特征片段(图3)。初步确定单县枯萎病病原菌为枯萎病菌生理小种1(Fusarium oxysporum f. sp. lycopersici race 1, Fol 1),其它地区病原菌为枯萎病菌生理小种3(Fusarium oxysporum f. sp. lycopersici race 3, Fol 3)。
3 讨论与结论
本研究发现,临淄、寿光、胶州、即墨、海阳、莱阳地区的病原菌菌落特征基本一致,单县菌株的菌落特征与其它地区有明显区别。进一步利用分子检测技术进行鉴定发现,临淄、寿光、胶州、即墨、海阳、莱阳6个地区的病原菌为枯萎病菌生理小种3,单县地区的病原菌为枯萎病菌生理小种1。
番茄颈腐、根腐病害已给美国、日本、加拿大、墨西哥、以色列、韩国以及欧洲等许多国家和地区的番茄生产造成重大损失[1]。山东省于2010年在寿光发现该病害后,该病害逐渐蔓延至全省各地;当前,此病害已经严重威胁到山东省温室大棚冬春季番茄生产[14]。本研究对从山东省主要番茄产区采集的番茄颈腐、根腐病病样进行病原菌分离、纯化及鉴定,基本确定引起山东省番茄颈腐、根腐病主要病原物为番茄枯萎病生理小种3。Hirano等[13]将日本地区番茄颈腐、根腐病病原菌鉴定为Fusarium oxysporum f. sp. radicis-lycopersici (FORL),可见,山东省番茄颈腐、根腐病病原菌与日本地区不同。
参 考 文 献:
[1] Jacobs A, Heerden S W. First report of Fusarium oxysporum f. sp. radicis-lycopersici in South Africa[J]. Australasian Plant Dis. Notes, 2012, 7: 29-32.
[2] 耿丽华, 李常保, 迟胜起, 等. 番茄颈腐根腐病病原鉴定及不同条件对其生长的影响[J]. 植物病理学报, 2012, 42(5): 449-455.
[3] Noguez M A, Tokeshi H. Review of classification of race 3 of Fusarium oxysporum f. sp. lycopersici[J]. Anais Da Escola Superior De Agricultura Luiz De Queiroz, 1973, 31:419-430.
[4] Schmidt S M, Houterman P M, Schreiver I, et al. MITEs in the promoters of effector genes allow prediction of novel virulence genes in Fusarium oxysporum[J]. BMC Genomics, 2013, 14(1): 119-139.
[5] Cirulli M, Alexander L G. A comparison of pathogenic isolates of Fusarium oxysporum f. sp. lycopersici and different sources of resistancein tomato[J]. Phytopathology, 1996, 56: 1301-1304.
[6] Grattidge R, O'Brien R G. O′ccurrence of a third race of Fusarium wilt of tomatoes in Queensland.[J]. Plant Disease, 1982, 66(2): 165-166.
[7] Shiomi H, Komada H. Highly virulent isolates of Fusarium oxysporum f. sp. lycopersici race 2[J]. Annals of the Phytopathological Society of Japan, 2006, 72:221-222.
[8] Laurence M H, Walsh J L, Shuttleworth L A, et al. Six novel species of Fusarium from natural ecosystems in Australia[J]. Fungal Diversity, 2015, 77(1):1-18.
[9] Ghiasian S A, Rezayat S M, Kord-Bacheh P, et al. Fumonisin production by Fusarium species isolated from freshly harvested corn in Iran[J]. Mycopathologia, 2005, 159(1):31-40.
[10]Troisi M, Bertetti D, Gullino M L, et al. Race differentiation in Fusarium oxysporum f.sp. chrysanthemi[J]. Journal of Phytopathology, 2013, 161(10):675-688.
[11]Woo S L, Zoina A, Del Sorbo G, et al. Characterization of Fusarium oxysporum f. sp. phaseoli by pathogenic races, VCGs, RFLPs, and RAPD[J]. Phytopathology, 1996, 86(9):966-973.
[12]孫飞龙. 北五味子3种病害的病原菌鉴定及有效药剂筛选[D]. 长春:吉林农业大学, 2016.
[13] Hirano Y, Arie T. PCR-based differentiation of Fusarium oxysporum f. sp. lycopersici and radicis-lycopersici and races of F. oxysporum f. sp. lycopersici[J]. Journal of General Plant Pathology, 2006, 72(5):273-283.
[14]程琳, 张生, 李艳青, 等. 番茄颈腐根腐病病原菌鉴定与抗病种质材料的筛选[J]. 园艺学报, 2016, 43(4):781-788.
