PLK1对人子宫内膜癌AN3CA细胞增殖的影响及其相关机制
2019-02-10陈玉忠张晓静邵均均张慧慧王丽华
魏 丽,陈玉忠,张晓静,邵均均,李 艳,张慧慧,刘 健,王丽华*
(1蚌埠医学院第一附属医院肿瘤妇科,蚌埠 233000;2蚌埠医学院第一附属医院肿瘤外科;*通讯作者,E-mail:doctorwlh@163.com)
子宫内膜癌是妇科常见恶性肿瘤之一,2019年癌症统计数据表明子宫内膜癌发病率和死亡率近些年呈上升趋势[1]。近年随着基因组学等相关精准治疗发展迅速,针对肿瘤特异表达基因的研究已成为目前研究的热点。作为丝氨酸-苏氨酸激酶家族之一的Polo样激酶1(polo-like kinase 1,PLK1),在生殖系统肿瘤[2,3]、血液系统肿瘤[4]和神经系统肿瘤[5]等多种恶性肿瘤中高表达,并在细胞有丝分裂中起重要作用。因此,PKL1有望成为成为子宫内膜癌的治疗靶点。目前PKL1在子宫内膜癌中研究较少。本研究使用免疫组化检测PLK1在子宫内膜癌组织中的表达,并通过敲低和过表达PKL1,探讨其对子宫内膜癌细胞增殖的影响及其相关机制。
1 材料与方法
1.1 主要试剂与仪器
CCK-8试剂盒购于诺唯赞生物试剂公司(南京),二甲亚砜(DMSO)(Biosharp公司,美国),1640培养基、胰蛋白酶、胎牛血清(FBS)购于Gibco公司(美国),兔抗PLK1抗体购于abcam公司(美国),鼠抗GAPDH抗体购于Proteintech公司(中国)PLK1 shRNA慢病毒购于上海吉玛基因有限公司(中国)。PLK1重组质粒购于武汉淼灵生物科技有限公司(中国)。Lipo 3000购于赛默飞公司(美国)。子宫内膜癌组织芯片购于上海芯超生物有限公司(中国)。恒温CO2培养箱(Thermo公司,美国),Bio Tek酶标仪(Synergy HT公司,美国),IX73倒置荧光显微镜(Olympus公司,日本)。ChemDoc XRS凝胶成像系统(Bio-Rad公司,美国)。
1.2 细胞培养
人子宫内膜癌AN3CA细胞购于中国科学院上海细胞库。用含10% FBS、10 U/ml青霉素、100 U/ml链霉素的1640培养基培养AN3CA细胞,37 ℃、5% CO2细胞培养箱中培养。
1.3 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达
慢病毒感染前24 h,将细胞按每孔4×105个细胞接种于6孔板,使用含胎牛血清和抗生素的1640培养基,使细胞量在24 h内达到80%左右。实验分为空白对照组(Mock)、无效序列对照组(Scr)和PLK1干扰序列sh1组、sh2组、sh3组,具体序列见表1;分别加入不同的shRNA慢病毒,并加入1‰体积的聚凝胺(polybrene)增加细胞膜的通透性。然后将细胞在5% CO2,37 ℃培养箱中继续培养48 h,收集细胞,用于后续分析。

表1 PLK1干扰序列碱基Table 1 PLK1 interference sequences
1.4 Western blot法检测细胞中PLK1、Cdc25c蛋白表达
取对数生长期的子宫内膜癌的AN3CA细胞,接种于6孔板中,待细胞生长至80%左右,使用转染干扰或过表达序列处理细胞48 h收集细胞,并用RIPA蛋白裂解缓冲液在冰上裂解30 min,12 000 r/min,4 ℃离心30 min,提取上清进行蛋白定量,进行SDS-聚丙烯酰胺凝胶电泳,电泳结束将蛋白条带转至PVDF膜,蛋白封闭,分别孵育PLK1、Cdc25c一抗(1 ∶500)、二抗,ECL发光液显影。
1.5 CCK-8法检测细胞存活率
经转染干扰或过表达序列处理的AN3CA细胞以2 000个/孔接种于96孔板中置于培养箱培养,每组4个复孔,放入培养箱中继续培养24,48,72,96 h。在相应的时间点每孔加入10 μl的CCK-8,继续孵育2 h,用酶标仪测定波长为450 nm时每孔细胞的吸光度OD值。
1.6 克隆形成实验检测细胞增殖能力
子宫内膜癌细胞经转染干扰或过表达序列处理48 h,6孔板中每孔接种1 500个细胞,放入培养箱培养10 d至克隆形成,除去培养液,用PBS洗2次,用5%多聚甲醛固定20 min,5%结晶紫染色室温孵育20 min,用双蒸水洗涤2次。室温干燥,观察克隆形成情况。
1.7 PLK1重组质粒转染
取生长状态良好的AN3CA细胞,接种于6孔板中,待细胞生长至6孔板面积的80%进行转染。实验分为空载体对照组(vector)和PLK1过表达质粒(overexpression,OE)组。每组各取2个1.5 ml EP管,每管中均加入500 μl无血清1640培养基,然后一个EP管中加入5 μg质粒(对照组为空载pcDNA3.1质粒,OE组为pcDNA3.1-PLK1重组质粒);另一个EP管加入15 μl Lipo 3000转染试剂,随后将空载体对照组和OE组的2个EP管分别混合静置15 min,加入6孔板中,作用AN3CA细胞6 h更换新鲜的完全培养基,置于培养箱中培养48 h,收集细胞,用于后续实验分析。
1.8 统计学分析
2 结果
2.1 PLK1在子宫内膜癌组织中高表达
为探索PLK1在子宫内膜癌中的表达情况,首先对组织芯片进行HE染色,可见正常组织结构较均匀,肿瘤组织可见细胞核大深染,组织结构紊乱(见图1A)。而后对组织芯片进行免疫组化染色,镜下观察肿瘤组织中PLK1染色明显,正常组织染色较少(见图1B),同时对免疫组化镜下观察结果进行统计分析,结果显示PLK1在肿瘤组织中的表达明显高于正常组织,差异有统计学意义(P<0.05,见图1C)。免疫组化结果证实:PLK1在子宫内膜癌中高表达,说明PLK1在子宫内膜癌的发生发展中可能发挥重要作用。
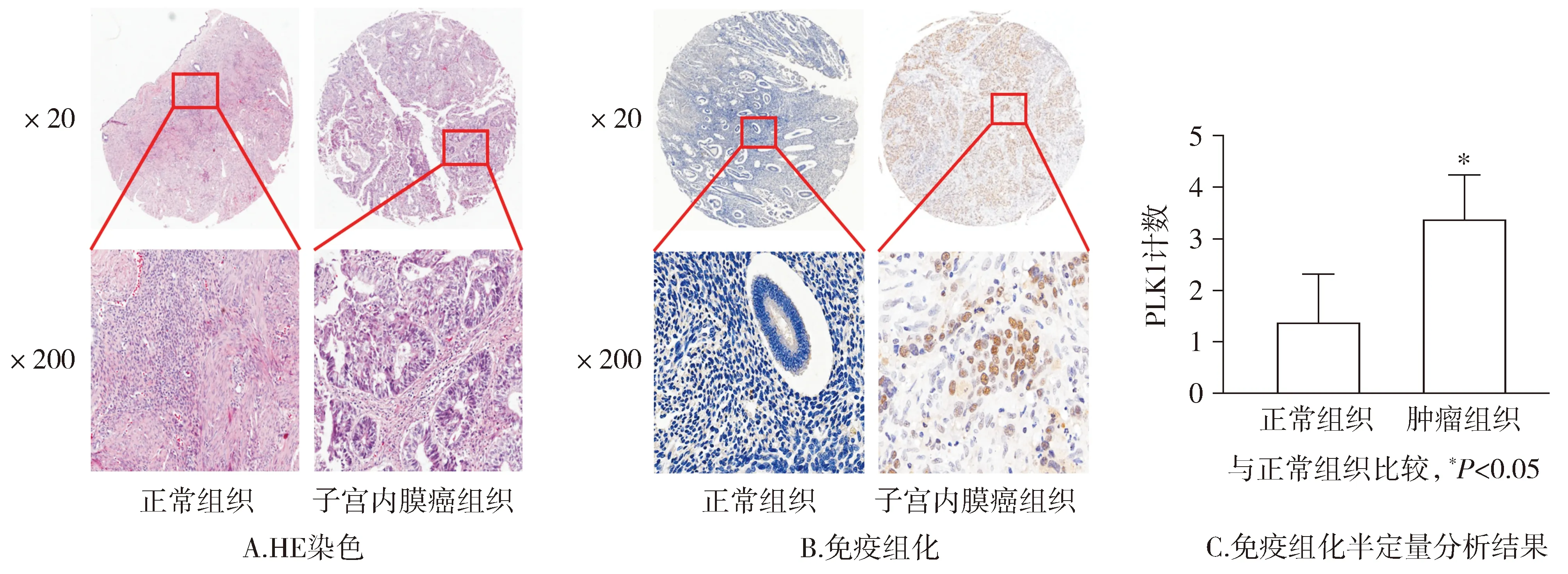
图1 PLK1在子宫内膜癌组织中高表达Figure 1 PLK1 high expression in endometrial carcinoma
2.2 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达
为检测shRNA对子宫内膜癌细胞AN3CA中PLK1表达的影响及筛选有效的shRNA序列,分别设置空白对照组(Mock)、无义序列对照组(Scr)、包含不同PLK1干扰序列的sh1组、sh2组、sh3组,在shRNA慢病毒感染AN3CA细胞48 h提取蛋白进行Western blot实验,观察三组序列的干扰效果进行干扰序列的初筛,结果显示与Mock组相比,含PLK1干扰序列的sh1组、sh2组、sh3组处理的AN3CA细胞株中PLK1的表达显著降低,而Scr组无明显改变(见图2)。此结果为筛选有效PLK1干扰序列提供了依据,据此实验结果选取Scr、sh1、sh2用于后续的实验分析。

图2 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达Figure 2 The expression of PLK1 after shRNA treatment in AN3CA cells
2.3 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达后细胞抑制增殖
基于PLK1干扰序列的筛选结果,分别用Scr、sh1、sh2慢病毒作用子宫内膜癌细胞AN3CA 24,48,72,96 h,采用CCK-8法检测各组细胞的OD450吸光度值。结果显示,在相同时间点,sh1组和sh2组与Scr组相比,作用第2天和第3天时OD450值明显降低,且差异有统计学意义(P<0.05,见图3)。在克隆形成实验中,与Scr组相比,sh1、sh2作用后的AN3CA细胞集落形成数量明显减少(见图3)。这表明在子宫内膜癌细胞AN3CA中,敲低PLK1的表达能明显抑制细胞的增殖。
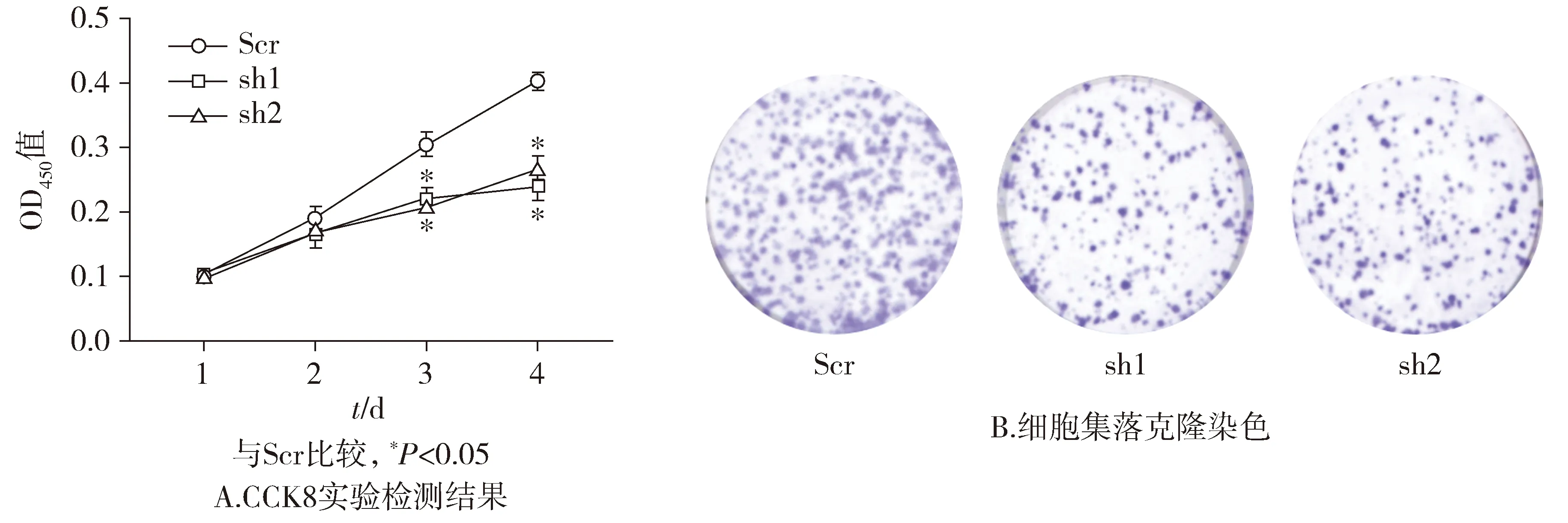
图3 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达后细胞增殖Figure 3 Proliferation after the down-regulation of PLK1 expression by shRNA in endometrial cancer AN3CA cells
2.4 shRNA敲低子宫内膜癌细胞AN3CA中PLK1表达后Cdc25C的表达降低
为探索降低PLK1表达后细胞增殖抑制的相关机制。对子宫内膜癌细胞AN3CA进行了如下处理:分别将Scr、sh1、sh2应用于AN3CA细胞48 h,提取蛋白进行进行Western blot实验。蛋白条带结果显示与Scr组相比,sh1、sh2处理的AN3CA细胞Cdc25C表达量明显降低,蛋白相对表达量分析显示sh1、sh2组与Scr组相比,差异有统计学意义(P<0.05,见图4)。这表明在AN3CA细胞中,PLK1被干扰后的细胞增殖抑制可能是由于Cdc25C的下调所介导的。
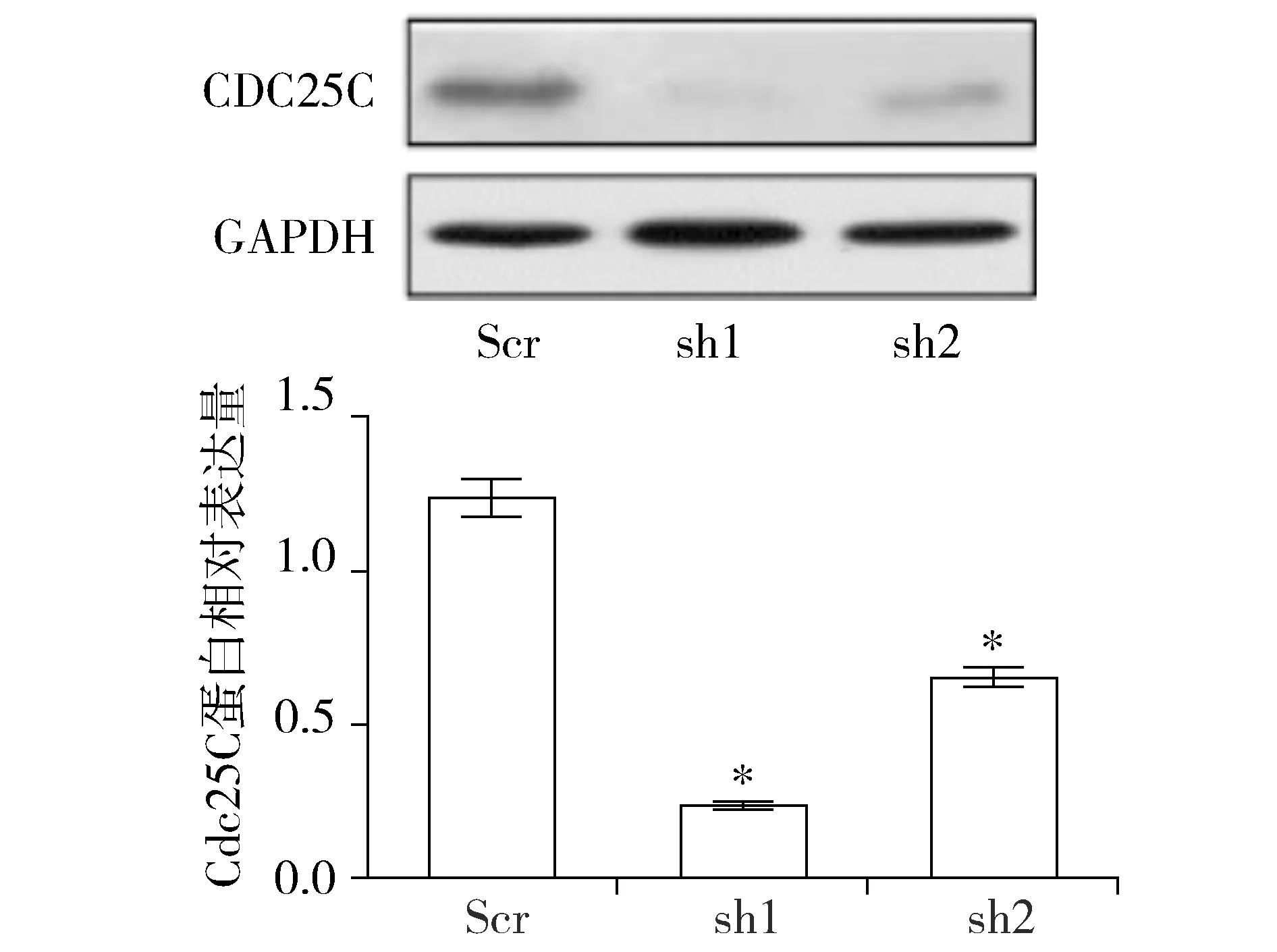
与Scr比较,*P<0.05图4 shRNA作用子宫内膜癌细胞AN3CA后Cdc25C的表达Figure 4 The expression of Cdc25C after the down-regulation of PLK1 expression by shRNA in endometrial cancer AN3CA cells
2.5 子宫内膜癌AN3CA细胞中过表达PLK1后可促进细胞的增殖
子宫内膜癌AN3CA细胞株转染PLK1的过表达质粒,培养48 h提取蛋白进行Western blot实验验证,结果显示,与vector组相比,PLK1过表达组PLK1的表达明显增加。CCK8实验结果表明,第2天和第3天PLK1过表达质粒组较空白组OD450值增加,且差异具有统计学意义(P<0.05,见图5)。细胞集落克隆实验显示,与对照组相比,转染PLK1过表达质粒的AN3CA细胞的集落形成密度明显增加(见图5)。这表明在子宫内膜癌细胞AN3CA中过表达PLK1表达后可促进细胞的增殖。
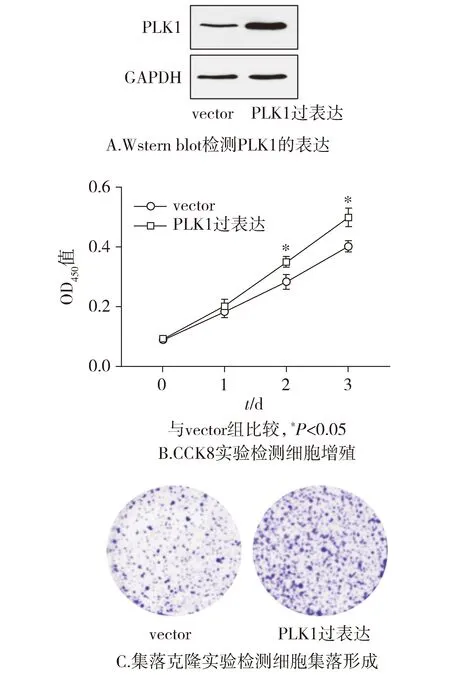
图5 子宫内膜癌AN3CA细胞中过表达PLK1后细胞的增殖Figure 5 Proliferation after PLK1 overexpression in endometrial cancer AN3CA cells
2.6 子宫内膜癌细胞AN3CA中过表达PLK1后Cdc25C的表达增加
同样对子宫内膜癌AN3CA细胞株转染含有PLK1的过表达质粒,培养48 h时提取蛋白进行Western blot实验。结果表明:PLK1过表达组中Cdc25C蛋白的表达较vector组明显增加,差异具有统计学意义(P<0.05)。这表明子宫内膜癌细胞AN3CA中过表达PLK1促进细胞的增殖的机制可能是通过促进Cdc25C的表达来实现的。
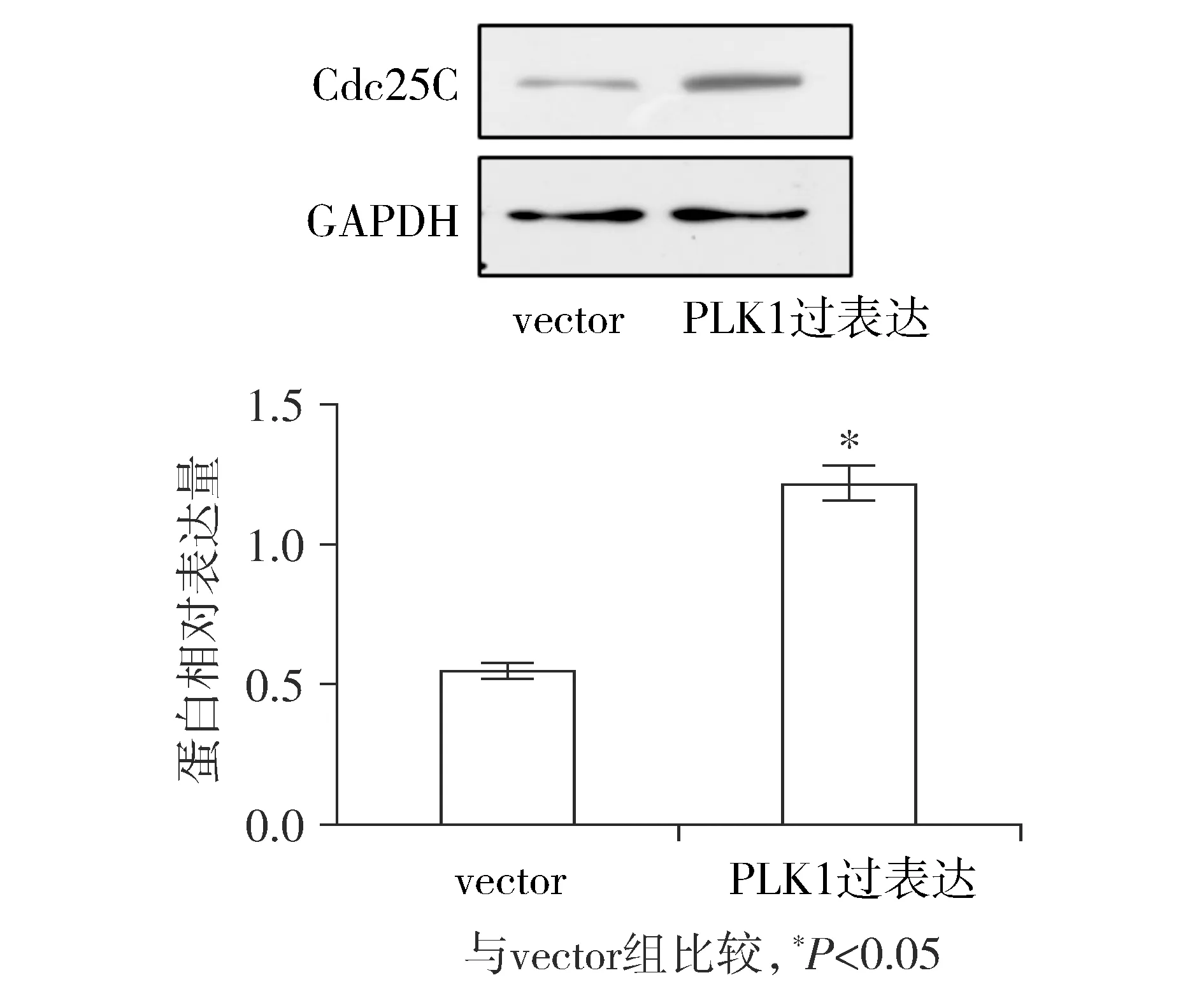
图6 Western blot检测子宫内膜癌细胞AN3CA中过表达PLK1后Cdc25C的表达变化Figure 6 The expression of Cdc25C after PLK1 overexpression in endometrial cancer AN3CA cells by Wes-tern blot
3 讨论
丝氨酸-苏氨酸激酶家族之一的PLK1在细胞有丝分裂过程中起着关键作用,它与纺锤体形成、中心体复制、染色体分离等多种有丝分裂有关[6-9]。大量研究发现,在食管癌、黑色素瘤、乳腺癌、结肠癌、肾细胞癌等多种实体瘤中PLK1的表达增加,这表明PLK1与肿瘤的发生密切相关[10-12]。研究发现将外源重组的PLK1基因转染进入正常的纤维细胞,正常细胞可通过此过程转变为恶性肿瘤,转变的细胞能够在裸鼠皮下成功种植,这表明PLK1能够直接导致细胞的恶性转变[7,13]。近来,研究指出,在肝癌和胰腺癌的早期肿瘤中PLK1即呈高表达状态[14]。研究表明,在肿瘤细胞增殖过程中,PLK1在细胞有丝分裂的G2期被中心体募集,而后协同相关因子在G2期活化并增加下游细胞周期相关蛋白cyclin B的表达促进肿瘤细胞的有丝分裂,细胞周期的相关蛋白高表达也促进正常细胞向恶性肿瘤细胞的转化[7,13,14]。
Cdc25C作为细胞周期调节蛋白,参与调解细胞的有丝分裂,并与其同源蛋白CDC25A和CCDC25B协同进入细胞分裂S期,并在G2/M期的转换中起重要作用[8,15]。研究表明棕矢车菊素、异泽兰黄素可通过激活细胞周期中的Chk2/Cdc25C/Cdc2通路来抑制肿瘤的增殖[16,17]。Gheghiani等[9]指出PLK1活化后可能通过抑制周期蛋白A和Cdc25C的表达来诱发细胞凋亡,从而有效地抵抗肿瘤增殖。
在进行了肿瘤标本的HE染色和免疫组织化学染色(IHC)对比后发现,PLK1在子宫内膜癌的肿瘤组织中的表达明显高于正常组织。基于此项结果,针对子宫内膜癌AN3CA细胞进行了PLK1表达的敲低,而后进行了CCK8实验和细胞集落克隆实验来观察细胞的增殖情况,结果显示在PLK1表达下调之后,AN3CA细胞的增殖被抑制。为了探索此现象的相关机制,对上述方法处理的细胞进行了Western blot实验,结果显示,细胞周期调节蛋白Cdc25C的表达降低,差异有统计学意义(见图4)。为了进一步验证Cdc25C的表达与PLK1被抑制相关,对AN3CA细胞进行了PLK1的过表达实验,实验结果显示在PLK1的表达上调时,过表达组细胞的增殖明显高于对照组;同时,Cdc25C的表达也呈增加趋势,差异有统计学意义(见图6)。实验表明,当PLK1的表达增加,细胞增殖也明显增加。多项实验结果表明抑制Cdc25C的表达可促进肿瘤细胞的凋亡[9,16,17],当PLK1过表达时Cdc25C的表达也增加,反之亦然。因此推测,PLK1对AN3CA细胞增殖的影响可能与细胞周期调节蛋白Cdc25C的表达有关。本研究的不足之处在于没有进行相应的动物实验验证,今后将对相应处理的细胞进行动物实验来进一步进行研究。
本研究结果表明,PLK1可促进子宫内膜癌AN3CA细胞的增殖,其机制可能与细胞周期调节蛋白Cdc25C的表达有关。本研究为子宫内膜癌的靶向治疗提供了一些思路和理论支持。
