纳米MnO2/MoS2 复合材料的制备及其电化学性能
2019-02-07传秀云李爱军程思雨
杨 扬,传秀云,李爱军,程思雨
(北京大学 地球与空间科学学院,造山带与地壳演化教育部重点实验室,北京 100871)
1 前 言
超级电容器具有功率密度高,能快速充放电,循环寿命长、绿色无污染等优点,作为一种新型储能装置,在备用电源和记忆候补装置、便携式电子设备、再生制动系统、工业电源和能源管理等领域具有广泛应用前景[1-3]。根据电荷储存机制,超级电容器分为双电层电容(EDLC)和赝电容。EDLC 通过离子电荷在电极表面的吸附储存能量;而赝电容通过活性材料(如过渡金属氧化物、导电聚合物等)表面发生的氧化还原反应实现能量储存与转换[4-5]。
MoS2是一种类似石墨烯的层状材料,因具有良好的力、热、光、电、催化等性能,在多个领域受到普遍关注。MoS2的内在离子电导率高于金属氧化物[6],且具有比石墨更高的理论比电容[7],另外,得益于其独特的夹层结构,十分有利于电解质中离子的扩散和转移,达到储存及释放电子的目的[8],作为超级电容器的电极材料前景十分广阔。研究表明,MoS2具有较好的电容特性[9],然而单一MoS2仍然存在诸多局限性。将MoS2与其它材料结合起来制成复合材料,通过优势互补获得更好的性能,是目前的研究热点。如MoS2与TiO2组合的一维纳米复合材料具有更高的光降解能力[10],MoS2/碳纤维电极表现出增强的催化活性和光电转换效率[11],以MoS2为基底,通过在表面负载聚合物制备的PPy/MoS2、PANI/MoS2等复合材料表现出比单一MoS2更高的比电容和循环稳定性[12-13]。MnO2是一种具有较高理论比容量(1370F·g-1)的活性材料,然而,其电导率低(10-5~10-6S·cm-1),离子扩散常数小,循环过程中结构不稳定,限制了其作为超级电容器电极材料的应用[14-15]。通过控制制备条件可以得到不同形貌的MoS2[16-17],其中花状形貌具有稳定的骨架结构,可以作为复合材料的支撑体。关于MoS2与Mn O2复合作为超级电容器电极材料的报道较少。因此,本研究以花状MoS2为骨架结构,利用简便的液相沉积的方法制备了Mn O2/MoS2复合材料,并对样品的组成、形貌和电化学性能进行研究,为二硫化钼基复合材料的开发提供基础数据和理论指导。与单一电极材料相比,Mn O2/MoS2复合材料的电化学性能得到明显提高,是一种良好的超级电容器电极材料。
2 实 验
2.1 实验材料和方法
钼酸钠(Na2Mo O4·2 H2O)、硫脲(H2NCSNH2)、高锰酸钾(KMn O4)、硫酸锰(MnSO4)、硫酸钠(Na2SO4),所用试剂均为分析纯。
将一定比例的钼酸钠和硫脲(摩尔比为1∶5)依次溶解到70m L 去离子水中,充分搅拌,然后转移到100m L反应釜中200℃水热反应24h。反应完成后,将产物通过过滤收集,用去离子水和乙醇多次洗涤,并在60℃下24h真空干燥,得到纯的MoS2。
称取一定量的硫酸锰和高锰酸钾(摩尔比3∶1),分别溶解到20m L去离子水中,将一定量制备的MoS2加入硫酸锰溶液中,超声分散后快速搅拌,逐滴加入高锰酸钾溶液,搅拌6 h使其充分反应。过滤,洗涤,干燥得到Mn O2/MoS2复合材料。在同样的反应条件下不加入MoS2得到纯Mn O2。
2.2 测试及表征
采用X 射线衍射仪(Rigaku D/max2400)分析物相,入射光CuKα(λ=0.15406nm),扫描范围5~70°,扫描速度4°/min;利用热重-差热同步测定仪(Q600 SDT)对样品进行热重分析,升温速率10℃/min,温度范围50~1000℃,氮气气氛;通过扫描电镜(Nova Nano SEM 430)观察样品形貌,加速电压15k V,束流176μA;采用氮气吸附-脱附测试仪(ASAP2010)测试样品的N2吸附-脱附性能,测试前在150℃脱气6h,测试温度-196℃;用多点式BET 法测定比表面积,利用非定域密度泛函理论测定孔径分布[18]。
采用电化学工作站(CHI660E)对材料进行电化学性能测试。将制备的试样、乙炔黑和聚四氟乙烯(PTFE)(60wt.%)按质量比8.5∶1∶0.5混合,滴入适量无水乙醇制备成浆料,均匀地涂覆到泡沫镍集流体上,约1cm2,使用油压机压制成电极片(5MPa),80℃真空干燥12h,制得电极片。测试过程中,以铂片为对电极、Ag/AgCl电极为参比电极,1mol/L Na2SO4水溶液为电解液,测试项目包括循环伏安扫描(-0.1~-0.9V)、恒电流充放电(-0.1~-0.9V)、电化学阻抗(1~105Hz)。根据恒流充放电曲线,材料的单电极质量比电容C(F·g-1)按下面公式计算:

式中,I为放电电流(A),Δt为放电时间(s),m为活性物质质量(g),ΔU为Δt时间内的电压变化(V)。
3 结果与讨论
3.1 MnO2/MoS2 复合材料的组成和结构
图1为纯MnO2、MoS2和Mn O2/MoS2的X 射线衍射谱图。Mn O2在21°、37°、42°、56°和67°附近出现衍射峰,这些峰均属于γ-Mn O2[19]的特征峰(JCPDS No.14-0644),分别对应其(120)、(131)、(300)、(160)和(003)晶面。MoS2的衍射峰与其标准衍射峰(JCPDS No.37-1492)相吻合且无其他杂峰,证明制备的产物是较为纯净的2H-MoS2,衍射峰峰位显著,说明所合成产物结晶度较高,其中(002)和(100)晶面对应的峰强最为显著,说明层与层之间堆垛良好。Mn O2/MoS2复合材料中除MoS2的衍射峰外,还出现较明显的Mn O2的(131)和(003)峰,同时保持了Mn O2和MoS2的衍射峰,说明复合材料中Mn O2和MoS2分别保持着自己的晶型结构。
图2为纯MoS2(a)与Mn O2/MoS2复合材料(b)的热重曲线,热重曲线a主要分为三个阶段:第一阶段为200℃之前,热失重为材料表面吸附的物理结合水以及化学结合水的脱除[20];第二阶段为200~450℃,热失重与MoS2片层间水的脱出有关[13];450℃之后MoS2几乎不发生变化。热重曲线b主要分为四个阶段,前两个阶段与a相同,第三阶段为500~700℃,这一阶段主要发生的变化为Mn O2脱除一部分氧后生成Mn2O3,如式(2)所示;第四阶段为700~900℃,这一阶段中Mn2O3进一步脱除氧生成Mn3O4,反应方程式见式(3)[21]。根据Mn O2分解过程的热失重可以推算出复合材料中MoS2的含量约为54.3%。
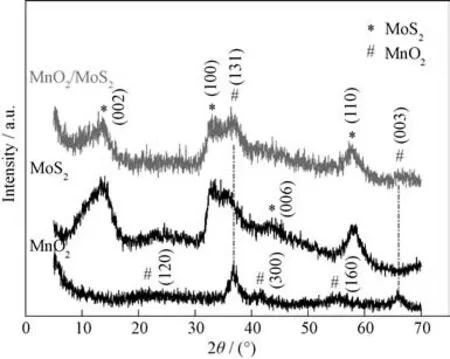
图1 Mn O2,MoS2 和Mn O2/MoS2 的XRD图谱Fig.1 XRD patterns of Mn O2,MoS2 and Mn O2/MoS2 composites


图2 MoS2(a),MnO2/MoS2(b)的热重曲线Fig.2 TG curves of(a)pure MoS2 and(b)Mn O2/MoS2 composites
图3显示了单一Mn O2、MoS2和Mn O2/MoS2复合材料的微观形貌。Mn O2呈均匀分散的球状,平均粒径为100~200nm(图3(a))。MoS2呈大小均一的花瓣状球形结构,平均球径约500nm,有一定的团聚现象;每个花瓣微球都是由许多MoS2纳米片蜷曲堆叠自组装而成(图3(b)),这是由于MoS2纳米片边缘悬挂了很多不饱和键,能量较高,为降低表面能,纳米片会自动弯曲蜷缩成球花状[22]。Mn O2/MoS2复合材料保持了MoS2的球花状结构,大量Mn O2纳米颗粒在球花状MoS2内部沉积生长,由于生长过程受到MoS2花状形貌的影响,颗粒尺寸明显减小,呈絮状填充(图3(c)、(d)),放大观察可见MnO2纳米颗粒主要附着在MoS2片层表面(图3(e))和沉积在层间(图3(f)),相互堆叠成孔,使得比表面积增大,空隙增多。对复合样品进行能谱分析(图3(g)),结果显示除S、Mo外,还含有Mn、O、K 三种元素,结合XRD 和热重分析结果,可以判断MoS2表面纳米颗粒为MnO2。K元素存在于Mn O2的晶格中[23]。对复合材料中图3d所示区域进行能谱面分布扫描,Mo、S两种元素的分布分别对应图3(h)和图3(i)。从图可见,两种元素具有相同的分布,且分布区域与纳米片的生长区域基本一致,这与前述纳米片为MoS2的论断相印证。
利用N2吸附法测试负载Mn O2前后材料的比表面积和孔径分布的变化。图4 为MoS2和Mn O2/MoS2的氮气吸附-脱附等温线,两种材料均属于Ⅳ型吸附等温线,在较低相对压力下,吸附等温线斜率较小,上升缓慢,表明有少量微孔存在。在较高相对压力下等温线上升较快,且在接近1时有一定的拖尾,说明两种材料中毛细凝聚现象较严重,有较大孔径的中大孔存在。两种材料的孔结构信息列于表1,MoS2的比表面积和孔容分别为9.7m2·g-1和0.0312cm3·g-1,其孔结构主要来源于MoS2纳米片蜷曲堆叠形成的裂隙孔[24];Mn O2/MoS2的比表面积和孔容分别达到119.4m2·g-1和0.342cm3·g-1,相对于MoS2增大了10倍以上,中孔率也由66.7%增大到88.8%,微孔率减小,说明MnO2附着在MoS2片层表面和充填在层间,不仅增大了材料的比表面积,而且相互堆叠形成了新的孔道结构,主要为中孔。这样不仅有利于电解质离子和电子的扩散,增大材料的比电容,而且有利于电解液渗透到材料内部,从而减小电荷转移电阻。
3.2 MnO2/MoS2 复合材料的电化学性能测试
图5(a)为MnO2/MoS2复合材料在不同扫描速率下的循环伏安曲线,CV曲线接近矩形,关于零电流基线基本对称,随着扫描速率增大曲线变形较小,表现出较好的双电层电容行为;扫速减慢时,CV曲线中还可以看到微小的氧化还原峰。图5(b)显示了20m V/s扫描速率下纯MoS2和Mn O2/MoS2复合材料的CV 曲线,可以看出,MoS2电极表现出典型的双电层电容特性,没有出现任何氧化还原峰,负载Mn O2后,复合材料在-0.2~-0.6V 处有微弱的氧化还原峰出现,表现出赝电容的特征。从曲线面积来看,复合材料的面
积大于纯MoS2的面积,说明在相同的扫描速率下,复合材料的比电容得到显著提高。

图3 (a)Mn O2,(b)MoS2,(c-f)Mn O2/MoS2 的SEM 照片,Mn O2/MoS2 的(g)能谱图及(h-i)面分布扫描Fig.3 SEM images of(a)Mn O2,(b)MoS2,(c-f)Mn O2/MoS2,and(g)EDS and(h-i)element distribution scanning of Mn O2/MoS2

图4 (a)MoS2,(b)MnO2/MoS2 的氮气吸附-脱附等温线Fig.4 Nitrogen adsorption/desorption isotherms of(a)MoS2 and(b)Mn O2/MoS2

表1 样品的孔结构信息Table 1 Pore parameters of samples
图5(c)显示了在各个电流密度下复合材料的充放电曲线,曲线近似三角形,具有良好的线性,且对称性良好,充放电时间基本一致,无明显电压降。根据公式(1)可以计算出样品在0.3、0.5、1、2、5A·g-1时,比电容分别为265.7、234.2、187.0、139.8、105.9F·g-1,随着电流密度增大,电极材料的比电容减小,这是由于在低电流密度下,电解液中的离子能更加充分地进入电极内部并在其中移动,提高了电极的利用率,随着电流密度增大,充放电只能够在部分电极表面进行,来不及充分充放电导致活性物质利用率降低,引起比电容的下降。图5(d)显示了MoS2和Mn O2/MoS2电极在不同电流密度下的比电容,相对于单一MoS2,负载Mn O2后复合材料的比电容明显增大,与循环伏安测试结果一致。分析认为,Mn O2不仅增大了材料的比表面积和中孔孔容,有利于电解质离子和电子的运移和扩散,还提供了一定的赝电容,增大了电子储存量,使得材料同时具备双电层电容和法拉第电容,导致比电容的增加。
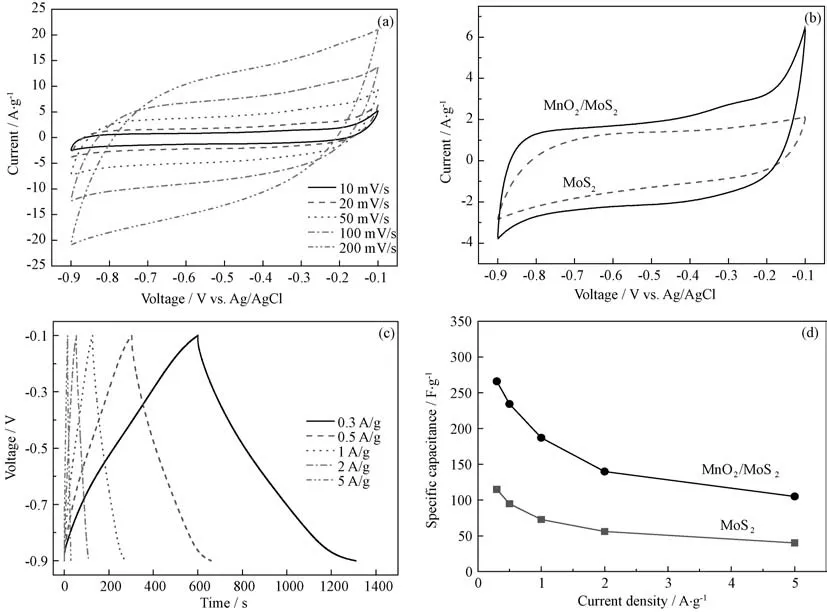
图5 (a)Mn O2/MoS2 的循环伏安图;(b)MnO2/MoS2 和MoS2 在20m V/s时的循环伏安图;(c)Mn O2/MoS2 的恒电流充放电图;(d)不同电流密度下Mn O2/MoS2 和MoS2 的比电容Fig.5 (a)Cyclic voltammograms of Mn O2/MoS2;(b)Cyclic voltammograms of Mn O2/MoS2 and MoS2 at 20m V/s;(c)Galvanostatic charge/discharge curves of Mn O2/MoS2;(d)Specific capacitance of Mn O2/MoS2 and MoS2 at different current densities

图6 Mn O2,MoS2 和Mn O2/MoS2 的Nyquist曲线图Fig.6 Nyquist plot of Mn O2,MoS2 and Mn O2/MoS2
图6是纯Mn O2、MoS2和Mn O2/MoS2复合材料交流阻抗的Nyquist曲线及其等效电路图。Nyquist曲线高频区出现的半圆弧能体现活性材料与电解液的界面电荷转移电阻,反映材料在充放电时电荷转移的难易程度,半圆直径越小,则界面转移电阻越小,表明材料的导电性能越好。低频区阻抗曲线为一条具有一定斜率的直线,表明存在由质子扩散引起的Warburg阻抗[25]。等效电路图中,Rs和Rct分别代表溶液电阻和界面电荷转移电阻,Zw为Warburg阻抗,CPE 为双电层电容。比较各电极材料的半圆直径,经拟合计算Mn O2/MoS2的Rct约为1.64Ω,比单一MoS2略大(约1.02Ω),但相对于单一Mn O2(约4.78Ω),复合材料则具有更低的电阻。分析认为复合材料较大的比表面积有利于减小离子和电子在充放电过程中转移和扩散时间;同时,MoS2较高的结晶性也有利于电子在材料内部有序移动,降低电子的损失,从而提高材料的导电性。
图7显示了复合材料和单一电极材料的循环稳定性,充放电1000 次后(1A·g-1电流密度),Mn O2和MoS2的电容保持率分别为78.2%、82.8%,而Mn O2/MoS2达92.3%,表现出较好的循环稳定性,说明Mn O2和MoS2复合对提高材料的循环稳定性能起了很大作用。一方面,三维花状MoS2为材料提供了骨架结构,缓解了MnO2在充放电过程中的结构坍塌和体积变化,另一方面,MoS2片层表面和层间的Mn O2能够防止充放电过程中花状MoS2的变形,使其具有良好的机械强度。

图7 Mn O2,MoS2 和Mn O2/MoS2 的循环性能Fig.7 Cycle performance of Mn O2,MoS2 and MnO2/MoS2
由以上分析可知,Mn O2/MoS2复合材料具有较大的比电容和较好的循环稳定性,这可能得益于复合材料独特的结构特征。Mn O2附着在MoS2片层表面和充填在层间,MoS2不仅为材料提供了稳定的骨架结构,缓解了MnO2在充放电过程中结构坍塌和体积变化,还提高了材料的电导率;同时,MnO2增大了材料的比表面积和孔容,并提供了一定的赝电容,从而保证了复合材料优良的电化学性能。
4 结 论
以花状MoS2为骨架结构,利用简便的液相沉积法成功地制备了MnO2/MoS2复合材料,该复合物继承了MoS2的球花状形貌,纳米颗粒状MnO2沉积在MoS2片层表面和充填于层间,极大地增大了材料的比表面积和孔容。经电化学性能测试发现,电流密度为0.3A·g-1时Mn O2/MoS2复合材料比电容量为265.7F·g-1,循环1000次后电容保持率达92.3%,具有比单一MoS2更大的比电容和更好的循环稳定性;EIS测试得到复合材料Rct约为1.64Ω,远小于单一Mn O2的界面转移电阻,具有较高的电导率,说明制备的Mn O2/MoS2复合材料具有较好的电化学性能。
