热解吸-电晕放电电离-离子迁移谱法现场快速筛查化妆品中5种禁用组分
2019-01-29郭项雨翟俊峰马龙华
郭项雨, 翟俊峰, 马龙华, 吴 青, 白 桦*, 马 强*
(1. 中国检验检疫科学研究院, 北京 100176; 2. Excellims Corporation, Acton, MA 01720, USA)
随着社会经济的持续发展和人们生活水平的不断提高,化妆品不仅是人们日常生活的必需品,也已成为美化生活的一种时尚产品,受到广大消费者的青睐。对化妆品的巨大需求,又极大地促进了化妆品产业的飞速发展和市场的空前繁荣。2017年,我国的化妆品销售额已达434亿欧元,仅次于欧盟和美国,是全球第三大化妆品消费市场[1]。面对化妆品行业的高速发展和化妆品需求量的与日俱增,化妆品的产品质量和安全性越来越受到广大消费者的关注和重视。化妆品在使用过程中,会持续驻留人体皮肤表面,以发挥其美白、抗皱、祛痘等功效,化妆品中可能含有的化学风险物质会通过皮肤接触吸收,进而危害人体健康安全。为确保化妆品质量安全,广泛开发建立化妆品管控危害物质的检测方法尤为重要。
利多卡因、氯普鲁卡因、丁卡因、普莫卡因、辛可卡因等卡因类物质在医学领域主要作为局部麻醉剂,可能添加于晒后修复、祛斑、祛痘、脱毛、去角质层等化妆品中,以达到减轻人体肌肤疼痛或不适的作用,并且具有抗皱/抗衰老作用。但此类化学物质具有中枢神经毒性和心血管毒性,可经皮肤表面吸收进入血液循环,对人体健康造成危害[2]。因此,我国《化妆品安全技术规范》(2015年版)[3]及欧盟化妆品法规[4]将上述卡因类物质列为化妆品中禁用组分,相关部门也制定和发布了化妆品中卡因类物质检测的方法标准[3,5]。
目前,利多卡因、丁卡因、普莫卡因等卡因类化合物的测定方法包括高效液相色谱法[6-8]、高效液相色谱-质谱法[9]、气相色谱-质谱法[10,11]、电化学法[12]等,涉及的样品包括注射液、药膏、血液、胃液、生物组织等。上述方法各有特点,但大多需要对样品进行较为复杂的前处理过程,如溶解、提取、离心、浓缩、过滤等,然后经过色谱分离后测定。整个分析过程试剂消耗量大、分析周期长、时间成本高。另外,部分方法还需要依托大型质谱仪器进行定性定量分析,这些设备通常体积大、质量重、机动性差,不能实现对样品的现场检测分析。上述传统前处理步骤及实验室分析仪器虽然具有较好的灵敏度和准确性,但无法满足与日俱增的现场快速筛查需求。
离子迁移谱(ion mobility spectrometry, IMS)是基于气相中不同的气相离子在电场中迁移速度的差异来对化学物质进行表征的一项分析技术,具有设备质量轻、体积小、操作简便、快速灵敏等优点,是现场快速分析检测的有力工具,目前已广泛应用在车站、机场、口岸等区域,涉及毒品检测[13,14]、爆炸物分析[15]、食品安全[16-18]、环境监测[19]等诸多领域。热解吸离子化(thermal desorption ionization)技术无需任何样品前处理,无需萃取溶剂,对样品加热、吹扫、离子化一步完成,具有检测成本低、分析速度快、绿色环保等优势,也越来越受到检测分析工作者的关注,并在爆炸物排查[20,21]、毒品检测[22,23]等领域发挥了重要作用。在离子迁移谱分析中,首先要生成气相离子,然后才能进行产物离子的分离和检测。现有的电离源包括放射源、光致放电管、激光电离、电喷雾电离、火焰电离、电晕电离等[24]。本文采用热解吸-电晕放电电离技术,结合离子迁移谱,建立了化妆品中5种禁用卡因类化合物的现场快速筛查方法,疑似阳性样品采用高效液相色谱-串联质谱法进一步确证,为确保化妆品质量安全和消费者健康安全提供了科学有效的技术手段。
1 实验部分
1.1 仪器与试剂
GA2100型便携式离子迁移谱仪(美国Excellims公司):配有热解吸-电晕放电离子源、离子栅门控制器、空气过滤装置(含硫酸钙和分子筛)、高分辨率离子迁移分析器、法拉第杯检测器、VisIon仪器控制与数据处理系统,使用前用色氨酸和柠檬酸分别在正、负离子模式下校正仪器;ACQUITY超高效液相色谱仪、Xevo TQ-MS三重四极杆质谱仪、MassLynx数据处理系统(美国Waters公司); Milli-Q Integral 5型超纯水器(美国Merck Millipore公司)。丁卡因(CAS 94-24-6,纯度99.9%)购自德国Dr. Ehrenstorfer公司;利多卡因(CAS 137-58-6,纯度99%)购自百灵威科技有限公司;辛可卡因盐酸盐(CAS 85-79-0,纯度99%)、普莫卡因盐酸盐(CAS 637-58-1,纯度99%)和氯普鲁卡因盐酸盐(CAS 3858-89-7,纯度99.8%)购自美国Stanford Chemicals公司。5种卡因类禁用物质用甲醇配制成1 g/L标准储备液,使用时根据需要用甲醇稀释成混合标准工作液;甲醇(色谱纯)购自美国Fisher公司;色氨酸和柠檬酸购自美国Sigma-Aldrich公司,以甲醇配成10 mg/L校正液进行仪器校正;CT1319型玻璃纤维拭纸购自美国DSA Detection公司;Nomex纤维拭纸购自美国DuPont公司;Grade 1、Grade 3MM、Grade 17、Grade 31ET纤维素色谱纸购自美国Whatman公司。
1.2 实验方法
热解吸离子源由解吸加热器、样品槽、样品传输管、电晕腔、电晕针、解吸气和电晕吹扫气构成。化妆品样品无需前处理步骤,样品轻轻蘸取(膏霜类化妆品)、滴加(液体类化妆品)或喷雾(喷雾类化妆品)在采样拭纸上,静置30 s,待样品中可能含有的乙醇等溶剂挥发后置于离子源样品槽中,在加热器和解吸气的共同作用下,样品中待测组分热解吸并通过样品传输管进入电晕腔,在电晕针高压作用下发生离子化,并在电晕吹扫气和电场作用下进入离子迁移谱的迁移管内进行分离后,经法拉第杯检测器检测得到相应测试图谱。实验流程如图1所示。对于基质复杂的样品,为避免样品槽污染,应定期清洁,可设置热解吸离子源解吸温度至250 ℃,解吸时间5~10 min即可达到清洁效果。

图 1 热解吸-电晕放电电离-离子迁移谱实验流程Fig. 1 Work flow for thermal desorption-corona discharge ionization coupled with ion mobility spectrometry
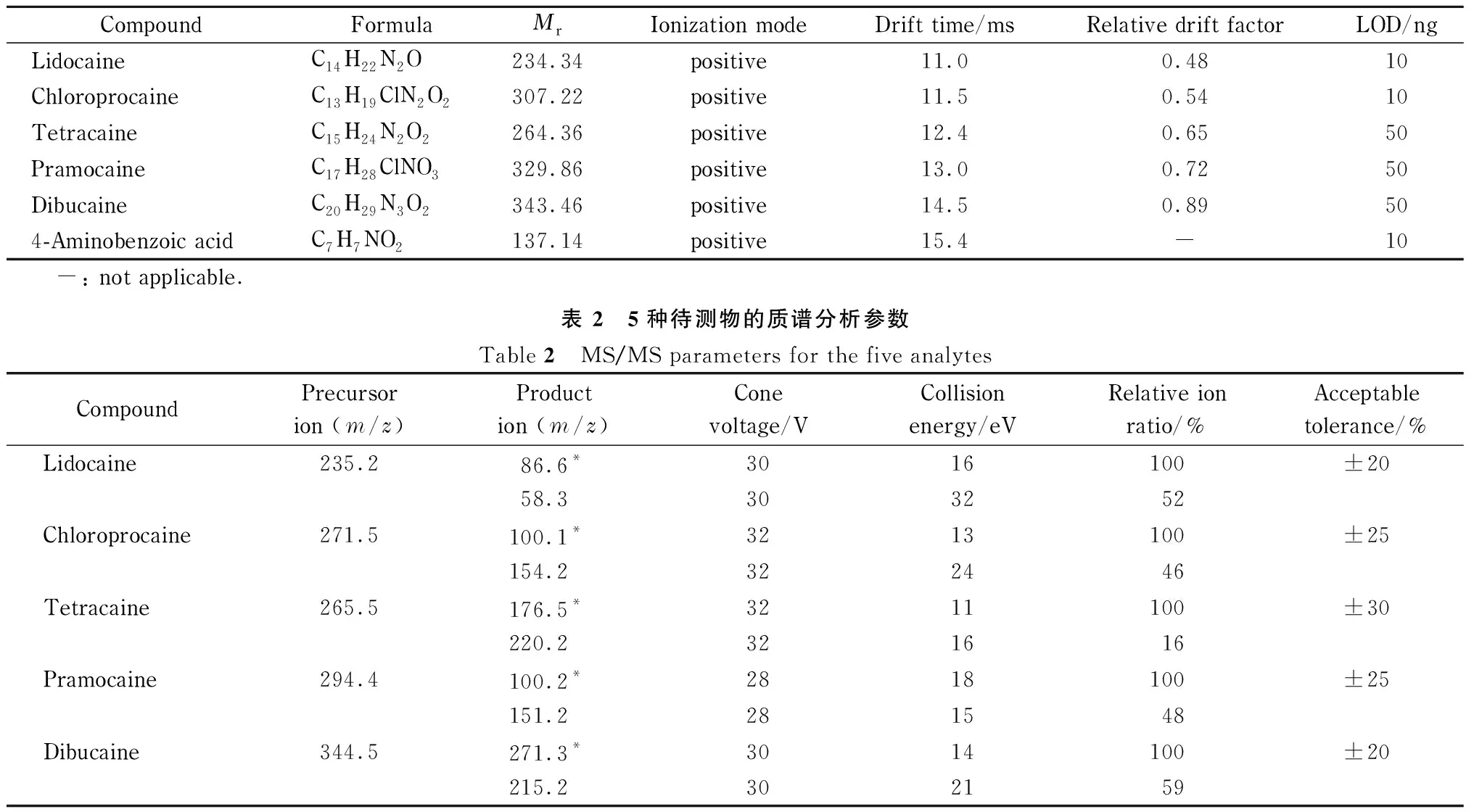
CompoundFormulaMrIonization modeDrift time/msRelative drift factorLOD/ngLidocaineC14H22N2O234.34positive11.00.4810ChloroprocaineC13H19ClN2O2307.22positive11.50.5410TetracaineC15H24N2O2264.36positive12.40.6550PramocaineC17H28ClNO3329.86positive13.00.7250DibucaineC20H29N3O2343.46positive14.50.89504-Aminobenzoic acidC7H7NO2137.14positive15.4-10-: not applicable.表 2 5种待测物的质谱分析参数Table 2 MS/MS parameters for the five analytesCompoundPrecursor ion (m/z)Product ion (m/z)Cone voltage/VCollision energy/eVRelative ion ratio/%Acceptable tolerance/%Lidocaine235.286.6*3016100±2058.3303252Chloroprocaine271.5100.1*3213100±25154.2322446Tetracaine265.5176.5*3211100±30220.2321616Pramocaine294.4100.2*2818100±25151.2281548Dibucaine344.5271.3*3014100±20215.2302159
* Ions with higher responses.
1.3 离子迁移谱分析条件
热解吸-电晕放电离子化条件如下。解吸温度:210 ℃;解吸气种类:空气;解吸气流速:0.5 L/min;解吸时间:15 s;电晕放电模式:正离子模式;电晕放电电压:2 143 V;电晕吹扫气种类:空气;电晕吹扫气流速:0.5 L/min;电晕吹扫气抽速:0.4 L/min。
离子迁移谱条件如下。迁移管电压:8 000 V;迁移管温度:180 ℃;气体预加热温度:180 ℃;迁移谱宽:20 ms; Bradbury-Nielsen离子门脉冲宽度:75 μs; Bradbury-Nielsen离子门电压:37 V;漂移气流速:1.80 L/min;排气泵抽速:1.30 L/min。为校正迁移时间可能产生的漂移对分析结果的影响,本研究选用4-氨基苯甲酸作为参比物质,用于计算待测卡因类化合物的相对迁移因子。5种待测物及参比物质的分子式、相对分子质量、离子化方式、迁移时间和相对迁移因子见表1。
1.4 高效液相色谱-串联质谱确证条件
Waters XBridge C18色谱柱(150 mm×2.1 mm, 3.5 μm);流动相:水(A)和甲醇(B)。梯度洗脱程序:0~12 min, 35%B~90%B; 12~18 min, 90%B。流速:0. 3 mL/min;柱温:30 ℃;样品室温度:20 ℃;进样量:5 μL。
5种卡因类化合物的质谱分析参数见表2,其判断依据主要参照欧盟指令2002/657/EC[25]中关于质谱分析方法定性的规定。电喷雾离子源;毛细管电压:3.0 kV;射频透镜电压:0.3 kV;离子源温度:150 ℃;去溶剂气温度:450 ℃;去溶剂气流量:800 L/h;锥孔气流量:50 L/h;光电倍增器电压:650 V;碰撞气体:氩气;碰撞室气压:0.32 Pa;多反应监测(MRM)模式检测。

图 2 不同拭纸对5种待测物的归一化响应值(n=6)Fig. 2 Normalized intensity of the five analytes with different sampling swabs (n=6)
2 结果与讨论
2.1 采样拭纸的选择
采样拭纸的选择对样品的采集和待测物的解吸具有重要影响。由于不同拭纸表面及内部含有的羟基数量不同,5种卡因类化合物的性质又存在差异,因此不同拭纸与化合物的结合程度存在差异,解吸效果随之不同。为确保上样量的准确统一,将10 μL质量浓度为50 mg/L的标准混合溶液滴加在不同的采样拭纸上,静置30 s,在仪器条件一致的情况下,以总响应强度为考察指标,比较CT1319型玻璃纤维拭纸、Nomex纤维拭纸以及Grade 1、Grade 3MM、Grade 17、Grade 31ET纤维素色谱纸等6种采样拭纸对5种待测卡因类化合物的分析效果,实验数据经归一化处理,结果如图2所示。采用Nomex纤维拭纸对于待测物的信号响应值最高,推测可能是由于Nomex纤维拭纸对待测物吸附性较强,并且在热解吸过程中又具有较好的解吸附效果。Grade 1、Grade 17、Grade 3MM和Grade 31ET纤维素色谱纸的表面及纸基内部均含有较多的羟基,加载样品后,对样品中待测物形成氢键等分子间作用力,在热解吸过程中不能将待测物完全解吸附,故响应值略低。CT1319型玻璃纤维拭纸响应值最低,这可能是由于基质材料对样品吸附性差,导致样品加载量较少。
2.2 解吸温度的优化
解吸温度对目标分析物的解吸附程度及响应值有着显著影响。解吸温度过低时,样品中待测物不能从拭纸上完全解吸;解吸温度过高时,样品原本较难挥发的杂质会随着解吸温度的升高解吸出来,在电晕腔内与目标物质发生电荷竞争作用,并且离子化后进入迁移管中,有可能形成较强的基质干扰,影响目标化合物的分析检测。本研究在180~250 ℃范围内设定了一系列解吸温度。经考察,在1.3节下,当解吸温度为210 ℃时,5种卡因类待测化合物的响应值均接近最大值(见图3)。
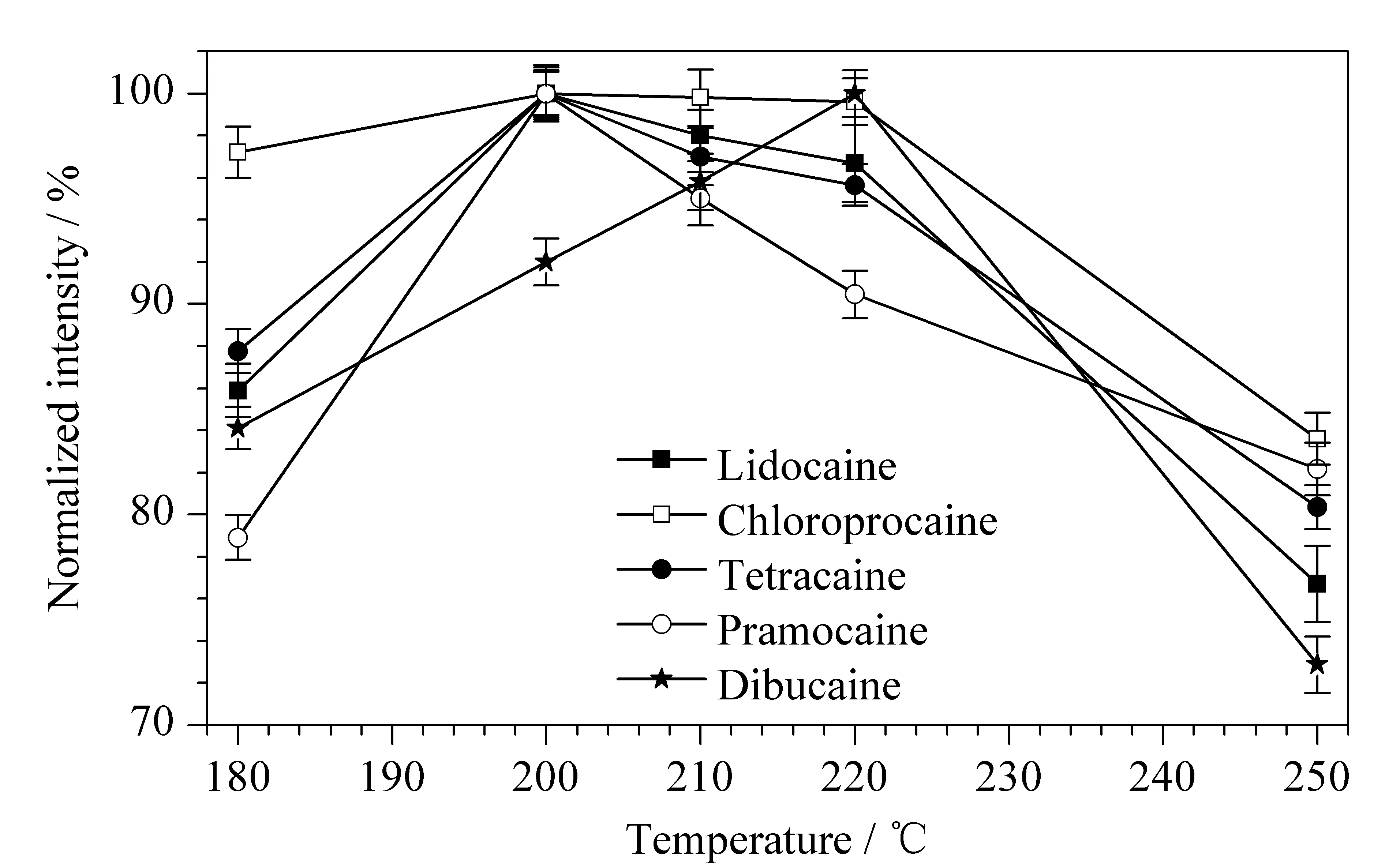
图 3 不同解吸温度下5种待测物的信号响应(n=6)Fig. 3 Signal responses of the five analytes at various desorption temperatures (n=6)
2.3 电晕放电电压的优化
电晕放电电压是决定目标化合物离子化效果及信号响应强度的重要参数。在热解吸-电晕放电电离过程中,待测物经加热后从拭纸上解吸,以气态分子形式进入电晕腔,在电晕针高压的作用下发生分子离子反应,形成离子进入离子迁移谱。5种卡因类化合物的最佳电晕放电电压略有差异,综合5种待测化合物各自的最佳电压值及离子化效果,确定本方法的电晕放电电压为2 143 V。
2.4 迁移管和气体预加热温度的优化
在离子迁移谱进样分析时,为了避免热交换或其他因素导致的离子迁移时间重现性差、响应值不稳定等现象,气体预加热温度和迁移管温度的设定应尽量保持一致。如设定温度过低时,空气湿度和环境温度会对离子信号造成干扰;温度过高会造成离子迁移系统不稳定,引发的离子扩散及碰撞损失,反而导致信号减弱。本研究考察了不同温度(170、180、190、200 ℃)对待测化合物响应值的影响,最终确定迁移管和气体预加热温度为180 ℃(见图4)。
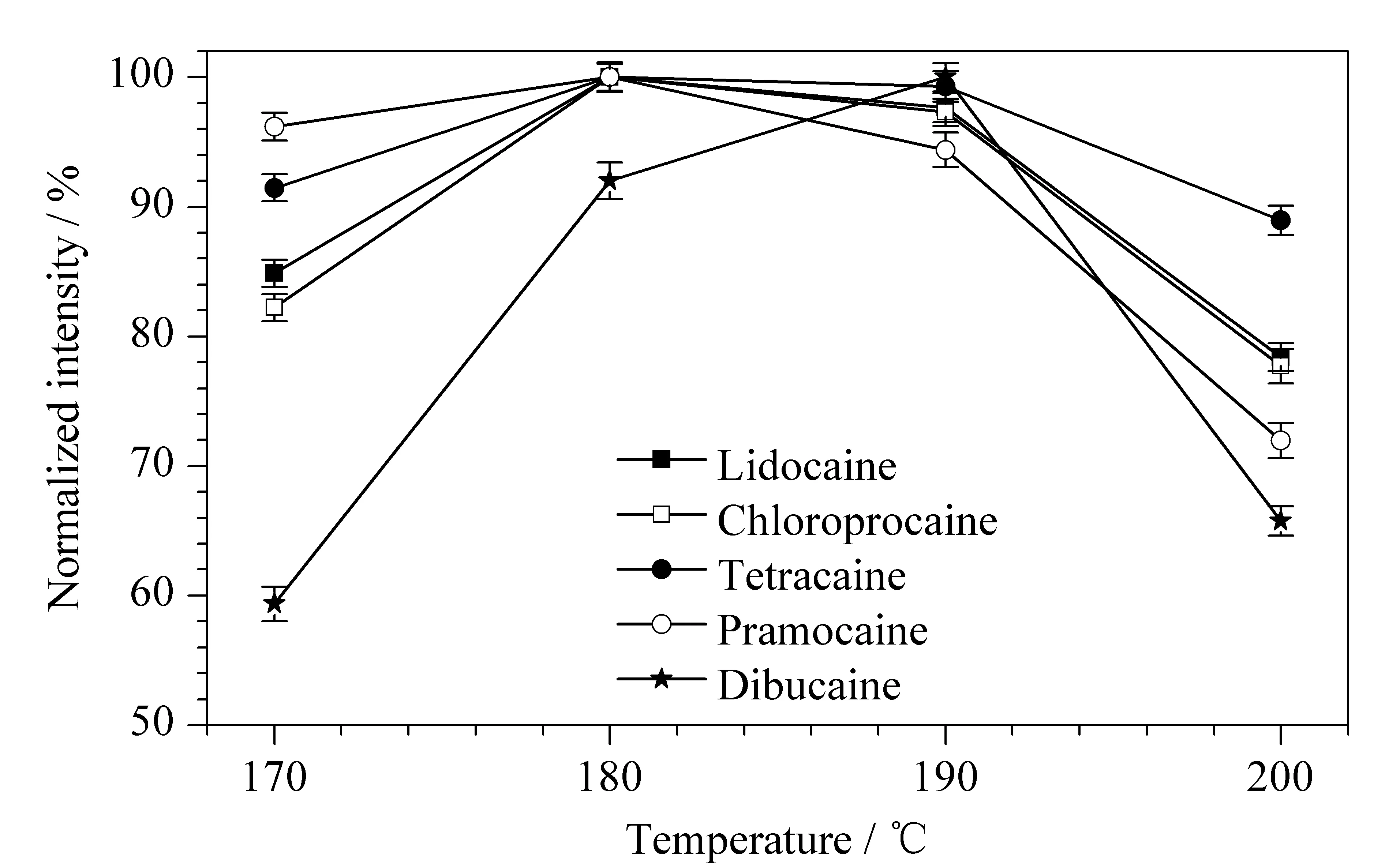
图 4 不同迁移管及气体预加热温度下5种待测物的 信号响应(n=6)Fig. 4 Signal responses of the five analytes at various drift tube and gas pre-heating temperatures (n=6)
2.5 漂移气流速的优化
漂移气的流速对离子分辨率和响应强度存在一定影响。基于前期研究经验[26-28],空气稳定性强、成本低廉,并且作为漂移气能较好地分离各组分,响应强度高。同时选用空气作为漂移气,无需为离子迁移谱仪额外配备气体钢瓶,有助于实现现场快速检测。本研究考察了不同漂移气流速(1.4~2.2 L/min)对5种卡因类化合物分离效果和响应强度的影响。实验结果表明,当漂移气流速过低时,5种卡因类化合物分析周期短,分辨率较差;而流速太高时,分辨率提高,分析周期长,同时会稀释目标气体分子浓度,甚至抵消电场力的作用,使目标离子不能到达检测器,没有响应信号。经考察,漂移气的最佳流速为1.8 L/min(见图5)。

图 5 不同漂移气流速下5种待测物的信号响应(n=6)Fig. 5 Signal responses of the five analytes at various drift gas velocities (n=6)
2.6 定性依据和检出限
本文所述5种卡因类化合物为化妆品中禁用组分,在实际样品检测中,重点需要开展定性筛查分析,以确定产品是否符合法规要求。离子迁移谱以迁移时间作为主要定性依据,为消除迁移时间可能发生的漂移对定性判别结果造成的干扰,保证方法准确可靠,本研究引入4-氨基苯甲酸作为参比物质,以相对迁移因子作为目标化合物的定性依据。按照前文所述方法进行分析测定,以信噪比为3测算,5种卡因类化合物的检出限在10~50 ng之间。5种卡因类化合物及参比物质的离子迁移谱图见图6。

图 6 5种待测物及参比物质的离子迁移谱图Fig. 6 Ion mobility spectra of the five analytes and reference substance
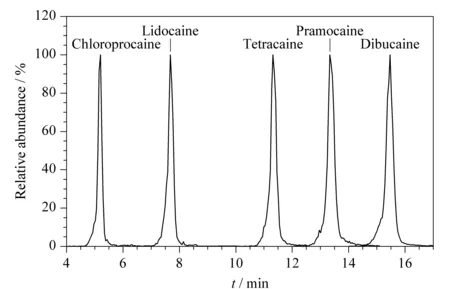
图 7 5种待测物的选择离子监测色谱图Fig. 7 MRM chromatograms of the five analytes
2.7 高效液相色谱-串联质谱确证
对于经离子迁移谱法筛检出的疑似阳性样品,本研究还开发了进一步确证的高效液相色谱-串联质谱方法。每种目标化合物分别选择一个前体离子和对应的两个产物离子作为监测离子对。5种卡因类化合物的质谱分析参数见表2。如果样品中目标化合物的离子相对丰度与浓度相当的标准溶液的相对丰度一致,且偏差不超过表2中对应的允许偏差,则判断样品中含有相应的禁用卡因类化合物。5种卡因类化合物的选择离子监测色谱图见图7。
2.8 样品筛查
应用本方法对不同类型的共16件化妆品实际样品进行了筛查分析,均未检测到上述5种卡因类化合物。为进一步验证本方法的适用性,以1种含有利多卡因的气雾剂外用非处方药剂作为待测样品进行了分析检测。结果表明,离子迁移谱筛检出了样品中含有的利多卡因成分。进一步经高效液相色谱-串联质谱确证,验证了实际样品中存在利多卡因。
3 结论
本研究采用热解吸-电晕放电电离技术,结合离子迁移谱,开发建立了化妆品中5种禁用卡因类化合物的现场快速筛查方法。该方法准确可靠、快速简捷、成本低廉,无需任何样品前处理过程,离子迁移谱分析时间小于20 ms,整个样品分析周期不超过1 min,可用于化妆品实际样品的现场快速和高通量筛查检测。
