注射用灯盏花素对脂多糖致巨噬细胞炎症损伤的抑制作用
2019-01-29齐睿娟孙桂波费巧玲韩宜芯
齐睿娟,孙桂波,侯 睿,高 源,费巧玲,韩宜芯,周 鸿,齐 云
(1.中国医学科学院北京协和医学院药用植物研究所,北京 100193;2.中国中医科学研究院西苑医院老年病中心,北京 100091)
灯盏花素(breviscapine,BS)是从菊科植物短葶飞蓬〔Erigeron breviscapus(Vant.)Hand.-Mazz.〕干燥全草中提取出的黄酮类成分,其中含量最高的是灯盏乙素。由于其在治疗心脑血管疾病方面有确切的疗效,已被开发为片剂、颗粒剂、注射剂和注射粉针剂等多种剂型应用于临床[1],最主要适应症是冠心病、心绞痛和脑缺血等。据报道,BS中几种黄酮生物利用度极低,因此其注射剂的临床疗效更为显著[2]。近几年,临床上除将BS用于治疗缺血性疾病外,也将其用于治疗与炎症密切相关的疾病。研究表明,BS均可降低缺血再灌注损伤和脑损伤大鼠脑组织中炎症因子如白细胞介素6(interleu⁃kin-6,IL-6)和肿瘤坏死因子α(tumor necrosis fac⁃tor-α,TNF-α)的水平[3-5]。BS对脂多糖(lipopoly⁃saccharides,LPS)诱导的脓毒症性急性肺损伤[6]和肾损伤[7]模型大鼠肺、肾组织内诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、TNF-α和IL-1β均有明显抑制作用,并可改善肺、肾组织损伤。不仅如此,BS还能通过抑制炎性凋亡及减少活性氧簇(reactive oxygen species,ROS)产生,改善CCl4诱导的小鼠肝损伤[8]。这些研究结果拓宽了对BS通过改善缺血器官的供血、抗脂质过氧化、清除自由基并减轻细胞凋亡等保护缺血器官的认识[9],提示其可能具有直接的抗炎和抗氧化作用。
LPS是革兰阴性菌细胞壁的主要致病成分,是巨噬细胞等细胞膜上Toll样受体4(Toll-like receptor 4,TLR4)的配体,通过TLR4转导的信号可活化巨噬细胞并产生大量的炎症介质和ROS[10]。LPS活化的巨噬细胞模型主要用于考察受试物对TLR4信号转导入胞内、激活NF-κB和转录因子活化蛋白1(activator protein-1,AP-1)产生大量炎症介质的作用,是评价抗炎药物最经典的体外模型。鉴于BS在炎症疾病,包括在LPS诱导脓毒症中的使用,本研究采用LPS活化巨噬细胞模型和致内毒素血症小鼠模型观察BS注射液(BS injection,BSI)的抗炎作用及对巨噬细胞的保护效应,以期阐释BSI在炎症疾病中的应用价值,为临床合理应用提供实验依据。
1 材料与方法
1.1 动物、细胞、药物、试剂和主要仪器
健康雄性ICR小鼠,20~23 g,由北京维通利华实验动物技术有限公司提供,实验动物合格证号SCXK(京)2016-0006。小鼠常规饲养于中国医学科学院药用植物研究所SPF级实验动物中心,许可证号为SYXK(京)2017-0020,室温20~25℃,湿度55%~70%,12/12 h光照/黑暗,自由饮水摄食。
小鼠巨噬细胞RAW264.7购自美国ATCC细胞库。RAW264.7细胞用含10%(V/V)胎牛血清的DMEM培养基在37℃,5%CO2的恒温培养箱中培养,每3 d传代1次。取对数生长期细胞用于实验。
BSI(国药准字 Z20053907,批号 2014090H,含灯盏乙素96.6%),购自昆明龙津药业股份有限公司,预先用无菌生理盐水配制成浓度为10 g·L-1的储备液,用时稀释。
DMEM培养基和胎牛血清购自美国Gibco公司;LPS、光泽精(lucigenin)、磺胺和N-1-萘乙二胺基二盐酸盐购自美国Sigma-Aldrich公司;还原型辅酶二钠(NADHNa2)和吩嗪二甲基硫酸盐(PMS)购自美国Fluka公司;氯化硝基四氮唑蓝(NBT)购自上海前进试剂厂;EDTA·2H2O购自美国Bio Basic公司;苯甲基磺酰氟(PMSF)购自美国Amresco公司;亮肽素(leupeptin)购自瑞士Roche公司;L-012探针购自日本和光纯药株式会社;JC-1线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒购自上海碧云天生物技术有限公司;ATP检测试剂盒购自北京威格拉斯生物技术有限公司;小鼠巨噬细胞集落刺激因子(mouse colony-stimulating factor,M-CSF)购自北京义翘神州科技有限公司;小鼠TNF-α和IL-6 ELISA试剂盒购自美国Biolegend公司。
Napco 5410型二氧化碳孵箱购自美国NAPCO公司;Multiskan Ascent酶标仪购自美国Thermo Electron公司;Infinite M1000微孔板检测系统购自瑞士Tecan公司;微孔板恒温振荡器购自杭州奥盛仪器有限公司;雷磁PHS-3B型精密pH计购自上海精密科学仪器有限公司;LD5-2A离心机购自北京医用离心机厂;细胞培养板和酶标板购自美国Corning公司。
1.2 小鼠髓源巨噬细胞的制备
小鼠髓源巨噬细胞的制备参考文献[11]。将小鼠处死取股骨,用DMEM培养基冲洗,过滤骨渣并除红细胞后离心,以完全培养基重悬细胞。加入终浓度为100 μg·L-1的M-CSF,分化培养5 d。其间每24 h补充终浓度为100 μg·L-1的M-CSF,第6~9天分化好的细胞(由不贴壁细胞转变为贴壁细胞)用于实验。
1.3 MTT法测定巨噬细胞存活率[12]
取对数生长期RAW264.7细胞以每孔2×105接种于96孔板中,加入BSI 6.25~400 mg·L-1(终浓度),细胞对照组加等体积培养基,本底组加等体积培养基代替细胞悬液(调零孔)。37℃孵育20 h后,加入MTT 20 μL(5 g·L-1),37℃继续孵育4 h,吸除上清,加入DMSO 100 μL,振荡10 min,在540 nm处测吸光度值(A540nm)。细胞存活率(%)=给药组A540nm/细胞对照组A540nm×100%。
1.4 LPS活化巨噬细胞体外模型的制备及上清中炎症因子的测定[12]
取对数生长期RAW264.7细胞按每孔2×105接种于96孔板,或小鼠髓源巨噬细胞按每孔6×105接种于48孔板;模型组加入LPS(终浓度40 μg·L-1),BSI组加入LPS(40 μg·L-1)和BSI(终浓度1.5625~50 mg·L-1),对照组用等体积培养基替代BSI和LPS,于37℃孵育24h后取上清,Griess法测定上清中NO2-的含量,以代表NO分泌水平,按照ELISA试剂盒说明书测定TNF-α和IL-6水平。
1.5 LPS致内毒素血症小鼠模型的制备及血清中炎症因子的测定[13]
将雄性ICR小鼠随机分为5组:正常对照组、模型对照组和模型+BSI 2.5,5和10 mg·kg-1组,每组8只。除正常和模型对照组外,其余各组小鼠一次性ip给予BSI,正常和模型对照组给予等量生理盐水。给予BSI 0.5 h后,模型对照组和模型+BSI组小鼠尾静脉注射LPS 5 mg·kg-1,正常对照组给予等量生理盐水。给予LPS后3 h,各组小鼠眼球取血,4℃静置过夜,4℃下1600×g离心10 min,收集血清备用。
采用改良的Griess法[14]测定血清中NO。将氯化钒(VCl3)溶于1 mol·L-1HCl中,与待测血清按1∶1比例混合,室温避光反应30 min。按原血清体积与混合液〔甲醇∶乙醚=3∶1(V/V)〕1∶9比例进行混合,于4℃静置过夜。4℃条件下1600×g离心10 min,取上清液与Griess试剂等体积混合,室温振荡孵育5 min,测定A540nm。以亚硝酸钠标准曲线来确定其亚硝酸盐含量。血清中TNF-α和IL-6含量按照ELISA试剂盒说明书测定。
1.6 RAW264.7细胞ROS,MMP和ATP水平的测定
取对数生长期RAW264.7细胞按每孔2×105(ROS)或3×106(MMP和ATP)分别接种于96孔板或48孔板,模型组加入LPS(终浓度40 μg·L-1),BSI组给予LPS(40 μg·L-1)和BSI(终浓度1.5625~50 mg·L-1),细胞对照组用等体积培养基替代BSI和LPS。37℃孵育24 h后,L-012荧光染色法测定细胞内ROS浓度[15],JC-1荧光染色法检测细胞内MMP水平[16],荧光素酶催化底物荧光素发光反应检测RAW264.7胞内ATP水平[17]。
1.7 NADH-PMS体系NBT法测定超氧阴离子清除能力[18]
用PBS 0.1 mol·L-1(pH7.4)稀释BSI至终浓度为1.5625~ 50 mg·L-1,按每孔50 μL加入96孔酶标板,阴性对照组加等体积PBS代替BSI。依次加入 150 μmol·L-1PMS 溶液、1.2 mmol·L-1NADH⁃Na2溶液和360 μmol·L-1NBT溶液各50 μL(本底组以等体积0.1 mol·L-1PBS代替),在微型振荡器上振荡30 s,室温反应5 min,在酶标仪540 nm处测A540nm。
1.8 化学发光法测定RAW264.7细胞内NADPH氧化酶活性[19]
取对数生长期RAW264.7细胞,以每孔3×106细胞接种于12孔板中,模型组加入LPS(终浓度40 μg·L-1),BSI组给予LPS(40 μg·L-1)和BSI(终浓度1.5625~50 mg·L-1),细胞对照组用等体积培养基替代BSI和LPS。37℃继续孵育6 h,冰上超声破碎细胞得到溶胞液。加入NADPH(10 mmol·L-1)10 μL,室温避光反应15 min,加5 mmol·L-1光泽精80 μL溶液,混匀后立即测定化学发光值。
1.9 统计学分析
实验结果数据以±s表示。组间均数比较采用单因素方差分析。IC50通过量效曲线回归方程计算。P<0.05认为差异具有统计学意义。
2 结果
2.1 BSI对小鼠巨噬细胞RAW264.7存活率的影响
MTT法测定结果(图1)表明,BSI在6.25~100 mg·L-1浓度范围内,对RAW264.7细胞存活无明显影响;BSI 200和400 mg·L-1明显抑制RAW264.7细胞存活(P<0.01)。为此,后续实验BSI的终浓度均<100 mg·L-1。
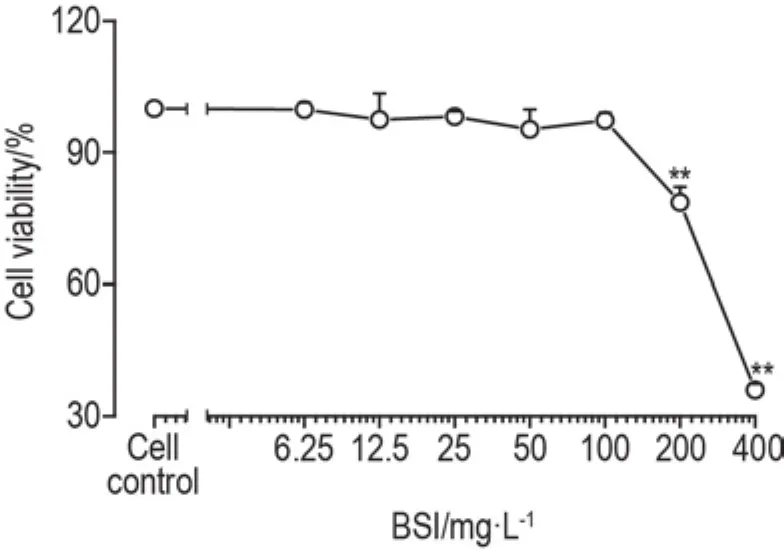
Fig.1 Effect of breviscapine injection(BSI)on cell viability of RAW264.7 macrophages by MTT assay.The cells were incubated with BSI for 24 h.Cell viability(%)=A540 nmof BSI group/A540 nmof cell control group×100%.±s,n=3.**P<0.01,compared with cell control group.
2.2 BSI对LPS活化RAW264.7巨噬细胞和小鼠髓源巨噬细胞分泌炎症因子的作用
图2A结果显示,与细胞对照组比较,LPS孵育RAW264.7细胞24 h可显著增加细胞上清中NO(以上清中NO2-含量反映),TNF-α和IL-6含量(P<0.01);BSI 25和50 mg·L-1组NO含量较LPS组显著降低(P<0.01);BSI 1.5625~50 mg·L-1组TNF-α含量较LPS组无明显变化,IL-6含量较LPS组明显升高(P<0.01)。BSI 1.5625~50 mg·L-1对小鼠髓源巨噬细胞上清NO,IL-6和TNF-α也无明显的抑制作用(图2B),与上述结果基本一致。提示BSI体外抗炎作用不明显。
2.3 BSI对LPS诱导内毒素血症模型小鼠血清中炎症因子的作用
图3结果所示,LPS 5 mg·kg-1可显著增加小鼠血清中NO,IL-6和TNF-α水平(P<0.01),给予BSI 2.5,5和10 mg·kg-1对该模型小鼠血清中3种炎症因子水平均无显著影响,表明BSI体内抗炎作用不明显。
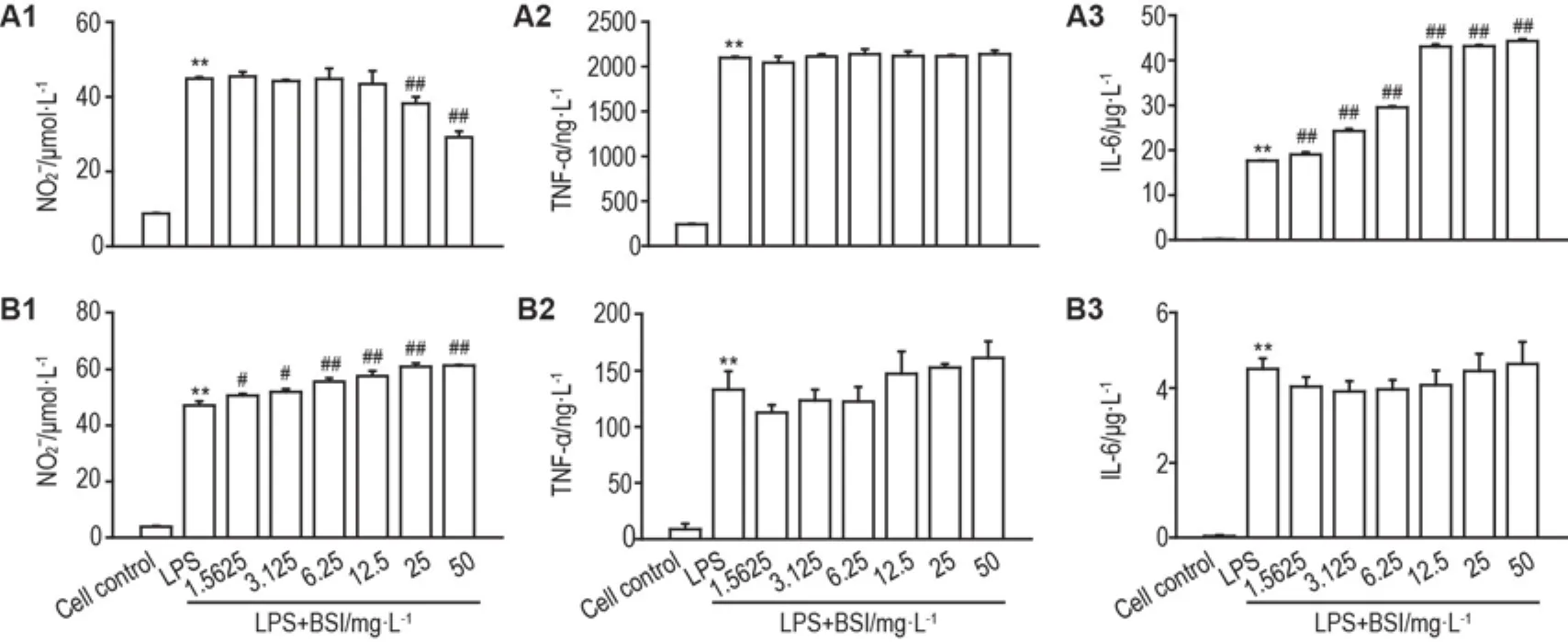
Fig.2 Effect of BSI on supernatant nitric oxide(NO),tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6)in lipo⁃polysaccharides(LPS)-primed RAW264.7 macrophages(A)and mouse bone marrow derived macrophages(B).The cells were treated with BSI 1.5625-50 mg·L-1with or without LPS(40 μg·L-1)for 24 h.Nitrite level(A1 and B1)in the culture medium was measured by the Griess reaction.Supernatant TNF-α(A2 and B2)and IL-6(A3 and B3)levels were determined by ELISA.±s,n=3.**P< 0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
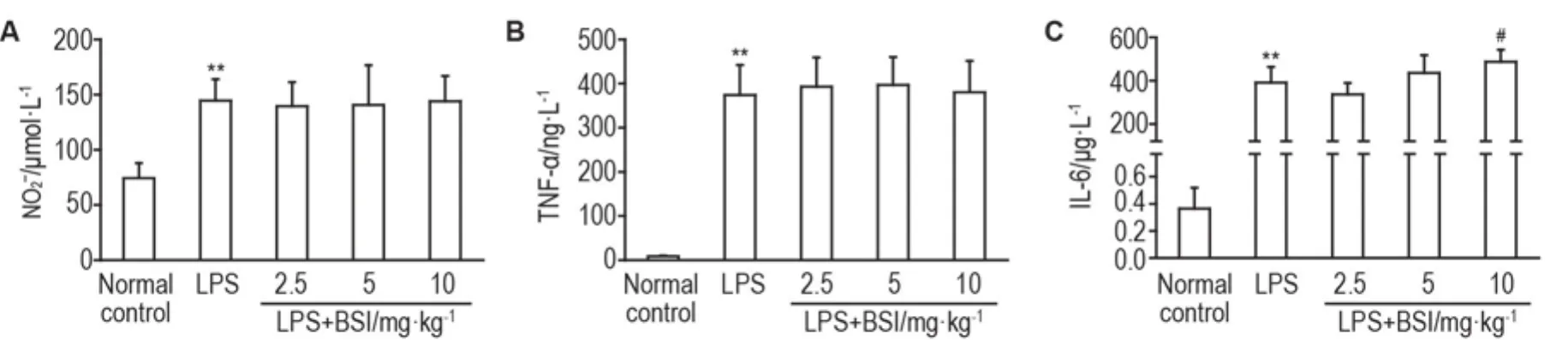
Fig.3 Effect of BSI on serum NO(A),TNF-α(B)and IL-6(C)levels in LPS-induced endotoxemia mice.Mice were ip given BSI 30 min before LPS 5 mg·kg-1intravenous injection.Three hours after LPS challenge,the mice were sacrificed and the serum NO,TNF-α and IL-6 were measured.±s,n=8.**P<0.01,compared with normal control;#P<0.05,compared with LPS group.
2.4 BSI对LPS活化RAW264.7巨噬细胞ROS,MMP和ATP水平的影响
如图 4A 所示,LPS 40 μg·L-1可显著升高RAW264.7细 胞 内 ROS 水 平(P<0.01),BSI 1.5625~50 mg·L-1可显著抑制LPS致细胞ROS水平的升高(P<0.01),显示出良好的抗氧化作用。
如图4B 所示,LPS 40 μg·L-1处理RAW264.7细胞24 h,可使胞内绿色/红色荧光比值明显升高(P<0.01),提示此时细胞MMP发生了去极化;BSI 6.25~50 mg·L-1则能显著减少绿色/红色荧光比值(P<0.01),提示BSI可有效减缓LPS诱导的MMP去极化作用。
图4C 显示,LPS 40 μg·L-1可致RAW264.7细胞内 ATP 含量明显下降(P<0.01),BSI 3.125~50 mg·L-1能显著升高胞内ATP含量(P<0.01),提示BSI能有效对抗LPS所导致胞内ATP下降。
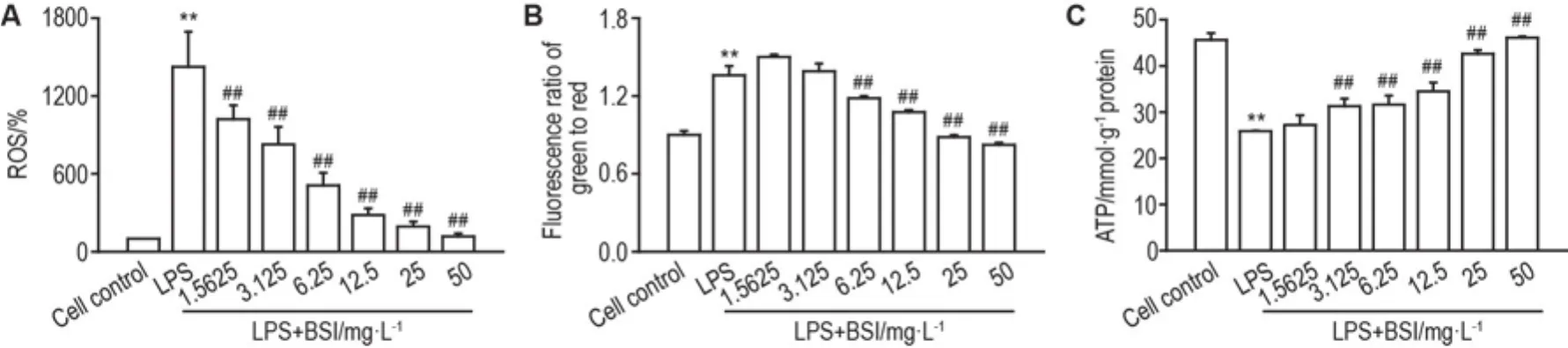
Fig.4 Effect of BSI on levels of reactive oxygen species(ROS)(A),mitochondrial membrane potential(MMP)(B)and ATP(C)in LPS-primed RAW264.7 macrophages.See Fig.2 for the cell treatment.ROS,MMP and ATP were deter⁃mined by L-012 assay,JC-1 assay and firefly luciferase reaction,respectively.±s,n=3.*P<0.01,compared with cell control group;##P<0.01,compared with LPS group.
2.5 BSI对超氧阴离子的直接清除作用
图5所示,BSI在3.125~ 50 mg·L-1浓度范围内,具有明显的直接清除超氧阴离子的作用,且呈良好的浓度效应关系(R2=0.999,P<0.05)。IC50为118.55 mg·L-1。
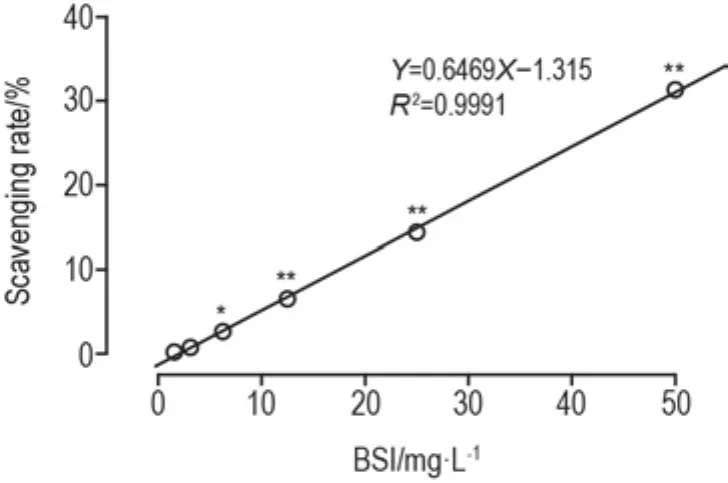
Fig.5 Effect of BSI on scavenging activity of super⁃oxide anion.The scavenging activity of BSI on superoxide anion was determined by NADH-NBT-PMS reaction.±s,n=3.*P<0.05,**P<0.01,compared with control(0)group.
2.6 BSI对LPS活化RAW264.7细胞NADPH氧化酶活性的作用
图6结果显示,与细胞对照组比较,LPS可致RAW264.7细胞内NADPH氧化酶活性明显增高(P<0.01);与LPS组比较,BSI则能显著抑制LPS活化的NADPH活性(P<0.05,P<0.01)。
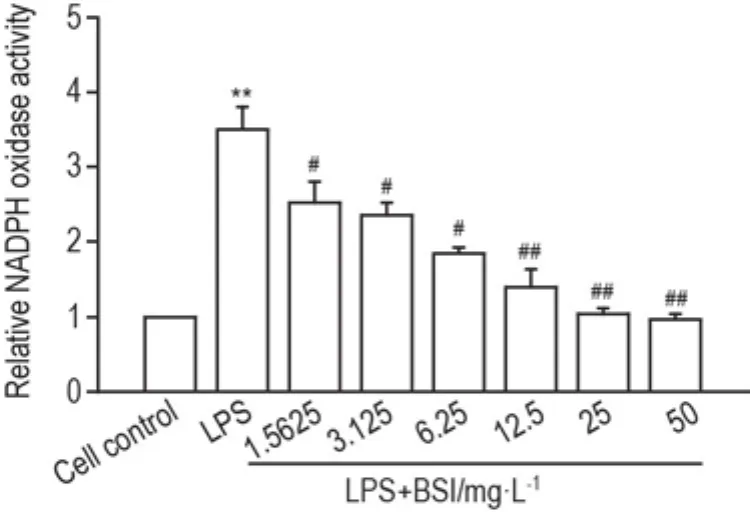
Fig.6 Effect of BSI on intracellular NADPH oxidase activity in LPS-primed RAW264.7 cells.See Fig.2 for the cell treatment.The NADPH oxidase activity was determined by chemiluminescence after six-hour cell treatment.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with LPS group.
3 讨论
临床上BS主要用于治疗卒中及其后遗症、冠心病和心绞痛等疾病。近年其临床应用逐步扩大,尤其是在一些与炎症密切相关的病症上应用渐多,如骨性关节炎[20]、慢性阻塞性肺病[21]、肺纤维化[22]、急性胰腺炎[23]、病毒性心肌炎[24]和慢性肾小球肾炎[25]等,或联用或单用。据报道,鞘内给予灯盏乙素(BSI中最主要成分),可明显抑制甲醛诱导的大鼠炎症疼痛反应、脊髓NOS的表达及NO水平,显示其可能的抗炎作用[26]。但由于炎症种类繁多,所涉及的信号转导通路及细胞因子各异,BS对LPS诱导脓毒症急性肾损伤的保护[7]等作用是通过抑制炎症还是保护细胞来实现的均不甚清楚。
巨噬细胞活化是宿主防御致病微生物的关键过程,进而导致炎症级联反应的开始和炎性介质的释放[27]。作为革兰阴性菌壁的主要成分,LPS可与巨噬细胞膜上TLR4的识别结合,触发下游信号接头蛋白MyD88的募集,后者又引起一系列信号级联反应使得IκB激酶(inhibitory kappa B kinase,IKK)或丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的激活[28]。IKK使IκB发生磷酸化,进而释放转录因子如P65等入核,而MAPK包括P38,ERK1/2和JNK,激活后会使转录因子c-FOS等活化入核。核内的转录因子与靶基因启动子或增强子区特异性序列结合,发挥其转录调节功能,产生如iNOS,TNF-α和IL-6等促炎因子[29-30]。抗炎药物往往是通过抑制NF-κB/AP-1来发挥抗炎作用的。
在不影响细胞存活的浓度范围内,BSI对LPS活化巨噬细胞分泌TNF-α和IL-6无抑制作用,提示其可能对NF-κB/AP-1信号通路无相应的抑制作用。本研究发现,BSI在25和50 mg·L-1时对LPS活化的RAW264.7细胞上清中NO含量有抑制作用,但在原代巨噬细胞并未显示该作用。再综合BSI对该2种细胞TNF-α和IL-6分泌无抑制作用,推测BSI对TLR4信号通路无抑制作用。
值得一提的是,BSI在实验浓度范围内,对LPS活化RAW264.7细胞(不包括原代巨噬细胞)上清中IL-6,不仅无抑制作用,反而可促进其生成。但体内实验并不支持BSI升高LPS活化RAW264.7细胞IL-6结果。总之,无论是体外LPS活化巨噬细胞模型,还是体内内毒素血症模型,BSI均未显示出其抗炎作用,此结果3个模型是一致的。
在LPS活化细胞膜TLR4通路转导炎症信号的同时,它还能活化细胞膜上NADPH氧化酶等引起胞内ROS增加[31]。BSI抗炎作用不明显,临床却将其用于与炎症相关的病症,包括脓毒症,推测BSI在这些病症中发挥了抗炎以外的作用。考虑到BS在治疗缺血性疾病中突出的抗氧化作用,推测其有可能通过抗氧化来实现对炎症相关细胞(如中性粒细胞、单核细胞和巨噬细胞等)的保护作用。
LPS刺激RAW264.7细胞除可引起经典的炎症因子释放以外,还可引起细胞的其他损伤,如MMP水平的下降和胞内ATP被大量耗损等。细胞内的这些病理现象主要源于LPS能诱导胞内ROS的产生。对此,BSI既能直接清除超氧阴离子,又能抑制NADPH氧化酶以减少ROS的生成,通过抑制胞内ROS的升高来改善因ROS引起的MMP下降和ATP耗损以达到保护细胞的作用。
综上,BS虽无明显抗炎作用,却在炎症相关疾病中有应用,这可能与其阻止炎症损伤所致细胞内ROS升高、消除因ROS升高引起的MMP下降和ATP耗损,从而达到保护细胞(组织)作用有关。与本研究一致的是,近年来临床也越来越多地将BS联合抗炎药物用于炎症相关疾病[1-4]。本研究可能为扩大BS的临床适应症范围以及指导其在炎症相关疾病的临床使用方面提供实验支撑。
