外源钙和钙调素拮抗剂对冷藏桃果实耐冷性的影响
2019-01-28洪羽婕郑永华
凌 晨,谢 兵,洪羽婕,王 莉,金 鹏*,郑永华
(南京农业大学食品科技学院,江苏 南京 210095)
桃果实果肉柔软细腻、鲜美多汁,深受广大消费者喜爱。由于桃果实采摘时正值高温多雨的夏季,且桃属于典型的呼吸跃变型果实,采后在常温下迅速后熟软化,容易受机械损伤从而被病原菌侵染,极易腐烂变质[1]。同时,桃又是一种对低温非常敏感的水果,低于10 ℃贮藏2~3 周后极容易出现冷害症状,导致果肉褐变、絮状败坏或木质化、风味丧失、果汁减少等现象,极大地降低了商品价值[2]。低温冷害是影响桃果实采后贮藏保鲜、运输和制约其产业发展的主要障碍因子。因此,研究桃果实冷害的发生机制以及如何有效提高桃果实抗冷性从而延长贮藏期和货架期,一直是采后贮藏和运输产业亟需解决的问题。
Ca2+是生物必需营养元素之一,其在植物体内也发挥着十分重要的作用。Ca2+是细胞壁和细胞膜结构的必需物质,在维护其正常结构与功能、减少或延缓膜的损伤等方面具有重要作用[3]。然而,Ca2+不仅只发挥基础营养元素的作用,它还是耦联胞外信号与胞内生理反应的第二信使,参与植物因外界刺激而引起的自身反应,从而调节植物细胞对逆境信号的转导[4]。近年来诸多研究表明,添加外源钙(Ca2+)对提高果实抵御低温胁迫具有积极作用。王大伟等[5]研究发现质量分数1% CaCl2能较好地保持冬枣的品质,有效抑制低温贮藏期间冬枣腐烂的发生。刘萍等[6]对金柑果实进行次氯酸钙浸泡,发现其能有效降低果实腐烂率,提高抗氧化酶类(过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD))的活力并延缓其降低速率。Kou Xiaohong等[7-8]发现质量分数2% CaCl2溶液浸泡处理能有效抑制‘黄冠’梨褐斑病的发生,提高梨果实过氧化氢酶(catalase,CAT)、SOD活力,同时能保持梨果实中的苹果酸含量,较好地维持果实的口感和品质。梁庆沙等[9]研究发现质量分数1% CaCl2和0.1% VC混合液处理桃果实,能较长时间维持果实硬度,减少可溶性果胶和松弛结核性多糖的质量分数,有助于延长果实货架期。随着植物钙调素(CaM)的发现与深入研究,Ca2+的第二信使功能使Ca2+成为植物代谢的重要调节物质[10]。Ca2+参与植物细胞对低温胁迫的信号转导表现为:当植物受到不适宜的低温胁迫时,Ca2+会与其受体蛋白CaM结合,激活一系列靶酶和非酶蛋白,通过形成钙-钙调素(Ca2+-CaM)复合体来诱导和调控植物的保护酶系统,引起一系列的自我保护反应,从而调控相关生理代谢及基因表达[10-11]。三氟拉嗪(trifluoperazin,TFP)是一种钙调素拮抗剂,能影响Ca2+-CaM复合体的功能,引起植物信号转导之间的障碍。利用Ca2+和TFP处理实验材料,通过增强和阻碍Ca2+-CaM复合体的形成这两个方面进行考察,是目前研究植物钙-钙调素(Ca2+-CaM)信使系统的重要手段。国内外已有研究表明,当植物受到环境胁迫以及植物激素刺激时,均会导致细胞质内Ca2+浓度的变化,Ca2+参与了植物和果实在不同环境下抗冷能力的变化,与植物的抗冷性有着密切联系[12-13]。
目前,对Ca2+-CaM复合体的抗逆性研究已经在茄子幼苗[14]、辣椒幼苗[15]和黄瓜[16]等原材料上进行,但在桃果实上还鲜有报道。本实验利用外源钙和钙调素拮抗剂(TFP)浸泡处理桃果实,通过对采后冷藏桃果实冷害和活性氧代谢等方面的研究,以期从增强和阻碍Ca2+-CaM复合体的形成两个方面探讨Ca2+-CaM复合体在调控桃果实抗冷性方面的作用机理,为添加外源钙在桃果实采后低温贮藏和运输中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
以八成熟‘白凤’水蜜桃果实(Prunus persica Batsch ‘Baifeng’)为材料,于2017年7月采收于江苏省农科院果园,采摘后2 h内运回实验室,散去田间热,挑选色泽、大小基本一致,无病虫害和机械损伤的果实。
愈创木酚、对氨基苯磺酸、四氯化钛、VC、邻菲啰啉、2-硫代巴比妥酸(2-thiobarbituric,TBA)、三氯乙酸(trichloroacetic acid,TCA)、磺基水杨酸 国药集团化学试剂有限公司;核黄素、甲硫氨酸、氮蓝四唑(nitrotetrazolium blue chloride,NBT)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、无水CaCl2、α-萘胺、盐酸羟胺、Folin试剂、乙二胺四乙酸二钠(EDTA-2Na)、酸性茚三酮、脯氨酸、L-鸟氨酸、α-酮戊二酸、磷酸吡哆醛、还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH) 南京杰汶达试剂器材有限公司;TFP 北京百灵威科技有限公司。
1.2 仪器与设备
MIR-253三洋恒温培养箱 上海恒逸实业有限公司;HZ602A型电子天平 慈溪红钻衡器设备有限公司;PAL-1手持阿贝折光仪 日本Atago公司;GY-3型水果硬度计 衢州艾普计量仪器有限公司;QL-861型振荡仪海门市其林贝尔仪器制造有限公司;DK-S26型电热恒温水浴锅 上海森信实验仪器有限公司;GL-20G-H型冷冻离心机 上海安亭科学仪器厂;FA1204B型分析天平赛多利斯科学仪器(北京)有限公司;UV-1600型紫外-可见分光光度计 上海元析仪器有限公司;DDS-11A型电导率仪 上海第二分析仪器厂。
1.3 方法
1.3.1 样品前处理
将挑选出的桃果实随机分成3 组,将其中两组桃果实分别在质量分数1% CaCl2和200 μmol/L TFP溶液中浸泡10 min,剩下一组在蒸馏水中浸泡10 min(对照组)。浸泡后使其自然晾干,然后将每6 个桃果实装入一个0.01 mm厚聚氯乙烯塑料袋,袋口用普通橡皮筋绕两圈,随后放入(5±1)℃、相对湿度90%的恒温箱中贮藏5 周。贮藏期间每隔1 周进行取样并分析测定相关品质和生理指标。另外,每周取部分桃果实放在20 ℃条件下模拟3 d货架期,使桃果实冷害症状充分显现,并测定桃果实硬度、出汁率和可溶性固形物(total soluble solid,TSS)质量分数。实验中其余指标均为贮藏期间取样测定。
1.3.2 果肉硬度的测定
在桃果实赤道部位(横径最大处)挑选对称的两点去皮(厚度1 mm),用硬度计测定桃果实硬度,每次测定8 个桃果实,结果取平均值。
1.3.3 果肉出汁率的测定
参照Ling Chen等[17]的方法测定,用直径6 mm的打孔器在每个去皮后的桃果实上取出肉柱,分别切下厚度均匀的片状果实,每次取8 片来自不同桃果实的肉片放入已称质量的装有吸水纸的离心管(m1/g)中,并称此时的质量(m2/g),1 500×g离心10 min后取出果肉再称质量(m3/g),重复3 次。出汁率计算见公式(1)。

1.3.4 TSS质量分数的测定
将桃果实样品在研钵中研磨成匀浆,再用手持折光仪测定桃果实TSS质量分数,重复3 次。
1.3.5 褐变指数的测定
取10 个桃果实,将果实纵向切开,按照桃果实果心褐变面积占果实切面总面积的百分比将褐变程度分为5 个等级。0级:没有褐变;1级:褐变面积小于5%;2级:褐变面积在5%~25%之间;3级:褐变面积在25%~50%之间;4级:褐变面积大于50%。褐变指数的计算见公式(2)。

1.3.6 相对电导率的测定
按照测果肉出汁率的方法取出8 片果肉圆片放入25 m L具塞刻度试管,同时加入2 0 m L去离子水,摇匀后放置3 0 m i n,用电导率仪测定电导率(P1/(μ S/c m)),然后将试管煮沸15 min,待冷却到室温后再次测定电导率(P2/(μS/cm)),重复3 次。相对电导率计算见公式(3)。

1.3.7 丙二醛含量的测定
取2 g桃果肉样品放入研钵,加入5 mL 50 g/L TCA溶液,冰浴条件下研磨成匀浆,转移到10 mL离心管中,4 ℃、12 000×g条件下离心20 min,所得上清液即为待测溶液。取2 mL待测溶液于试管中,加入2 mL 6.7 g/L TBA溶液,混匀后在沸水浴下反应30 min,待煮沸后的混合液冷却置室温,紫外-可见分光光度计分别测定混合液在450、532 nm和600 nm波长处的吸光度,分别记为A1、A2、A3。为消除果肉中可溶性糖类物质引起的误差,反应混合液中丙二醛(malondialdehyde,MDA)浓度(c)计算见公式(4),MDA含量计算见公式(5)。

式中:V0表示样品提取液总体积/mL;V1表示测定时所取样品提取液体积/mL;m0表示样品质量/g。1.3.8 VC含量的测定
VC含量的测定参考梁敏华等[18]的方法并稍作修改。待测溶液的提取方法同1.3.7节。提前分别将1 mL 50 g/L TCA溶液、1 mL无水乙醇、0.5 mL体积分数0.4%磷酸溶液、1 mL5 g/L邻菲啰啉溶液加入试管,然后加入1 mL待测溶液和0.5 mL 0.3 g/L FeCl3溶液,振荡摇匀后放置在30 ℃水浴中反应1 h,测定混合液在534 nm波长处的吸光度。单位为mg/kg,结果以鲜质量计。1.3.9 SOD、CAT、APX活力的测定
SOD活力参照Jin Peng等[19]的方法,用NBT光还原法进行测定,分别向试管中加入0.1 mL待测酶液和1.8 mL磷酸盐缓冲液(50 mmol/L,pH 7.8),然后分别加入体积均为0.3 mL的130 mmol/L蛋氨酸溶液、0.75 mmol/L NBT溶液和0.1 mmol/L EDTA-2Na溶液,最后加入0.3 mL 20 μmol/L核黄素溶液,置于4 000 lx日光灯下反应15 min后,立即取出置于暗处终止反应。以不经日光灯照射作空白对照,测定混合液在560 nm波长处的吸光度;以每克鲜样品每分钟在560 nm波长处对NBT光化还原的抑制为50%时为1 个SOD活力单位。
CAT活力参照Zhang Yu等[20]的方法进行测定并稍作修改,反应体系包括2.5 mL 50 mmol/L磷酸盐缓冲液(pH 7.0)、0.3 mL待测酶液以及0.2 mL、体积分数0.75% H2O2溶液,振荡摇匀后立即测定混合液2 min内在240 nm波长处吸光度的变化;以每克鲜样品每分钟在240 nm波长处吸光度变化0.01为1 个酶活力单位。
APX活力参照孙玉洁等[21]的方法进行测定并稍作修改,向试管中加入2.2 mL 50 mmol/L pH 7.5磷酸盐缓冲液(含0.1 mmol/L EDTA、0.5 mmol/L VC)和0.5 mL待测酶液,最后加入0.3 mL2 mmol/L H2O2溶液启动反应,振荡摇匀后立即测定混合液5 min内在290 nm波长处吸光度的变化。以每克鲜样品每分钟在290 nm波长处吸光度变化0.01为1 个酶活力单位。
例2 北京同仁堂是中药行业著名的老字号,创建于清康熙八年(1669),自雍正元年(1723)正式供奉清皇宫御药房用药,历经八代皇帝,长达188年。
以上酶活力单位均为U/g,且均以鲜质量计。
1.3.11 脯氨酸含量和P5CS、PDH、OAT活力的测定
脯氨酸含量参照Shan Timin等[24]的方法进行测定并稍作修改,取2 g桃果肉样品放入研钵,加入5 mL 30 g/L磺基水杨酸,冰浴条件下研磨成匀浆,转移到10 mL离心管中,4 ℃、12 000×g条件下离心20 min,所得上清液即为待测溶液。向准备好的25 mL试管中加入2 mL冰醋酸及3 mL酸性茚三酮试剂,最后加入2 mL待测溶液,沸水浴30 min后溶液呈红色。取出试管,待冷却后加入4 mL甲苯,摇荡静置。待溶液分层后吸取上层于比色皿中测定其在520 nm波长处的吸光度,单位为μg/g。
Δ1-吡咯啉-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)、脯氨酸脱氢酶(proline dehydrogenase,PDH)和鸟氨酸氨基转移酶(ornithine δ-aminotransferase peroxidase,OAT)活力参照Shang Haitao等[25]的方法进行测定。P5CS反应体系包括1.3 mL 50 mmol/L Tris-HCl缓冲液(pH 7.2)、0.3 mL待测酶液以及0.2 mL 1.5 mmol/L NADPH溶液;以每克鲜样品每分钟在340 nm波长处吸光度变化0.001为1 个酶活力单位。PDH反应体系包括1.3 mL 0.1 mol/L Na2CO3-NaHCO3缓冲液(pH 10.3)、0.3 mL 0.1 mol/L脯氨酸溶液、0.4 mL待测酶液以及0.15 mL10 mmol/L NADPH溶液。以每克鲜样品每分钟在340 nm波长处吸光度变化0.001为1 个酶活力单位。OAT反应体系包括0.1 mL 50 mmol/L磷酸盐缓冲液(pH 8.0,含35 mmol/L L-鸟氨酸、5 mmol/L α-酮戊二酸和0.05 mmol/L磷酸吡哆醛)和0.3 mL待测酶液;以每克鲜样品每分钟在510 nm处吸光度变化0.001为1 个酶活力单位。以上酶活力单位均为U/g。
1.3.12 GSH含量和GR活力的测定
谷胱甘肽(glutathione,GSH)含量参照韩一林等[26]的方法进行测定并稍作修改,取2 g桃果肉样品放入研钵,加入5 mL 50 g/L TCA溶液,冰浴条件下研磨成匀浆,转移到10 mL离心管中,4 ℃、12 000×g条件下离心20 min,所得上清液即为待测溶液。取两支试管,分别加入1 mL待测溶液和1 mL磷酸盐缓冲液(0.1 mol/L,pH 7.7),然后向其中一支试管加入0.5 mL1 mmol/L二硫代硝基苯甲酸(5,5-dithiobis-2-nitrobenzoic acid,DTNB)溶液,另一支试管中加入0.5 mL 0.1 mol/L磷酸盐缓冲液(pH 6.8),置于25 ℃保温10 min,迅速测定其在412 nm波长处的吸光度,单位为μmol/g。
GR活力参照曲丹阳等[27]的方法进行测定,反应体系包括2.7 mL 0.1 mol/L磷酸盐缓冲液(pH 7.5)、0.1 mL5 mmol/L GSSG溶液、0.2 mL待测酶液和40 μL1 mmol/L NADPH溶液。以每克鲜样品每分钟在340 nm波长处吸光度变化0.01为1 个酶活力单位,单位为U/g。
1.4 数据处理
2 结果与分析
2.1 钙和钙调素拮抗剂处理对桃果实货架期品质的影响
贮藏不同时间并进行货架3 d后,桃果实品质指标见表1。贮藏时间越长,模拟货架3 d后硬度越低,表明桃果实发生了后熟软化。贮藏不同时间并进行货架3 d后,CaCl2处理组均表现为硬度最高;贮藏35 d+货架3 d各处理组中,CaCl2处理组硬度显著高于TFP处理组(P<0.05),是其1.76 倍。在贮藏不同时间并进行货架3 d时,桃果实出汁率随贮藏时间延长呈现上升趋势,CaCl2处理组出汁率最低,其次为对照组,TFP处理组出汁率最高,CaCl2处理组出汁率显著低于TFP处理组(P<0.05),表明CaCl2处理能较好地延缓桃果实软化。贮藏时间越长,货架3 d后桃果实TSS质量分数越低,CaCl2处理组TSS质量分数最高,其次为对照组,TFP处理组TSS质量分数最低,CaCl2处理组TSS质量分数显著高于TFP处理组(P<0.05)。

表1 钙和钙调素拮抗剂处理对冷藏桃果实货架期品质指标的影响Table1 Effects of calcium and trif l uoperazin treatments on quality parameters of peach fruit during shelf life after cold storage
2.2 钙和钙调素拮抗剂处理对桃果实贮藏期间果心褐变的影响

图1 钙和钙调素拮抗剂处理对桃果实冷藏过程中褐变指数的影响Fig.1 Effects of calcium and trif l uoperazin treatments on internal browning index in cold-stored peach fruits
随着贮藏时间延长,各处理组桃果实果心褐变指数不断增加。如图1所示,贮藏至21 d,各处理组均开始发生明显冷害,出现果心褐变症状,随后不断上升。CaCl2处理组在整个贮藏期间桃果实褐变指数显著低于对照组(P<0.05),而TFP处理组褐变指数显著高于对照组和CaCl2处理组(P<0.05)。在贮藏结束时,经CaCl2处理的果实果心褐变指数仅为对照组的77.6%,而TFP处理加剧了褐变程度,是对照组的1.17 倍。这表明CaCl2处理明显抑制了果心褐变,提高桃果实抗冷性;而TFP处理加剧了桃果实采后冷害,缩短果实贮藏寿命和货架期。不同处理组在贮藏28 d、货架3 d后的果实见图2。

图2 货架结束后不同处理组桃果实照片Fig.2 Photographs of peach fruit subjected to different treatments at the end of shelf-life
2.3 钙和钙调素拮抗剂处理对桃果实贮藏期间相对电导率和MDA含量的影响


图3 钙和钙调素拮抗剂处理对桃果实冷藏过程中相对电导率(A)和MDA含量(B)的影响Fig.3 Effects of calcium and trif l uoperazin treatments on relative electric conductivity (A) and MDA content (B) in cold-stored peach fruit
如图3A、B所示,桃果实在冷藏期间相对电导率和MDA含量总体呈逐渐上升的趋势。CaCl2处理组的相对电导率低于对照组和TFP处理组,CaCl2处理在一定程度上保持了桃果实细胞膜良好的完整性,而TFP处理则加剧了相对电导率的上升,但两个处理组之间差异不显著(图3A)。MDA是细胞膜脂过氧化的产物,在桃果实采后冷害过程中,其含量总体呈现上升趋势(图3B)。在冷藏的第35天,CaCl2处理组MDA含量低于对照组和TFP处理组,而TFP处理组高于对照组。表明CaCl2处理通过促进Ca2+-CaM复合体的形成,减缓低温胁迫对细胞膜带来的损伤,控制细胞内电解质外渗,从而提高桃果实抗冷性;而TFP处理通过抑制Ca2+-CaM复合体的形成,加重桃果实细胞膜损伤,加剧冷害对桃果实的伤害。
2.4 钙和钙调素拮抗剂处理对桃果实贮藏期间VC含量的影响

图1 钙和钙调素拮抗剂处理对桃果实冷藏过程中VC含量的影响Fig.1 Effects of calcium and trif l uoperazin treatments on the content of VC in cold-stored peach fruit
如图4所示,各处理组桃果实在冷藏期间VC含量总体呈下降趋势。CaCl2处理有效抑制了VC含量的下降,其VC含量在贮藏末期显著高于对照组和TFP处理组(P<0.05),在贮藏第35天,CaCl2处理组VC含量为对照组的1.43 倍;而TFP处理组VC含量在贮藏前28 d低于对照组,至贮藏结束时基本与对照组持平。
2.5 钙和钙调素拮抗剂处理对桃果实贮藏期间抗氧化酶活力的影响
SOD、CAT、APX是果实组织中清除活性氧自由基的抗氧化酶类。桃果实在5 ℃贮藏期间,对照组SOD活力在贮藏期间表现出先略微上升而后逐渐趋于平缓的趋势(图5A),CAT活力在贮藏前7 d有所上升随后呈现缓慢下降的趋势(图5B),APX活力在贮藏前14 d上升,随后不断下降(图5C)。CaCl2处理组桃果实SOD、CAT和APX活力在整个贮藏期间都显著高于对照组(P<0.05),且其SOD活力至贮藏结束时仍高于采摘当天;与对照组相比,TFP处理在贮藏7 d之后显著抑制了桃果实SOD、CAT和APX活力(P<0.05)。贮藏的第35天,CaCl2处理组SOD、CAT和APX活力分别比对照组高13.50%、25.52%和19.77%,而TFP处理组SOD、CAT和APX活力分别比对照组低19.6%、21.4%和8.1%。这表明Ca2+处理能促进Ca2+-CaM复合体的形成,提高活性氧代谢酶活力,缓解低温胁迫给细胞带来的损伤,从而提高桃果实抗冷性;而TFP处理通过抑制Ca2+-CaM复合体的形成降低了SOD、CAT和APX活力,从而加剧冷害对桃果实的伤害。

图5 钙和钙调素拮抗剂处理对桃果实冷藏过程中SOD(A)、CAT(B)、APX(C)活力的影响Fig.5 Effects of calcium and trif l uoperazin treatments on SOD (A),CAT (B) and APX (C) activities in cold-stored peach fruit
2.6 钙和钙调素拮抗剂处理对桃果实贮藏期间O2-·产生速率和H2O2含量的影响
由图6A、B可以看出,桃果实O2-·产生速率和H2O2含量在整个贮藏期间呈现总体上升趋势。对照组和TFP处理组O2-·产生速率在前7 d上升,随后下降,之后再持续上升,CaCl2处理组则在前7 d略微下降,随后缓慢上升,CaCl2处理组整个贮藏过程中O2-·产生速率均显著低于对照组(P<0.05)。对照组H2O2含量总体呈现上升趋势,CaCl2处理组H2O2含量显著低于对照组(P<0.05),TFP处理组在贮藏7 d后,H2O2含量显著高于对照组和CaCl2处理组(P<0.05)。说明CaCl2处理增加了桃果实内Ca2+浓度,促进了Ca2+-CaM复合体的形成,能减少活性氧自由基的积累和伤害,提高桃果实抗冷性;而TFP处理通过抑制Ca2+-CaM复合体的形成,在贮藏中后期显著提高了这两种活性氧自由基的积累,加剧了对桃果实组织的伤害。

图6 钙和钙调素拮抗剂处理对桃果实冷藏过程中O-2·产生速率(A)和H2O2含量(B)的影响Fig.6 Effects of calcium and tri fl uoperazin treatments on O2-·production rate (A) and H2O2 content (B) in cold-stored peach fruit
2.7 钙和钙调素拮抗剂处理对桃果实贮藏期间脯氨酸含量和P5CS、PDH、OAT活力的影响

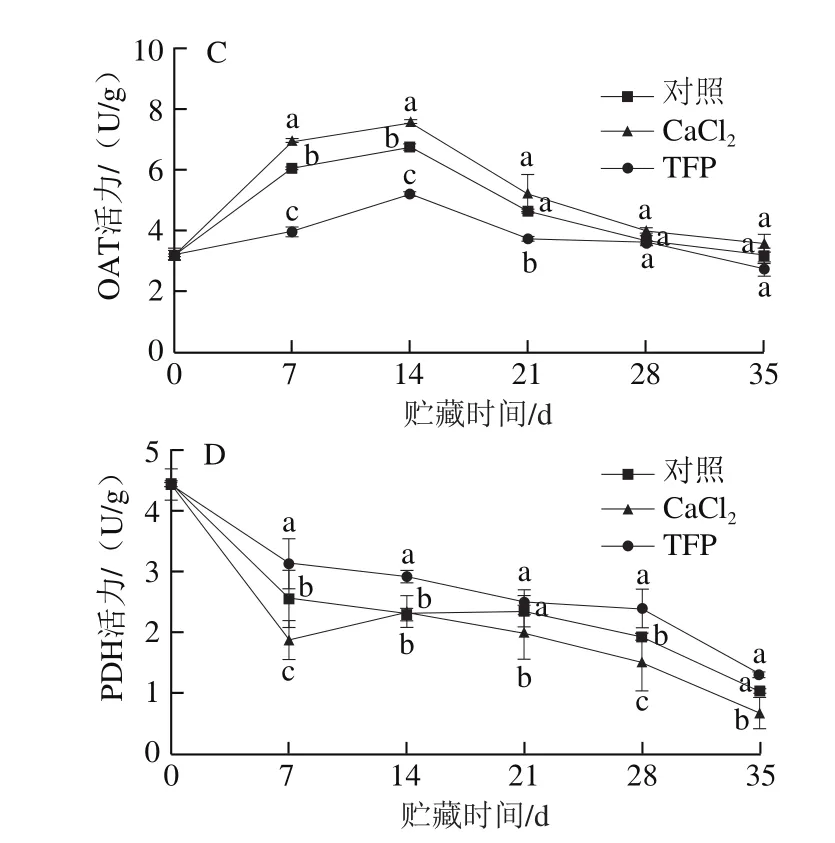
图7 钙和钙调素拮抗剂处理对桃果实冷藏过程中脯氨酸含量(A)和P5CS(B)、OAT(C)、PDH(D)活力的影响Fig.7 Effects of calcium and trif l uoperazin treatments on proline content (A) and P5CS (B), OAT (C) and PDH (D) activities in cold-stored peach fruit
由图7A可知,在冷藏期间,桃果实中脯氨酸含量大体上呈逐渐增加的趋势;与对照组相比,CaCl2处理显著提高了贮藏后期脯氨酸的积累量(P<0.05),而TFP处理则降低了贮藏过程中脯氨酸的积累量;贮藏第35天时,Ca2+处理组脯氨酸含量比TFP组高11.7%。由图7B可知,P5CS活力在贮藏前21 d呈上升趋势,而后略有下降;与对照组相比,CaCl2处理显著提高了桃果实中P5CS活力(P<0.05),而TFP处理显著抑制了贮藏中后期P5CS活力(P<0.05);贮藏第35天,CaCl2处理组P5CS活力比对照组提高了17.5%。由图7C可知,所有组桃果实OAT活力在贮藏前14 d急剧上升,随后逐渐下降;与对照组相比,贮藏前期CaCl2处理显著提高了桃果实中OAT活力(P<0.05),而TFP处理组在整个贮藏期间抑制OAT活力。由图7D可知,PDH活力在冷藏期间大体上呈下降趋势;与对照组相比,CaCl2处理在贮藏21 d后显著抑制了PDH活力(P<0.05),而整个贮藏期间TFP组桃果实的PDH活力均高于对照组。
以上结果表明CaCl2处理能促进Ca2+-CaM复合体的形成,提高P5CS和OAT活力并且降低PDH活力,促使脯氨酸积累量增加,从而提高桃果实抗冷性;而TFP处理通过抑制Ca2+-CaM复合体的形成提高PDH活力,降低P5CS和OAT活力,阻碍脯氨酸的积累,从而加剧冷害对桃果实的伤害。
2.8 钙和钙调素拮抗剂处理对桃果实贮藏期间GSH含量和GR活力的影响
如图8A所示,在冷藏期间,桃果实中GSH含量总体呈上升趋势,至贮藏结束时,各处理组GSH含量均比初始值高;CaCl2处理组桃果实中GSH含量在第28天达到最大,比此时对照组高44.3%;TFP处理组桃果实中GSH含量在贮藏21 d后显著低于对照组和CaCl2处理组(P<0.05)。如图8B所示,对照组和TFP处理组桃果实中GR活力总体呈逐渐上升趋势,CaCl2处理组在贮藏第28天时达到最大,随后下降;CaCl2处理组桃果实GR活力在贮藏后期显著高于对照组(P<0.05),整个贮藏期间TFP处理组GR活力低于对照组,但没有显著性差异。这表明CaCl2处理促进Ca2+-CaM复合体的形成,通过提高GR活力增加GSH含量,从而提高桃果实抗冷性;而TFP处理通过抑制Ca2+-CaM复合体的形成,抑制GR活力,减少GSH含量,从而加剧冷害对桃果实的伤害。
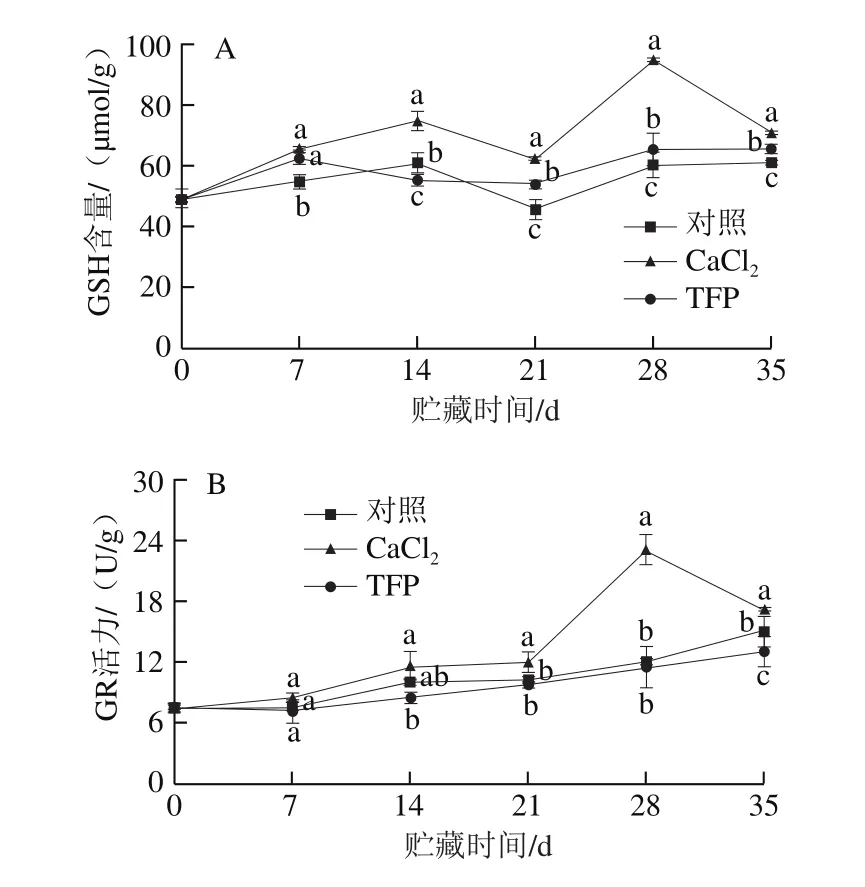
图8 钙和钙调素拮抗剂处理对桃果实冷藏过程中GSH含量(A)和GR活力(B)的影响Fig.8 Effects of calcium and trif l uoperazin treatments on GSH content (A)and GR activity (B) in cold-stored peach fruit
3 讨 论
近年来,对Ca2+-CaM复合体进行抗逆性研究多是利用添加外源钙和钙调素拮抗剂,如高洪波等[14]用Ca2+处理茄子幼苗,发现其有利于降低电解质渗透率和提高SOD等酶活力,而用钙调素拮抗剂W7处理效果则相反。张化生[28]研究发现分别用外源Ca2+和W7处理后的辣椒幼苗在可溶性蛋白、可溶性糖和脯氨酸含量方面的表现正好相反。本研究发现,Ca2+处理能有效抑制桃果实冷藏期间果心褐变的发生,保持果实硬度、TSS质量分数和VC含量,延缓果实软化衰老和果肉絮状败坏进程,对提高果实抗冷性有明显效果;而TFP处理加剧了桃果肉褐变程度,加速了果实的衰老和败坏,表明Ca2+-CaM复合体参与桃果实抵御低温的过程,且Ca2+-CaM复合体的形成有助于提高桃果实的抗冷性。
桃果实对低温极其敏感,一般情况下,由于长时间不适宜的低温(高于冰点温度)贮藏而引起冷害,造成果肉细胞生理失调,出现果心褐变、果肉絮败等典型冷害症状。冷害使果实细胞膜遭受破坏,影响活性氧自由基代谢平衡,产生大量的O2-·和H2O2,加剧细胞膜脂质过氧化作用和细胞质膜结构损伤,破坏膜区域化分布的体系,使膜透性上升,积累大量MDA[29]。VC-GSH循环是植物体内存在的重要抗氧化系统,它同其他活性氧清除系统协同作用从而清除植物体内积累的活性氧自由基。被光合作用还原的NADPH在GR作用下,能将氧化型谷胱甘肽还原为还原型GSH,从而经过一系列反应,最终达到清除活性氧自由基的目的[30]。本研究认为,Ca2+浓度的增加有助于保证植物细胞生物膜的完整性,维持活性氧代谢的平衡,减少膜脂过氧化的发生,从而抑制膜脂过氧化产物MDA的积累和电导率的上升,提高GR活力和GSH含量的积累,延缓H2O2含量和O2-·产生速率的增加。这些结果表明Ca2+-CaM复合体参与调节桃果实酶促褐变反应,通过保持细胞膜完整性,及时清除细胞内积累的活性氧自由基,从而控制桃果实褐变程度。
果实低温贮藏期间的冷害作用与体内的活性氧代谢失衡以及膜损伤密切相关。低温胁迫对桃果实细胞膜的结构和厚度发生变化有所影响,打破了细胞内自由基清除与产生之间的动态平衡,使组织衰老加剧。细胞内积累的O2-·、H2O2和羟自由基等会引起膜脂过氧化和脱脂化作用,引起蛋白质分子内和分子间的交联,破坏细胞膜的结构和功能[31]。果实的酶促系统由活性氧代谢酶类和产生抗氧化物质的相关酶组成,SOD、POD、CAT和APX是活氧代谢中的重要酶类。在植物抗氧化酶系统中,SOD能通过歧化反应将O2-·歧化成H2O2,是抵御活性氧的第一道防线,最大程度限制活性氧与H2O2形成羟自由基,减少因活性氧积累而对细胞膜系统造成的伤害[32];随后细胞内的H2O2又在CAT专一催化作用下将H2O2分解成H2O,最终变为O2;POD也能将H2O2分解为H2O和O2;APX能催化H2O2和VC反应,经VC-GSH循环将其分解成H2O,提高细胞抗氧化系统的还原势,从而减轻H2O2对细胞造成的氧化伤害。这3 种酶在植物体内相互协调,将植物体内积累的O2-·和H2O2及时分解清除,使活性氧含量处于较低水平,保持一种动态平衡,防止其对细胞的毒害[33-35]。Ca2+能够通过自身浓度的变化稳定双脂层的基本结构、减少膜损伤和渗透,对保持细胞膜完整性起着积极作用[31]。CaM是真核细胞内高度保守和广泛存在的一类重要的Ca2+受体蛋白,尽管它本身不具有活力,但能与Ca2+结合形成Ca2+-CaM复合体从而调节一系列靶蛋白的活性,对植物的生理功能进行调控。Ca2+与受体CaM结合后会引发如POD、SOD、APX、ATPase等酶活力增强以及内源保护性物质含量增加等与增强耐冷性有关的一系列生理反应[36-37]。
本实验结果表明,低温胁迫下桃果实体内活性氧代谢相关酶活力升高是对低温胁迫的一种自我应急反应,桃果实采后SOD、CAT和APX活力总体上呈现先上升后下降的趋势,Ca2+处理有效提高了桃果实较高的活性氧代谢相关酶(SOD、CAT、APX)活力,及时清除细胞内的O2-·和H2O2,维持果实在低温环境下的活性氧代谢平衡;而TFP处理使低温胁迫后的桃果实SOD、CAT、APX活力下降,积累大量的O2-·和H2O2。这表明Ca2+-CaM复合体的形成数量对活性氧代谢相关酶活力的调节程度有所不同,该复合体参与并调控桃果实的抗冷能力,这与张化生[28]的研究结果一致。本研究认为,Ca2+-CaM复合体在桃果实抗冷过程中通过调节活性氧代谢相关酶活力,从而调控桃果实的抗冷能力。添加Ca2+使类脂排列紧密,维持细胞膜的稳定性,增加了Ca2+-CaM复合体的形成数量,提高了活性氧代谢相关酶类对Ca2+-CaM复合体的亲和力;TFP则阻碍Ca2+-CaM复合体的形成,阻断由于外界刺激而产生的信号传递,影响细胞自身的生理调节。
脯氨酸是细胞内的渗透调节物质,对维持逆境胁迫下细胞的渗透平衡具有重要作用。P5CS和OAT分别是脯氨酸两条合成途径过程中的关键酶,而PDH是催化脯氨酸降解的一种酶,在这3 种酶的相互作用下,脯氨酸在植物体内的合成与降解形成一个动态的调节和控制[19]。本研究认为,Ca2+处理诱导了P5CS和OAT两者的活力,同时抑制了PDH的活力,从而增加了桃果实中脯氨酸含量的积累,而TFP处理则相反。这表明Ca2+-CaM复合体参与桃果实中渗透物质脯氨酸的调节和控制,进而影响冷藏桃果实的抗冷性。Ca2+-CaM复合体在冷害过程中的作用机制总结如图9所示。
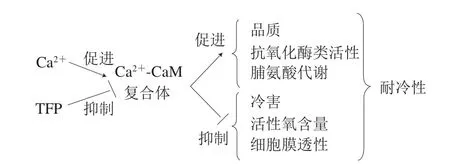
图9 Ca2+-CaM复合体在冷害过程中的作用机制Fig.9 A simpli fi ed hypothetical model for the mechanism of Ca2+-CaM complex in chilling injury
4 结 论
Ca2+-CaM复合体参与了桃果实的抗冷调节过程。Ca2+处理能有效缓解低温胁迫对采后桃果实的冷害,而TFP处理则加剧了这种伤害,说明Ca2+增强桃果实抗冷性的作用和增加Ca2+-CaM复合体的形成密切相关。TFP处理后,果实内Ca2+-CaM复合体形成受阻,导致其功能发生障碍,说明Ca2+-CaM复合体参与了桃果实抗冷过程,其信号转导途径受到限制,果实不能及时对低温胁迫的刺激作出有效反应,导致低温对桃果实进一步伤害。Ca2+-CaM复合体对低温胁迫下桃果实抗冷性具有调控作用,它通过调节低温胁迫下桃果实抗氧化系统,从而减轻桃果实的低温冷害,同时较好地保持了桃果实品质并延长了贮藏期。
