非梗阻性无精子症基因多态性分析研究*
2019-01-26周敬华韩瑞钰刘东科王树松
周敬华 韩瑞钰 默 义 刘东科 王树松
河北省计划生育科学技术研究院(国家卫计委计划生育与优生重点实验室)(河北石家庄 050071)
非梗阻性无精子症(non-obstructive azoospermia,NOA)是男性不育的重要原因之一。近年来,遗传因素在无精子症发病中的影响越来越受到人们的重视。目前已陆续发现了一系列原发性无精子症相关基因,提示了相应的人类同源基因极有可能与男性NOA显著相关。单核苷酸多态性(single nucleotide polymorphism, SNP)是人类基因组序列中最常见的一种变异形式,使造成不同个体罹患疾病的风险不同。因此,通过分子生物学手段发现NOA相关的潜在风险遗传因素,进一步揭示相关基因多态性与NOA的密切关系,可阐述疾病的致病机制。本研究采用实时荧光定量Taqman-MGB探针法对NOA患者进行了8个多态性基因位点的分布研究,以期为无精子症相关易感基因或其有效分子标记提供参考。
资料与方法
一、研究对象
本研究的研究方案通过河北省计划生育科学技术研究院医学伦理委员会。选自于2016年1月至2017年4月在本院就诊的NOA病例作为研究组,并且排除梗阻性无精子症、染色体异常、隐睾、病毒性睾丸炎、精索静脉曲张、垂体疾病以及全身性疾病等引起的继发性不育。NOA患者的诊断基于标准的临床检查程序, 包括病史、体格检查、精液分析 (3次检查精子浓度为零)、血清生殖激素分析、超声评价和遗传学检测(包括核型分析、Y 染色体微缺失检测等)。为了避免样本选择偏差,任何 NOA 患者含有核型异常、遗传学异常或 Y 染色体微缺失,均被排除。对照组选用有正常生育史的健康男性,年龄20~45岁。研究组和对照组均被告知研究目的、方法和意义,并签署知情同意书。
二、材料与试剂
离心柱型血液基因组DNA提取试剂盒(DP348-02,北京天根生化科技有限公司);TaqMan SNP基因分型试剂盒包括:2×TaqMan Universal PCR Master Mix(ABI 公司),40×SNP Genotyping Assay Mix(ABI 公司)。DNA 的浓度和纯度检测采用Nanodrop 2000 超微量分光光度计(美国 Thermo Scientific公司)将浓度和纯度满足要求的DNA溶液(OD260/OD280值1.6~2.0、质量浓度1~20ng)保存于-80℃超低温冰箱中备用。
三、全血基因组DNA的提取
采集2mL外周静脉血于EDTA抗凝管中,放置于-20℃冰箱保存备用。全血基因组DNA提取按照试剂盒说明书进行,并用TE溶解。
四、检测基因多态性
候选 SNPs 位点具体基本信息见表1。PCR终反应体系(10μL)见表2。在ABI 7500型Fast Realtime PCR仪中进行DNA扩增反应。PCR反应条件如下:60℃,1min(预加热)→95℃,10min(预变性)→95℃,15s(变性)→60℃,1min(收集荧光),变性、收集荧光进行40个循环,最后在60℃收集荧光1min。为保证实验结果的准确性,每次加样设置一个阴性对照(NTC),加样品的过程中需严格避光,以免探针及相关试剂降解失效。反应完成后, 在 ABI 7500 型荧光定量 PCR 仪上读取样品孔中的终点荧光,利用TaqMan Genotyper Software Version 1.0.1分析软件确定各个样本的基因分型结果。

表1 TaqMan®-MGB 探针基本信息表

表2 TaqMan®-MGB 探针法RT-PCR 反应体系
五、基因型分析
本实验根据ABI公司试剂盒信息,对多态性位点分型时设定等位基因对应FAM荧光为Y轴,VIC荧光为X轴,基因型分型采用双验证的方法,即散点图+扩增曲线两方面验证,以确保基因分型准确无误。
六、统计学分析
利用SPSS 19.0进行统计学分析,SNP多态性位点在两组间的分布差异利用Chi-square检验和Fisher exact检测。 此外,比值比(OR)及95%可信区间(95% CI)利用非条件Logistic回归模型计算。以P<0.05为差异有统计学意义。
结 果
一、研究对象
1 9 2例N O A患者作为研究组,平均年龄(30.08±5.38)岁;124例正常健康男性作为对照组,平均年龄(32.05±5.97)岁。两组间年龄比较,差异无统计学意义(P>0.05)。
二、基因型频率与NOA易感性之间的关系
研究组与对照组中TEX15基因rs323346位点各基因型分别为TT 85.42% vs76.61,CT 13.54%vs 21.39%,CC1.04% vs 0%,两组基因型构成比具有统计学差异(P<0.05)。与TT基因型相比,携带CC基因型的个体患NOA的风险是其1.745倍,携带CC+CT基因型的个体患NOA的风险较携带TT型的个体低(P<0.05,OR=0.559,95%CI=0.314~0.996)。其余多态性位点在两组中各基因型的分布没有统计学意义。8个SNP多态性位点基因型频率的分布及其与研究组易感的相关性结果见表3。
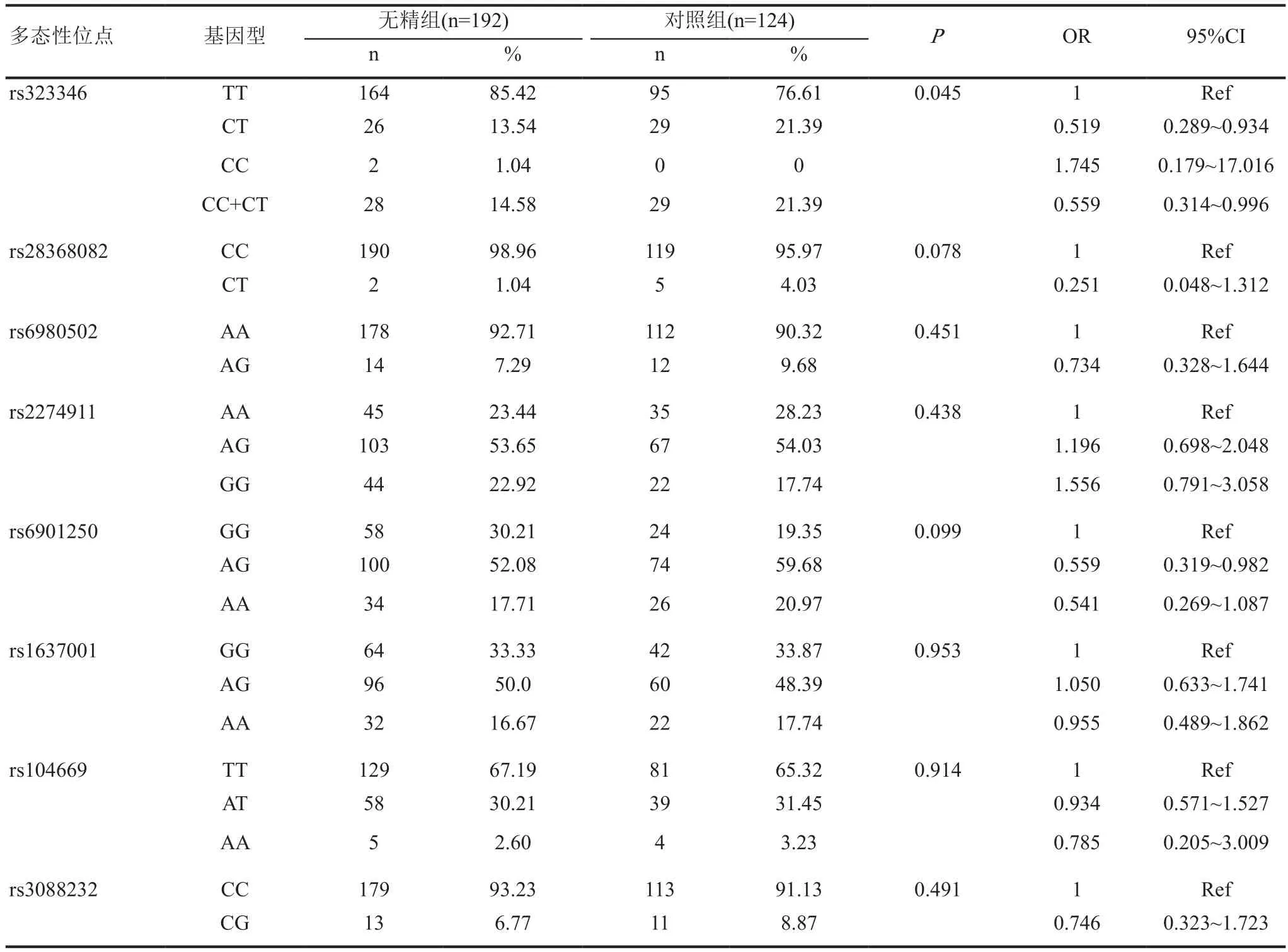
表3 多态性位点基因型频率与NOA易感性之间的关系
三、等位基因频率与NOA易感性之间的关系
经统计学分析,结果显示所测 8个位点等位基因频率分布在研究组和对照组中比较,差异无统计学意义(P>0.05),见表4。

表4 多态性位点等位基因频率与NOA易感性之间的关系
讨 论
无精子症可分为梗阻性无精子症和NOA。梗阻性无精子症主要原因包括先天性发育异常、精索静脉曲张和生殖道感染等, 其约占无精子症患者的 40%[1]。遗传因素是导致NOA发生的主要原因,如染色体核型异常、Y染色体微缺失[2]、基因突变与缺失以及基因的单核苷酸多态性等[3,4]。一些遗传学研究通过现代核酸测序技术和大规模的基因探针,发现导致 NOA 疾病新的易感基因。但是,仍然有超过 50% 的无精子症的致病因素不可知[5]。近年来,人们一直在寻找与精子发生和生精障碍相关的基因突变、缺失或单核苷酸多态性[6]以期能更好地阐述疾病的致病机制。已证实,特定基因的单核苷酸多态性改变与临床上的原发性无精子症存在关联[7-9]。
TEX15 (testis-expressed 15)基因定位于人类染色体8号染色体上,仅仅在睾丸和卵巢中表达[10],TEX15 转录物存在于精原细胞和初级精母细胞中,在调控DNA 断裂双链上染色体联会、DNA 双链修复和减数分裂重组过程中起着重要的作用。对欧洲人群研究显示 TEX15 基因 rs323344 和 rs323345 多态性在NOA、严重少精子症、中度少精子症患者与正常生育对照人群存在着差异[11],而Ruan等[12]则认为rs323346显著增加了罹患严重少精子症的风险,但未发现与无精子症患病的风险显著相关。我们的结果显示在NOA组中与对照组中TEX15基因rs323346位点各基因型分布具有统计学差异(P<0.05)。与TT基因型相比,携带CC基因型的个体患NOA的风险是其1.745倍,携带CC+CT基因型的个体患NOA的风险较携带TT型的个体低(P<0.05,OR=0.559,95%CI=0.314-0.996)。而rs6980502位点基因型频率以及等位基因频率则没有明显差异。
GPRC6A为G蛋白偶联受体(G protein-coupled receptor, family C, group 6, type A, GPRC6A)位于6q22.31,在脑、骨骼肌、睾丸和白细胞高表达[13,14]。有研究[15]认为GPRC6A基因rs2274911多态性被证实与睾丸损伤有关,rs6901250组成的单体型频率在前列腺癌患者明显升高。SP011基因定位于20q13.2-13.3,系减数分裂相关基因,所编码的蛋白质在减数分裂染色体断裂重组中发挥着重要的作用,已有研究表明SP011基因可能是一个不育易感基因[16]。冯战启等[17]研究发现SP011基因rs28368082位点是原发性不育患者的遗传易感因素。RNF8 基因位于人类染色体 6p21.2上,是一种组蛋白泛素化的 E3 连接酶。在精子形成阶段,包裹精子 DNA 的组蛋白由组蛋白类似的鱼精蛋白代替,而这种转变由 RNF8 依赖性组蛋白泛素化所引起的[18,19]。RNF8基因rs104669等位基因频率在NOA患者组和对照组间显示有显著性差异,可以增加罹患 NOA 风险[20]。睾丸特异性含溴结构域的蛋白(testis-specific bromodomain-containing protein,BRDT)是BET蛋白家族的成员,在精子发生过程的核染色质重组中起关键作用[21]。对不育男性全基因组分析表明 BRDT 的单核苷酸多态性与欧洲男子的少精子症和无精子症相关[22]。卵丘细胞中的 STAG3是参与卵母细胞第一次减数分裂的一种调节蛋白,而Llano等[23]最新发现STAG3是人类男性不育一个强有力的候选基因。我们的结果显示GPRC6A基因rs2274911, rs6901250;SPO11 基因rs28368082;RNF8基因rs104669;BRDT基因rs3088232和STAG3基因rs1637001位点基因型频率和等位基因频率在NOA组和对照组中差异均无统计学意义。
造成研究结果有差异的原因可能是基因多态性与精子发生障碍易感性在不同种族或地域人群中存在的机制目前尚不清楚,并且已有大量报道表明,种族因素、不同的地理及环境条件,可能会造成遗传学基础的差别,进而导致在精子发生障碍患者中存在不同的发病机制。因此,推测本研究结果与上述研究的结果不同可能是由于研究人群的遗传学背景或者地理区域不同有关。另外,由于受样本量限制,要使结果更具有说服力,需要扩大样本量进一步验证基因多态性与NOA的关系。
目前,研究基因多态性的方法逐渐增多,但许多方法由于其自身方法学特点存在着各自的优缺点,比如PCR-限制性片段长度多态性、等位基因特异性PCR,这些方法由于均需先经过PCR扩增,扩增产物再经琼脂糖凝胶电泳后才能区分基因型,虽然过程操作不复杂,实验成本也偏低,但其在灵敏度方面和操作时间上都处于劣势,且实验过程易受污染,结果出现假阳性或假阴性。相比之下,基因碱基序列测序则显得较为精确和可靠,但它需DNA测序仪等昂贵仪器,并且对测序标本要求严格,而Taqman-MGB法则利用MGB探针标记不同基因型的探针,整个实验过程在实时荧光定量 PCR仪中完成,无需电泳等后处理,在特异性和灵敏度上也优于其他[24]。
本文首次应用Taqman-MGB法检测了SPO11 基因rs28368082,TEX15基因rs323346,rs6980502;STAG3基因rs1637001;GPRC6A基因rs2274911,rs6901250;RNF8基因rs104669;BRDT基因rs3088232位点,共8个多态性基因位点的分布频率。结果显示TEX15基因rs323346多态性位点与NOA发病风险存在关联,可能是NOA的遗传易感基因之一。
