环糊精双功能单体分子印迹聚合物的制备与性能评价
2019-01-25于海宁黄海勇何成自菁素维查沈生荣
于海宁,黄海勇,何成自菁,素维查,沈生荣*
(1.浙江工业大学药学院,杭州310032;2.浙江大学生物系统工程与食品科学学院,杭州310058)
邻苯二甲酸酯常被用作塑料添加剂,增加聚氯乙烯塑料制品的透明度、耐久性和寿命,被用于食品包装材料、医疗器械、玩具等中。邻苯二甲酸二异辛酯[di(2-ethylhexyl)phthalate,DEHP]和邻苯二甲酸二丁酯(dibutyl phthalate,DBP)是使用最广泛的塑化剂。根据动物模型的毒理学结果,塑化剂具有致癌[1-3]、造成激素失调和生殖障碍等毒性[4-6]。当前,塑化剂容易被滥用,用于代替传统昂贵的乳化剂(如棕榈油)而被添加到食品中。因此,建立快速有效的塑化剂选择性识别和吸附方法具有重要的实际意义。
分子印迹聚合物(molecularly imprinted polymer,MIPs)能选择性吸附目标分子,可进行化学分离和分析,已被广泛应用于传感器、对映体分离、生物医学和分析应用等方面[7],具有高稳定性、耐久性、可靠性及生产成本低廉等优点。参与MIPs形成的主要成分是模板分子、功能单体和交联剂。在过去的研究中,有研究者将β-环糊精(β-cyclodextrin,β-CD)及其衍生物选为单功能单体[8-10]或双功能单体之一[11]。其中,双功能单体合成的MIPs对目标分析物具有更好的特异性吸附效果[12]。
本文以DEHP为模板,以烯丙基-β-环糊精(allyl-β-cyclodextrin,allyl-β-CD)为单功能单体,或分别将allyl-β-CD与甲基丙烯酸(methacrylic acid,MAA)、甲基丙烯酸甲酯(methyl methacrylate,MMA)、丙烯腈(acrylonitrile,AN)、丙烯酰胺(acrylamide,AA)结合作为双功能单体,以二甲基丙烯酸乙二醇酯(ethylene glycol dimethacrylate,EGDMA)作为交联剂,制备出一系列DEHP印迹聚合物,并用于奶粉中DEHP含量测定(DEHP及其类似物的化学结构如图1所示),通过分子印迹固相萃取-高效液相色谱法(molecular imprinting solid-phase extraction-high performance liquid chromatography,MISPE-HPLC)测定其回收率,旨在对所制备的MIPs的选择性结合能力进行评估。
1 材料与方法
1.1 材料
邻苯二甲酸二异辛酯(DEHP,99%)、邻苯二甲酸二异壬酯(diisononyl phthalate,DINP,99%)、邻苯二甲酸二甲酯(dimethyl phthalate,DMP,99%)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、β-环糊精(β-CD,96%)、烯丙基溴(98%)、甲基丙烯酸(MAA,99%)、甲基丙烯酸甲酯(MMA,99%)、二甲基丙烯酸乙二醇酯(EGDMA,98%)、偶氮二异丁腈(azodiisobutyronitrile,AIBN,99%)、二甲基甲酰胺(dimethylformamide,DMF,99.5%)和异丙醇(isopropanol,IPA,99.5%),均为分析纯,购自阿拉丁试剂(上海)有限公司。
丙烯腈(AN,99%)、丙烯酰胺(AA,99%)和色谱纯甲醇,分别购自Gracia化学科技(成都)有限公司、合肥Biosharp有限公司和天津Sayfo科技有限公司。用于分子印迹聚合物合成和高效液相色谱流动相的超纯水,由实验室水净化系统(上海华膜实业有限公司)制得。
β-CD和AIBN试剂分别用水和甲醇重结晶。重蒸馏的MAA、MMA、AN功能单体和已制备好的DEHP原液(1 mmol/mL,溶于色谱纯甲醇中)在MIP本体聚合前存储于4℃冰箱中,备用。

图1 DEHP及其类似物的化学结构Fig.1 Chemical structures of DEHP and its analogues
1.2 仪器与设备
安捷伦1200 HPLC系统:配有紫外可见可变波长检测器(225 nm)、G1312B双泵、G1322A脱气器、SL型自动进样器,温控室;采用C18反相色谱柱(250 mm×4.60 mm×5µm);流动相中V(甲醇)∶V(异丙醇)∶V(水)=250∶100∶50;流速1 mL/min,控制温度30℃,注入体积10µL,运行时间6 min。
1.3 allyl-β-CD的制备
烯丙基溴和β-CD的反应如下:将20 g氢氧化钠(NaOH)溶于20 mL水中,不断搅拌直到完全溶解;加入20 g β-CD,在60℃水浴锅中搅拌2 h;加入4 mmol烯丙基溴,通氮气,连续搅拌2 h,内部温度为60℃;将溶液水浴30 min,再置于60℃烘箱中干燥3 d,获得干燥的反应混合物。用研钵和研杵粉碎并研磨成细粉,用无水乙醇洗5次,每次5 min,以减少产品的残留物。
1.4 MIPs的制备
将2.8 g allyl-β-CD溶解在40 mL DMF中,30 min后添加2 mmol DEHP,通氮气,60℃下磁搅拌2 h;分别加入12 mmol功能单体(MAA、MMA、AN、AA),反应1 h;加入60 mmol EGDMA反应1 h,再加入40 mg AIBN作为引发剂;约30 min后生成固态反应混合物,60℃水浴孵化24 h;取出固体,放入烘箱中干燥2 d。将干燥后的样品粉碎并研磨成粉末,过400目筛;收集微粒,用热水清洗,再用V(甲醇)∶V(乙酸)=9∶1进行索氏提取,直到用紫外可见分光光度仪检测不到DEHP;最后用甲醇洗净MIPs,去掉残留乙酸。M-MAA制备示意图见图2。非印迹聚合物(non-imprinted polymers,NIPs)除了不添加模板,制备条件与MIPs相同。
1.5 溶剂对吸附的影响试验
将不同体积比的甲醇和水(10∶0、9∶1、8∶2、7∶3、6∶4、5∶5)作为MIPs和NIPs吸附测试的溶剂,先混合甲醇与DEHP,涡旋混匀,再加入水。与其他研究多使用MAA作为功能单体制备MIPs[13-16]不同,本试验选用MAA-allyl-β-CD双功能单体分子印迹聚合物(M-MAA)为模型,评估其在不同溶剂中吸附DEHP的强度。
将20 mg聚合物悬浮在3 mLDEHP(1 mmol/L)溶液中,于10 mL锥形瓶里以130 r/min振荡,控制温度为30℃。分别悬浮1、3、6、9、12 h后,用0.22µm过滤器过滤,取1 mL过滤液用于高效液相色谱分析。聚合物吸附物质比例的计算公式如下:
吸附百分比=[(初始值-吸附后的游离值)/初始值]×100%。
1.6 特异性吸附试验

图2 M-MAA制备示意图Fig.2 Schematic representation for preparation of DEHP-imprinted polymer made of MAA-linked allyl-β-CD(M-MAA)
检测所有合成的MIPs和NIPs在溶剂中对目标分子的吸附能力,达到吸附平衡时,聚合物对模板分子的吸附量(Q,µmol/g)计算公式[13]如下:

式中:V为溶液体积,mL;Ci为初始浓度,µmol/mL;Ca为吸附后的游离浓度,µmol/mL;m为聚合物的干燥质量,g。
DEHP的分布系数(Kd)方程[17]为,用于分析其在聚合物和溶液之间的亲合力。
特异性吸附能力公式为ΔQ/(µmol/g)=Q(MIPs)-Q(NIPs),用于计算MIPs和NIPs吸附值的差异。
分子印迹因子(IF)的计算公式为IF=K(dMIP)/K(dNIP),用于验证印迹结果。
1.7 动力学吸附和竞争性吸附试验
为研究聚合物对不同浓度(0.10~1.00 mmol/L)模板分子的吸附效果,将20 mg聚合物悬浮在3 mL DEHP溶液中,于10 mL锥形瓶里以130 r/min振荡,温度30℃。将DEHP的一系列结构类似物(包括DMP、DEP和DINP)在相同条件下进行测试,以确定聚合物的竞争吸附能力和效率,以及对结构相关成分的功能性识别,溶液浓度均为1 mmol/L。
1.8 基于分子印迹固相萃取的印迹效果验证试验
1.8.1 结合吸附
将50 mg聚合物放入移液管,塞上棉花,再在顶部放一层石英晶体砂。在加载样品前,用3 mL甲醇和3 mL水对聚合物进行预处理。制备浓度为0.1 mmol/L DEHP的甲醇标准溶液。将1和3µmol DEHP分别装入微型柱中,然后添加1 mL甲醇、1mL水。每个样品中加入4 mL吸附溶剂。用6 mL含10%甲醇的水淋洗,以除去所有DEHP溶液中未被吸附的成分。再用5 mL体积比为9∶1的甲醇-乙酸溶液洗脱,移除模板分子。不断地将洗脱液收集到试管中,用氮气吹干,然后用1 mL甲醇重新溶解,进行高效液相色谱分析。洗脱溶剂通过柱子的流速为0.5 mL/min。
1.8.2 竞争性吸附
DEHP及其结构类似物(DMP、DEP和DINP)被混合于甲醇溶液中,最终浓度为40µmol/mL。按照1.8.1所述方法,测定聚合物对DEHP及其结构类似物的吸附能力。
1.8.3 奶粉样本分析
牛奶在通过挤奶机时可能被酯类污染,因此从超市购买了一种商业品牌婴儿配方奶粉作为样品。奶粉脂肪分离主要基于之前的研究[18],并做了一些调整:准确称量1 g婴儿配方奶粉,放入50 mL聚丙烯离心管中,加入10 mL甲醇后,用旋涡式搅拌器混合15 min,然后添加0.5 g氯化钠,再次均质,超声10 min,接着以3 500 r/min离心10 min,最后将收集到的上层清液移入试管中直接加载,或储存于4℃冰箱中,备用。将样品按照1.8.1的方法,采用50 mg聚合物的微型柱进行分离和6 mL洗脱液解吸。回收率用添加不同质量浓度DEHP标准溶液(100、200、300、400 ng/mL)的婴儿奶粉来评估,空白对照除了未添加DEHP标准溶液外,其余采用相同的样品制备过程。回收率(R,%)的计算公式如下:
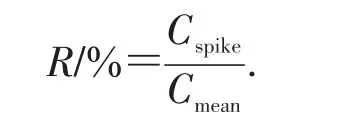
式中:Cmean表示检测出的质量浓度均值;Cspike表示添加的质量浓度。
1.8.4 MIPs重复利用稳定性分析
配置1和5µg/mL DEHP,按照1.8.1的方法进行反复吸附和洗脱,每个质量浓度测试10次,计算回收率,以检测MIPs的重复利用稳定性。
1.9 计算模拟
allyl-β-CD为所有制备的双功能单体中的一个共有单体,本试验计算了不同第二功能单体——甲基丙烯酸(MAA)、甲基丙烯酸甲酯(MMA)、丙烯腈(AN)和丙烯酰胺(AA)与模板分子的相互作用。在计算机上运行Gaussian09软件,采用量子化学半经验方法对模板分子和功能单体进行结构优化,寻找能量最低的构象,并计算各自的能量水平;再模拟第二功能单体与模板分子复合物的最低能量构象,计算模板分子与功能单体之间的相互作用结合能(ΔE),从计算机模拟角度对不同印迹聚合物的吸附效果差异做出解释。计算公式如下:
ΔE=E(模板分子-功能单体复合物)-E(模板分子)-E(功能单体)。
2 结果与分析
2.1 结合试验
2.1.1 溶剂的影响
分子印迹的特异性识别功能主要依靠以下2个因素实现:一是印迹腔的大小、形状与官能团精确互补;二是模板分子与功能单体之间形成的疏水作用力和氢键(图2)。溶液中的水能够增加MIP和模板分子之间的疏水作用力,但是DEHP在水中的溶解性差,所以需要筛选甲醇和水的比例来确定最佳的结合效果。从图3中可以看出,吸附溶剂中水和甲醇的体积比达到均衡水平(5∶5)时,吸附量最高。这也与之前的研究[10,12,19]相一致。因此,M-F(水和甲醇的体积比5∶5)被认为是最佳溶剂,被选用来进行后续的研究。此外,由于悬浮时间对印迹聚合物的吸附作用无显著影响,因此,聚合物悬浮1 h足以产生最优结果。
2.1.2 特异性吸附
平衡吸附试验中结合到不同MIPs和NIPs上的底物量如表1所示。Kd值越高,聚合物的作用就越大。结果显示,MIPs在各个方面都比NIPs有更强的亲合力,包括Q、Kd、ΔQ和IF,表明合成的NIPs不具备印迹空穴。在各种MIPs中,AA-allyl-β-CD双功能单体分子印迹聚合物(M-AA)的吸附量最小(≤47µmol/g),说明AA功能单体相比其他功能单体,在聚合物网络中没有形成强烈的氢键和疏水作用。AA功能单体在其他文献中也被报道只有较弱的作用[12,20]。尽管allyl-β-CD MIPs(M-β-CD)的吸附量≤94µmol/g,约为M-AA的2倍,但仍显著低于M-MAA、MMA-allyl-β-CD双功能单体分子印迹聚合物(M-MMA)和M-AN的值。因此,当MAA、MMA和AN单体与allyl-β-CD单体共同构成双功能单体时,吸附能力提高。M-MAA、M-MMA和M-AN的平均吸附量(Q)为110µmol/g,而M-β-CD和M-AA分别为90和40µmol/g。
2.1.3 动力学吸附和竞争性吸附
在上述结果的基础上,对M-MAA、M-MMA和M-AN这3种印迹聚合物进行进一步研究。采用不同浓度(0.10~1.00 mmol/L)的 DEHP测试MIPs和NIPs对目标分子的结合能力。对聚合物在溶液中悬浮1 h的吸附量测定的结果表明:MIPs和NIPs都显示出很好的响应值;模板的初始浓度越高,聚合物的吸附量就越大(图4);3种印迹聚合物的吸附效果类似,但它们都显著高于非印迹聚合物。
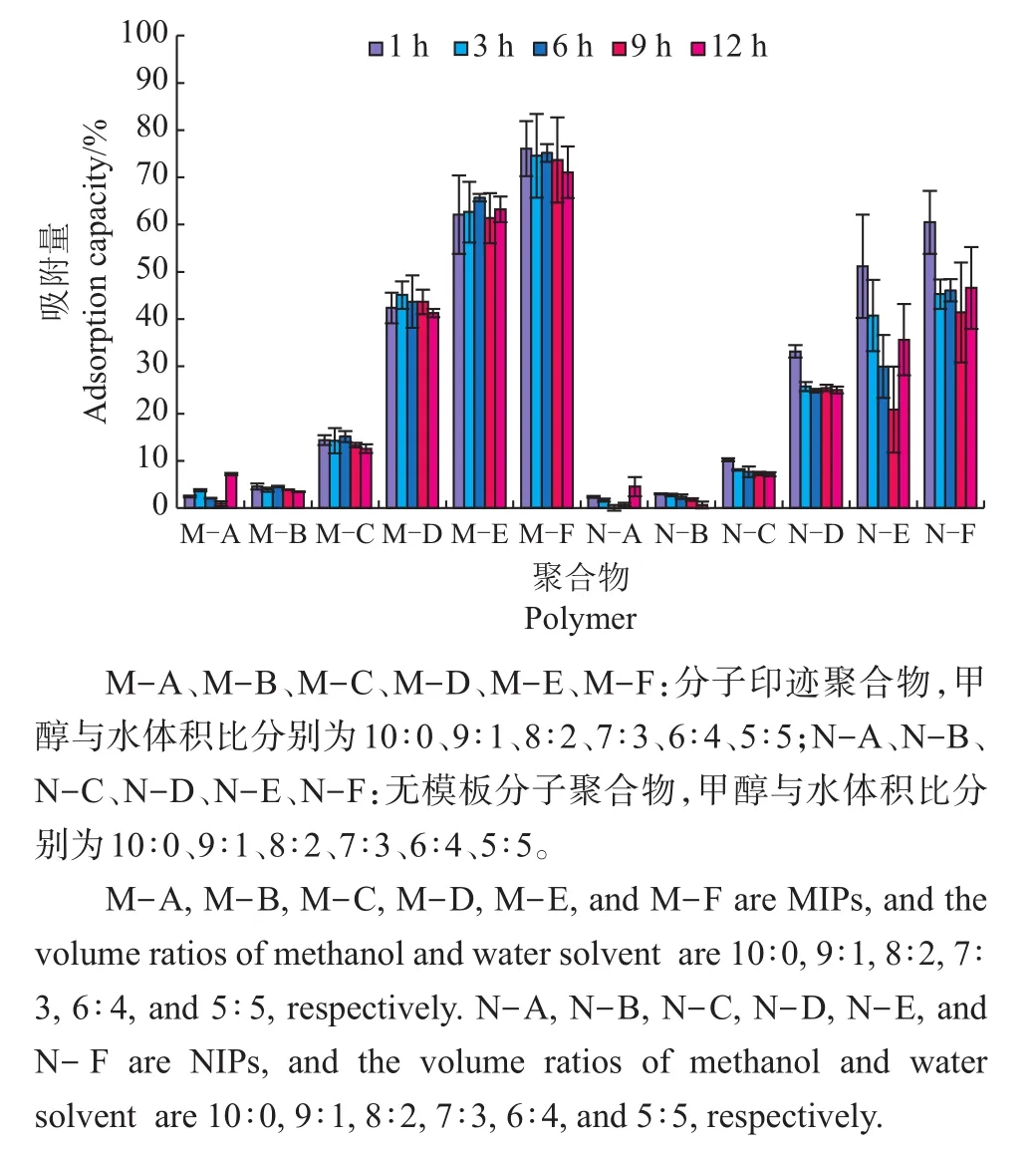
图3 溶剂对吸附的影响Fig.3 Influence of solvent on adsorption

表1 不同功能单体制备的聚合物对DEHP的吸附量*Table1 Recognition of DEHP amount uptake on the polymers prepared with different functional monomers*
2.1.4 MISPE过程
2.1.4.1 结合吸附结果
通过MISPE方法测定的MIPs和NIPs结合吸附百分比如图5所示。结果表明,当底物的量为1µmol时,M-AN、M-MMA和M-MAA的结合吸附百分比分别为96%、94%和92%,而N-AN、NMMA、N-MAA的结合吸附百分比分别为94%、86%和91%。但当上样量增加到3µmol时,M-AN、M-MMA和M-MAA的结合吸附百分比则要明显高于N-AN、N-MMA,N-MAA的,这表明上样量增大时,用MIPs比NIPs具有更强的吸附能力。另外,在比较这3种聚合物的结合吸附百分比时,发现虽然所有类型的MIPs都显示出强烈的亲合力,但是M-AN无论在上样量为1µmol还是3µmol,其平均结合吸附百分比都十分接近,所以M-AN在这3种聚合物中有更稳定的吸附能力。
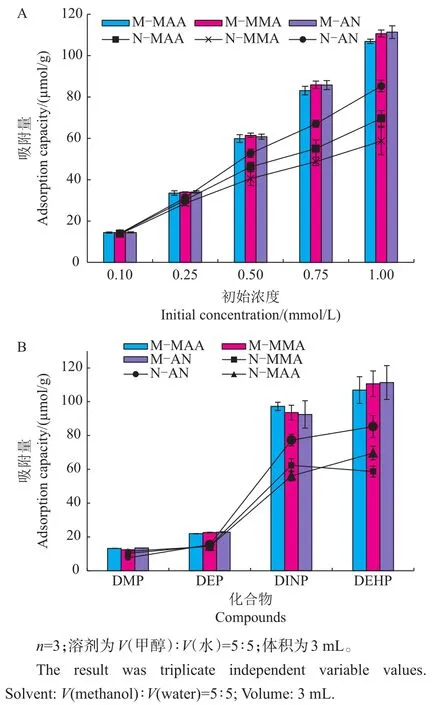
图4 动力学吸附(A)和MIPs、NIPs的竞争性吸附(B)Fig.4 Adsorption dynamics(A)and competitive binding selectivity of the MIPs and NIPs(B)
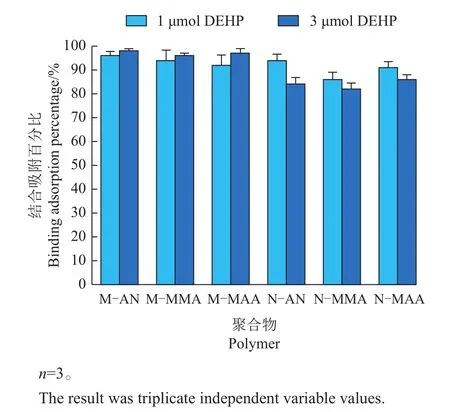
图5 DEHP和MIPs的结合吸附百分比Fig.5 Percentage of binding adsorption of DEPH and MIPs
2.1.4.2 竞争性吸附结果
根据图5的结果可知,相较于M-MMA、MMAA,M-AN在不同上样量中有着更稳定的吸附能力,所以选择M-AN和N-AN的高效液相色谱图进行讨论。对比图6A和图6B发现,混合溶液中的DMP和DEP在吸附结束后的洗涤过程中几乎全部都被洗掉了,这说明DMP和DEP与M-AN结合作用非常弱;而DEHP在吸附过程中几乎被完全回收,证明M-AN对模板有很高的选择性,其选择吸附能力很强。此外,通过计算得到,M-AN对DEHP、DINP、DEP和DMP的结合吸附百分比分别为97.98%、90.22%、11.55%和10.83%,这说明模板的形状、大小和功能结构会对聚合物的吸附能力和识别能力产生影响。另外,MISPE法和悬浮法的数据都表明MIPs比NIPs有更高的吸附量。
2.1.4.3 样品测试结果
用甲醇稀释储备溶液,得到质量浓度为2.5×10-3、5.0×10-3、0.1、0.2、0.4、0.6、0.8、1.0 µg/mL的标准溶液。以色谱峰面积为纵坐标,标准溶液质量浓度为横坐标,建立标准曲线。标准溶液检测3次,得到了良好的线性回归方程和相关系数(y=9.154x+1.923,r=0.998)。基于信噪比3∶1和10∶1,检测极限(limit of detection,LOD)和定量极限(limit of quantification,LOQ)分别为0.045和0.139µg/mL,此灵敏度可有效地测定目标基质中的微量残留。使用3种添加不同质量浓度的DEHP(n=3,100~400 ng/mL)的婴儿配方奶粉进行试验,平均回收率为89.06%~97.98%,样本分析中相对标准偏差低于6.47%。同时,采用1和5µg/mLDEHP进行反复吸附和洗脱,发现被测的MIPs可被重复利用,且几乎没有质量损失(回收率为92.13%~98.32%;相对标准偏差为1.14%~4.70%),表明MIPs具有较好的稳定性。

图6 高效液相色谱图Fig.6 High performance liquid chromatograms
2.2 计算机建模
图7和图8分别为模板、功能单体及DEHP和每个第二功能单体之间形成的复合物的优化结构。从表2中可发现,ΔE(MAA-DEHP)<ΔE(ANDEHP)<ΔE(MMA-DEHP)<ΔE(AA-DEHP)。根据ΔE越小,模板分子与功能单体之间的结合能力越强的原则,表明MAA和AN有最强的结合能力,AA结合能力最弱。由此推测,结合allyl-β-CD、MAA和AN最有效,而AA作用最弱。单功能单体分子印迹聚合物由于只有allyl-β-CD与模板分子作用,少了第二功能单体的作用,因此吸附力弱于双功能单体分子印迹聚合物。

图7 模板和功能单体优化后的结构Fig.7 Optimized structures of the template and functional monomers
3 讨论
在本研究中,将不同体积比例的水与甲醇作为溶剂的组成部分来评估水对聚合物吸附DEHP的影响,结果表明:水产生的疏水作用在β-CD MIPs的识别过程中扮演了重要的角色;由于分析物为非极性,不溶于水,因此在制备吸附溶剂的过程中,选择水体积≤甲醇体积。
分子结构对MIPs的识别能力起到了基础性作用。分子结构的不同直接造成了MIPs对其吸附能力的差别,且不同分子之间结构差异越大,MIPs的选择性吸附能力也越强。所以,DMP和DEP的结构与DEHP的差异大,使得MIPs吸附这2种物质的能力就差。而DINP和DEHP的分子结构非常相近,会与一部分MIPs的空穴进行互补,所以它的吸附百分比也能达到90%以上。结合所有数据发现,所有类型的MIPs的选择吸附能力均强于NIPs,这表明MIPs是具有更高选择能力的吸附剂。
在MISPE过程中MIPs和NIPs的吸附量并没有产生统计学上的差别,但是在相同上样浓度(0.10 mmol/L)时,用MISPE法测得的吸附量与悬浮方法相比有显著差异,这可能是由于在MISPE法中使用的MIPs颗粒较悬浮法多。这也说明当聚合物颗粒增多时,更多的底物会被吸附到MIPs和NIPs上,即聚合物颗粒越多,其结合位点就越多。
将本文检测邻苯二甲酸酯的MISPE-HPLC方法与其他已报道的方法比较(表3)发现:本试验方法的LOD高于文献报道。这可能是由于质谱(mass spectrometry,MS)或火焰离子化检测器(flame ionization detector,FID)的匹配问题,但其检测结果仍低于美国食品与药物管理局规定的邻苯二甲酸酯耐受极限(成人3.5µg/mL,新生儿和婴儿0.3µg/mL)。对回收率的比较分析发现,本试验方法与其他方法无显著性差异。
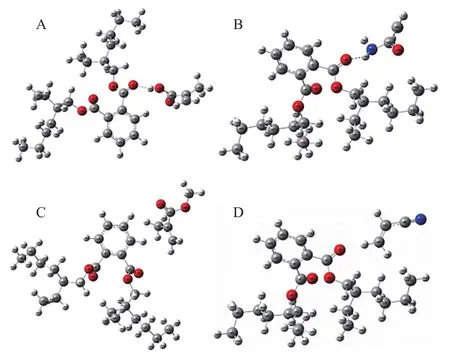
图8 DEHP与MAA(A)、AA(B)、MMA(C)、AN(D)形成的复合物优化后的结构Fig.8 Optimized structures of the complex formed by DEHP with MAA(A),AA(B),MMA(C),AN(D),respectively

表2 能量计算值Table2 Value of the calculated energy

表3 邻苯二甲酸酯的不同测定方法比较Table3 Comparison of different methods for determination of phthalates
4 结论
本研究采用本体聚合法制备了多种基于allylβ-CD功能单体的DEHP印迹聚合物。结果表明:吸附溶剂中含有更多的水,会诱发更多的模板材料吸附到印迹聚合物上;双功能单体MIPs(M-MAA、M-MMA和M-AN)的吸附能力优于单功能单体MIPs(M-β-CD);双功能单体MIPs的平均吸附量为110 µmol/g,单功能单体MIPs则为90 µmol/g。M-AN比M-MAA和M-MMA的吸附量略高,三者均具有较强的吸附力,在竞争性吸附试验中,它们可以区分模板分子与其结构类似物,并且高度优于M-AA和M-β-CD。将M-MAA、M-MMA和MAN作为分子印迹固相萃取(MISPE)的固定相,分析婴儿配方奶粉中的DEHP,其回收率范围为89.06%~97.98%,相对标准偏差≤6.47%,说明它们可用于实际样品分析。总之,本文制备的双功能单体的选择性识别吸附能力优于单功能单体,能有效分离疏水性分子,且所用有机溶剂少,材料成本低,容易获得,具有较好的利用前景。
