DPP-4抑制剂与α糖苷酶抑制剂治疗2型糖尿病比较的Meta分析
2019-01-24高倩章文俊金华伟
高倩 章文俊 金华伟
近30年来,我国糖尿病患病率显著增加。2010年流行病学调查显示,我国成人糖尿病患病率为9.7%。二肽基肽酶-4(DPP-4)抑制剂(DPPIs)是一类治疗 2 型糖尿病相对较新的药物,目前上市及处于临床研究阶段的DPPIs有西格列汀、维格列汀、阿格列汀、沙格列汀、利格列汀、利拉利汀、吉格列汀、特力利汀及奥玛格列汀[1-3]。DPPIs通过抑制DPP-4而抑制内源性胰高血糖素样肽-1在体内失活,使内源性胰高血糖素样肽-1水平升高[4]。DPPIs还能以葡萄糖浓度依赖方式促进胰岛素分泌,抑制α细胞分泌胰高血糖素[5-6]。美国糖尿病协会(ADA)、欧洲糖尿病研究协会和中国糖尿病协会已经推荐DPPIs作为治疗2型糖尿病的二线药物[2,7]。α糖苷酶抑制剂(AGIs)通过抑制碳水化合物在小肠上段的吸收而降低餐后血糖[8]。目前上市的AGIs有阿卡波糖、伏格列波糖及米格列醇。中国指南推荐AGIs作为治疗2型糖尿病的一线备选药物及二线药物[7]。目前研究显示DPPIs和AGIs均能有效降低血糖,且两者低血糖发生率均较低[9]。为了给临床治疗提供新的循证医学证据,本研究采用系统评价和Meta分析的方法,对DPPIs与AGIs治疗2型糖尿病疗效和安全性进行比较,以期为临床实践提供决策参考。
1 资料和方法
1.1 资料来源和检索策略 使用主题词和自由词检索PubMed、EMbase、The Cochrane library、CNKI、WanFang Data和VIP数据库,检索时限从建库至2017年7月,搜集DPPIs与AGIs治疗2型糖尿病的相关随机对照试验(RCT)。同时,追溯纳入文献的参考文献,以补充获取相关文献。中文检索词包括:二肽基肽酶-4抑制剂/西格列汀/维格列汀/阿格列汀/沙格列汀/利格列汀/利拉利汀/特力利汀、α糖苷酶抑制剂/阿卡波糖/伏格列波糖/米格列醇、2型糖尿病/糖尿病,英文检索词包括:Type 2 Diabetes Mellitus/NIDDM/diabetes mellitus、acarbose/voglibose/miglitol/alpha-glucosidase inhibitors、sitagliptin/vildagliptin/saxagliptin/alogliptin/linagliptin/gemigliptin/teneligliptin/DDP-4 inhibitors。
1.2 文献纳入标准和排除标准 纳入标准:(1)比较DPPIs与AGIs治疗2型糖尿病的随机对照试验;(2)各研究报道了治疗的时间、治疗例数、安全性和有效性相关指标;(3)治疗疗程≥8周。排除标准:(1)重复发表的文献;(2)非中、英文文献;(3)Jadad评分<3 分的文献。干预措施:试验组在运动饮食治疗的基础上给予DPPIs,对照组给予 AGIs。
1.3 文献数据提取 由2位研究者独立进行文献筛选和资料提取,并交叉核对,如遇分歧,则讨论解决或交由第3位研究者裁决,缺乏的资料尽量与原作者联系予以补充。文献筛选时首先阅读文题,在排除明显不相关的文献后,进一步阅读摘要和全文,以确定最终是否纳入。资料提取内容主要包括:(1)纳入研究的基本信息,包括研究题目、第一作者、发表杂志及时间等;(2)研究设计类型及质量评价的关键要素;(3)试验组与对照组患者基本情况,包括纳入例数、年龄等;(4)有效性、安全性等。
1.4 文献质量评价 对每项原始研究的偏倚风险采用Jadad量表评价[10]:随机化(0~2分)、双盲(0~2分),撤退(0~1分)。总分0~5分,≥3分的研究认为是“高质量”研究,即可纳入。
1.5 统计学处理 采用STATA 11.0统计软件。计量资料采用加权均数差(WMD)及其95%CI为效应分析统计量,计数资料采用风险差异(RD)及其95%CI为效应分析统计量。纳入研究结果间的异质性分析采用Q检验(检验水准设为α=0.1),并结合I2定量判断异质性的大小。若P>0.1且I2<50%,则说明各研究结果间无统计学异质性,采用固定效应模型进行Meta分析;反之,则采用随机效应模型进行Meta分析[11]。采用Egger法和Begg法以糖化血红蛋白(HbA1C)作为对象检验发表偏倚[12]。Meta分析的检验水准设为α=0.05。明显的临床异质性进行敏感性分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 初检出相关文献1 128篇,最终纳入10个RCT[13-22]。文献筛选流程及结果见图1。
2.2 纳入研究的基本特征与偏倚风险评价 10个纳入研究的发表时间为2008—2016年,样本量为28~601例。纳入研究的基本特征及偏倚风险评价结果见表1。
2.3 Meta分析结果
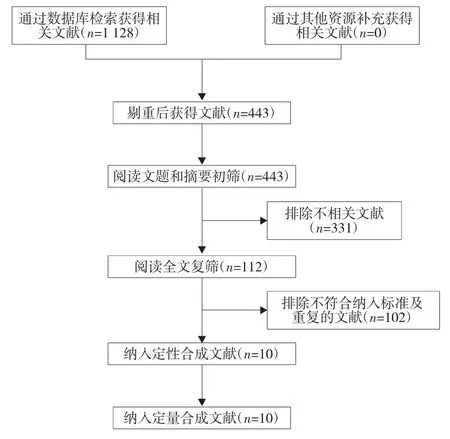
图1 文献筛选流程图及结果
2.3.1 HbA1C10个RCT[13-22]报道了治疗前后HbA1C水平的变化,共纳入3 293例患者,其中DPPIs组1 852例,AGIs组1 441例。各研究结果间有统计学异质性(P=0.000,I2=92.8%),采用随机效应模型分析,结果显示DPPIs与AGIs治疗均能明显降低HbA1C,DPPIs在降低HbA1C水平方面优于AGIs,两组差异有统计学意义(WMD=-0.33,95%CI:-0.5~-0.16,P=0.000)。
2.3.2 胰岛素分泌指数(HOMA-β) 7个RCT[13-15,18-21]报道了治疗前后HOMA-β水平的变化,共纳入1 723例患者,其中DPPIs组861例,AGIs组862例。各研究结果间无统计学异质性(P=0.745,I2=0%),采用固定效应模型分析,结果显示DPPIs组在降低HOMA-β水平方面优于AGIs组,两组差异有统计学意义(WMD=7.5,95%CI:0.59~5.42,P=0.000)。
2.3.3 胰岛素抵抗指数(HOMA-IR) 6个RCT[14-15,18-21]报道了治疗前后HOMA-IR水平的变化,共纳入1 639例患者,其中DPPIs组623例,AGIs组616例。各研究结果间无统计学异质性(P=0.121,I2=42.7%),采用固定效应模型分析,结果显示DPPIs组在降低HOMA-IR水平方面优于AGIs组,两组差异有统计学意义(WMD=-0.10,95%CI:-0.12~-0.08,P=0.000)。
2.3.4 体重变化 9个RCT[13-20,22]报道了治疗前后体重的变化,共纳入2 910例患者,其中DPPIs组1 664例,AGIs组1 249例。各研究结果间有统计学异质性(P=0.000,I2=92.5%),采用随机效应模型分析,DPPIs降低体重疗效劣于AGIs,两组差异有统计学意义(WMD=0.67,95%CI:0.23~1.11,P=0.003)。
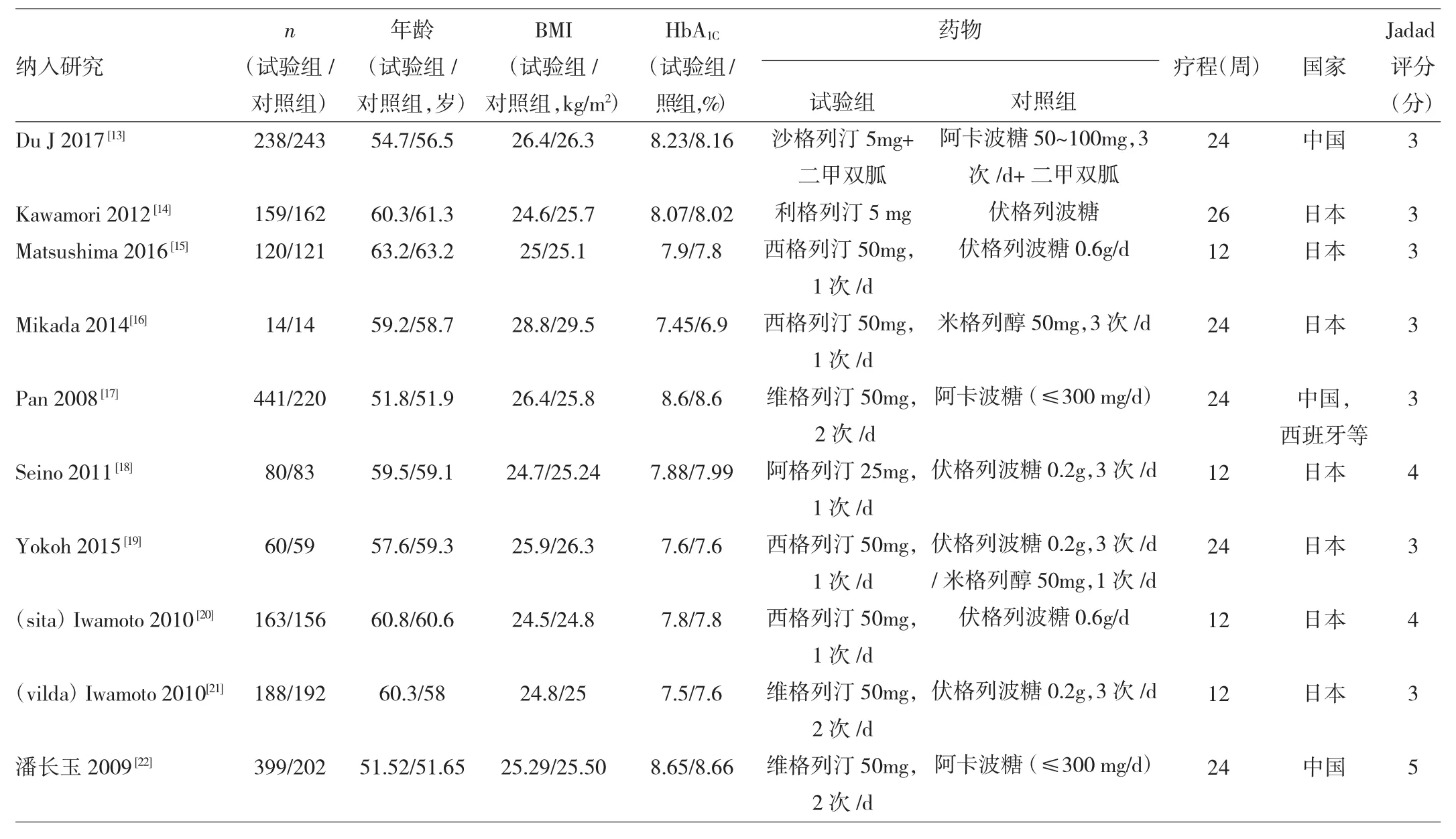
表1 纳入研究的基本特征与偏倚风险评估
2.3.5 低血糖发生率 9个RCT[13-15,17-22]报道了低血糖的发生情况,共纳入3 236例患者,其中DPPIs组1 827例,AGIs组1 409例。固定效应模型Meta分析结果显示,DPPIs与AGIs低血糖发生率比较差异无统计学意义(RD=0,95%CI:-0.01~0.00,P=0.458)。
2.3.6 不良反应 Meta分析显示DPPIs组的总体不良反应发生率(RD=-0.13,95%CI:-0.18~-0.08,P=0.000)及胃肠道不良反应发生率(RD=-0.15,95%CI:-0.18~-0.12,P=0.000)明显低于AGIs组,但是两组严重的不良反应发生率无统计学意义(RD=0,95%CI:-0.01~0.01,P=0.881)。
2.4 发表偏倚 用Egger法和Begg法对以HbA1C为指标的纳入文献的发表偏倚进行检测,结果显示纳入研究均无发表偏倚(Egger∶P=0.653;Begg∶P=0.721)。
2.5 敏感性分析 当合并研究存在明显异质性时,逐一剔除单个研究进行敏感性分析,以判断单个研究对合并效应量的影响,本研究仅对HbA1C及体重变化结果进行敏感性分析,结果显示HbA1C结论的稳定性良好。而潘长玉[22]对体重变化结论的稳定性影响较大,在剔除该研究后,随机效应模型分析,DPPIs降低体重疗效仍劣于DPPIs组,两组差异有统计学意义(WMD=0.54,95%CI:0.18~0.90,P=0.003)。
3 讨论
本系统评价结果显示:DPPIs在降低HbA1C水平、改善HOMA-β及HOMA-IR方面均优于AGIs,而AGIs减轻体重方面优于DPPIs。此外,DPPIs与AGIs的低血糖风险及严重不良反应发生率均较低,但DPPIs的总体不良反应发生率及胃肠道不良反应发生率低于AGIs。
DPPIs降糖作用优于AGIs,考虑与两者的降糖机制不同有关:DPPIs可以血糖浓度依赖性增加胰岛素分泌并可抑制胰高血糖素分泌,因此,DPPIs可有效降低空腹血糖及餐后血糖。AGIs主要是通过延缓胃肠道碳水化合物的吸收而以降低餐后血糖为主,降低空腹血糖作用甚微。
一项包括52个RCT的Meta分析结果显示:与安慰剂比较,单用DPPIs可明显改善2型糖尿病患者的胰岛功能,但是对胰岛素抵抗无明显改善[23]。目前尚无Meta分析研究AGIs对2型糖尿病患者胰岛β细胞功能及胰岛素抵抗的影响,但是Rudovich等[24]研究发现阿卡波糖能改善胰岛功能,但不能改善胰岛素抵抗。本研究显示DPPIs在改善HOMA-β及HOMA-IR方面均优于AGIs。DPPIs改善胰岛功能明显优于AGIs,可能因为DPPIs可提高内源性肠促胰岛素活性,促进葡萄糖依赖性胰岛素分泌,而AGIs没有促胰岛素分泌作用;DPPIs改善胰岛素抵抗方面优于AGIs,可能因为DPPIs可能有药物增敏作用而改善胰岛素抵抗,目前研究显示DPPIs可增加胰岛素介导的骨骼肌对葡萄糖的摄取及可显著抑制肝糖输出,从而改善肝脏胰岛素抵抗[25]。
既往研究显示DPPIs对体重改变作用为中性或增加体重[26],AGIs能减轻体重[27-28]。本系统研究显示:AGIs减重作用优于DPPIs,可能原因为DPPIs能促进胰岛素分泌,众所周知,胰岛素有增加体重作用,而AGIs可通过减少能量摄入而减轻体重。
DPPIs与AGIs总体安全性良好。两者低血糖风险及严重不良反应发生率均较低。糖尿病是心血管疾病的危险因素,糖尿病合并心血管疾病,特别是心力衰竭,可导致患者长期预后欠佳[29]。目前,EXAMINE和TECOS研究均发现,DPPIs不增加患者的心力衰竭住院率[30-31],SAVOR-TIMI 53研究结果则显示服用沙格列汀药物组患者心力衰竭住院率明显增高[32]。然而,本系统研究纳入的文献均没有报道因心力衰竭住院的患者。对肝肾功能影响方面,Seino等[18]研究报道伏格列波糖组1.3%的患者因ALT及AST升高而退出研究。Iwamoto等[20]报道伏格列波糖组ALT异常率明显高于西格列汀组(7.1%/0.6%)。
本系统评价的局限性:(1)本Meta分析中纳入的研究大部分都是短期的(最长持续时间为52周),因此,笔者不能评估药物的长期耐受性和安全性。(2)纳入研究间存在异质性,这些异质性可能源于研究设计、2型糖尿病病程及对照药物的不同。(3)西格列汀的标准剂量为100mg/d,然而本研究纳入研究西格列汀的使用剂量为50mg/d。(4)纳入研究主要来源于亚洲,缺少来源于欧美国家的数据,可能导致偏倚。
综上所述,DPPIs在降低HbA1C水平、提高HOMA-β水平及降低HOMA-IR水平方面方面均优于AGIs,两者低血糖风险及严重不良反应发生率均较低,DPPIs的总体不良反应发生率及胃肠道不良反应发生率低于AGIs。但受纳入研究数量和质量限制,本研究结论尚需开展更多高质量的研究予以验证。
