临床分离肺炎克雷伯菌生物膜形成能力及基因相关性研究
2019-01-24田学斌刘海洋李佳慧董郭枫周铁丽陈栎江曹建明
田学斌 刘海洋 李佳慧 董郭枫 周铁丽 陈栎江 曹建明
肺炎克雷伯菌是常见的医院感染病原体[1]。近年来,由于广谱抗菌药物的广泛使用甚至滥用,导致多重耐药菌不断出现,给临床抗感染治疗带来极大的困难[2]。细菌生物膜是细菌在群体生长过程中出现的一种特定现象,是细菌及其分泌的含水聚合性基质(主要是胞外多糖)黏附在物体或生物组织表面形成的结构性细菌群落[3],约80%医院感染与生物膜相关,而且生物膜能通过各
种机制增加细菌的耐药性[4]。一旦感染部位的细菌形成生物膜,即使抗菌药物的使用剂量达到正常剂量的成百倍,也很难消除生物膜引起的感染[5]。因此,细菌生物膜已成为研究者们关注的焦点之一。但目前关于细菌生物膜如何使细菌对抗菌药物耐药性增强的相关分子机制的研究资料仍然较少。本研究主要对肺炎克雷伯菌临床分离菌株生物膜形成能力进行初步探讨,并对生物膜形成相关基因的表达水平进行分析,为进一步研究生物膜形成机制提供理论基础。
1 材料和方法
1.1 菌株来源 收集2013年1月至2015年6月温州医科大学附属第一医院住院患者分离得到的肺炎克雷伯菌500株,剔除同一患者相同部位重复分离的菌株,其中包括200株对亚胺培南、头孢他啶、环丙沙星和庆大霉素敏感的肺炎克雷伯菌(敏感组)和300株对上述药物耐药的肺炎克雷伯菌(耐药组),药敏结果判读参照美国临床实验室标准化研究协会(CLSI)2015标准。质控菌株大肠埃希菌ATCC25922和肺炎克雷伯菌ATCC13883、ATCC700603购自卫生部临床检验中心。
1.2 仪器和试剂 VITEK 2 Compact全自动微生物分析仪(法国梅里埃公司);荧光定量PCR仪(美国Applied Biosystems公司);全功能微孔板检测酶标仪(美国Biotek公司);离子溅射仪(英国Cressington公司);扫描电镜(德国卡尔蔡司公司);PCR反应试剂盒(大连Takara有限公司);96孔细胞培养板、6孔细胞培养皿(美国康宁公司);逆转录试剂盒(美国Thermo公司);实时荧光定量PCR检测试剂盒(日本Toyobo公司);1%结晶紫染液(北京索莱宝科技有限公司)。
1.3 96孔板结晶紫染色法测定生物膜形成能力 生物膜形成试验采用半定量结晶紫染色法[6]。将菌液调至1.5×108CFU/ml。取 10μl菌液加入到含 190μl LB 的 96孔板中,同时作3个复孔,并作空白对照。静置培养18h后用结晶紫染色,无水乙醇洗脱,测定OD590值,计算3个复孔的平均吸光度值。实验重复3次,取平均值。参考文献标准[7],结合实验过程中生物膜的染色结果,将生物膜形成能力按照OD590测定值作以下分类:强生物膜形成能力(OD590>0.500),中等生物膜形成能力(0.200≤OD590≤0.500),弱生物膜形成能力(OD590<0.200)。
1.4 扫描电镜观察生物膜形成能力 生物膜培养参照文献[8]进行,选取生物膜形成能力强、中、弱菌株各1株,挑取菌落接种至LB肉汤培养基中,培养过夜离心,弃上清液,采用PBS缓冲液重悬菌液并调节菌悬液浓度至0.5麦氏浊度;将上述菌液1∶1 000稀释,将无菌盖玻片放入无菌6孔细胞培养皿孔中;每孔各加入稀释后的菌液2ml,37℃静置培养24h后即可形成生物膜,每株菌设置2个复孔;将6孔细胞培养板中的培养液弃去,将PBS缓冲液滴加于盖玻片上,静置,重复3次。将盖玻片放置于含有戊二醛的无菌6孔细胞培养板中4℃固定 1h,再用系列梯度浓度(50%、70%、80%、90%、95%和100%)乙醇分别脱水6min,之后进行干燥。将干燥完成的标本放进离子溅射仪镀膜室进行60s的镀膜处理。通过电镜捕捉并保存图像。
1.5 实时荧光定量PCR(qRT-PCR)检测生物膜形成相关基因表达量 采用简单随机抽样的方法选取同时携带可调控生物膜的Ⅱ型群体感应系统相关基因luxS,外排泵编码基因oqxB、acrB,外排泵编码基因的调控基因rarA、ramA,外膜蛋白相关基因ompK36,外膜蛋白相关基因调控基因micF的肺炎克雷伯菌共100株(阳性菌株均进行测序验证),比较这些菌株生物膜形成相关基因的表达量(该组所有菌株相关基因表达量的平均值)与生物膜形成能力的关系。研究所用的目的基因和内参基因引物的序列经Primer Premier 6自行设计,经primer-blast网站(http∶//www.ncbi.nlm.nih.gov/tools/primerblast/)验证其特异性,见表1。取每个样本3个复孔的平均值,计算生物膜形成相关基因的表达量,采用2-ΔΔCt公式计算生物膜形成相关基因表达量差异,肺炎克雷伯菌ATCC700603为对照菌株,管家基因rpoB为内参基因,以外排泵基因oqxB为例,如下所示:
ΔCt(试验样本)=Ct(试验样本oqxB基因)-Ct(试验样本rpoB基因)
ΔCt(校准样本)=Ct(ATCC700603的oqxB基因)-Ct(ATCC700603的rpoB基因)
-ΔΔCt=ΔCt(校准样本)-ΔCt(试验样本)
2-ΔΔCt即为外排泵基因oqxB的表达量。
1.6 统计学处理 采用SPSS17.0统计软件。正态分布的计量资料用表示,两样本比较采用t检验;多组间比较采用单因素方差分析,两两比较采用SNK-q检验;计量资料组间比较采用χ2检验;相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 肺炎克雷伯菌生物膜形成能力的对比 500株肺炎克雷伯菌中,强生物膜形成能力肺炎克雷伯菌243株(48.6%),中等生物膜形成能力肺炎克雷伯菌197株(39.4%),弱生物膜形成能力肺炎克雷伯菌60株(12.0%)。肺炎克雷伯菌中各菌株的生物膜形成能力之间差异有统计学意义(P<0.01),强形成能力组平均生物膜形成量为弱形成能力组的16.8倍(1.498/0.089)。耐药组和敏感组肺炎克雷伯菌株生物膜OD590的平均值分别为0.672±0.534和0.783±0.642,两者生物膜形成能力的差异无统计学意义。另外,耐药组按照生物膜形成能力强、中、弱等级分类后的比例分别为45.7%、42.0%、12.3%,敏感组分别为53.0%、35.5%、11.5%,3种生物膜等级强度的菌株在两组中的分布差异均无统计学意义(均P>0.05)。

表1 qRT-PCR引物序列
2.2 扫描电镜观察肺炎克雷伯菌生物膜形成能力 根据前述检测结果,选取生物膜形成能力强、中、弱各1株菌株作扫描电镜检测,观察镜下生物膜状态。结果见图1(见插页):生物膜形成能力较强的菌株生物膜数量较多,铺满整个视野,细菌在内部纵横交织;中等生物膜形成能力的菌株,生物膜数量相对减少,密度下降;生物膜形成能力较弱的菌株生物膜数量明显减少,密度明显下降,细菌小部分聚集。
2.3 不同生物膜形成能力组生物膜形成相关基因表达量分析 不同生物膜形成能力组菌株之间luxS基因表达水平的差异有统计学意义,强生物膜形成能力组(25株)luxS表达水平分别为生物膜形成能力中等(44株)和弱生物膜形成组(31株)的5.98倍(0.956/0.160)和3.37 倍(0.956/0.284)(均P<0.05)。此外,oqxB、ompK36和micF及rarA、acrB、ramA表达水平差异均有统计学意义(均P<0.05)。见表2。

表2 不同生物膜形成能力肺炎克雷伯菌生物膜相关基因表达谱
肺炎克雷伯菌的生物膜形成能力与其相关基因表达量的关系错综复杂。结果见表3,生物膜数量和luxS、micF之间呈正相关;luxS与acrB及ramA、rarA,以及ompK36、micF之间呈正相关;oqxB与rarA及acrB之间呈正相关;rarA作为oqxB的调控基因,与acrB、ramA以及micF之间呈正相关;acrB与ramA和ompK36、micF之间呈正相关;ompK36与micF之间也呈正相关。
3 讨论
肺炎克雷伯菌可引起社区和院内多种感染,临床分离肺炎克雷伯菌易形成生物膜的特点也提高了它们对抗菌药物的耐药水平[9]。目前关于多重耐药肺炎克雷伯菌生物膜形成能力的报道仍然较少,本研究通过半定量结晶紫染色法和电镜扫描证实肺炎克雷伯菌的生物膜形成能力,并进一步研究肺炎克雷伯菌生物膜形成能力及基因的相关性,希望找到对抗生物膜的有效途径。本研究结果显示肺炎克雷伯菌有较强的生物膜形成能力(48.6%),但多重耐药肺炎克雷伯菌的生物膜形成能力与敏感组差异无统计学意义,虽然肺炎克雷伯菌对药物的耐药性与其携带的耐药基因以及形成生物膜有关,细菌形成生物膜后可以大大降低抗菌药物对其的清除效率,但是耐药菌株并不一定携带相应的生物膜形成基因,也不一定都可以形成强的生物膜,此外,敏感菌株也部分携带生物膜形成相关基因。因此,笔者认为肺炎克雷伯菌生物膜形成能力主要与细菌本身是否携带相应的生物膜相关基因以及细菌本身的表面特性有关[10]。
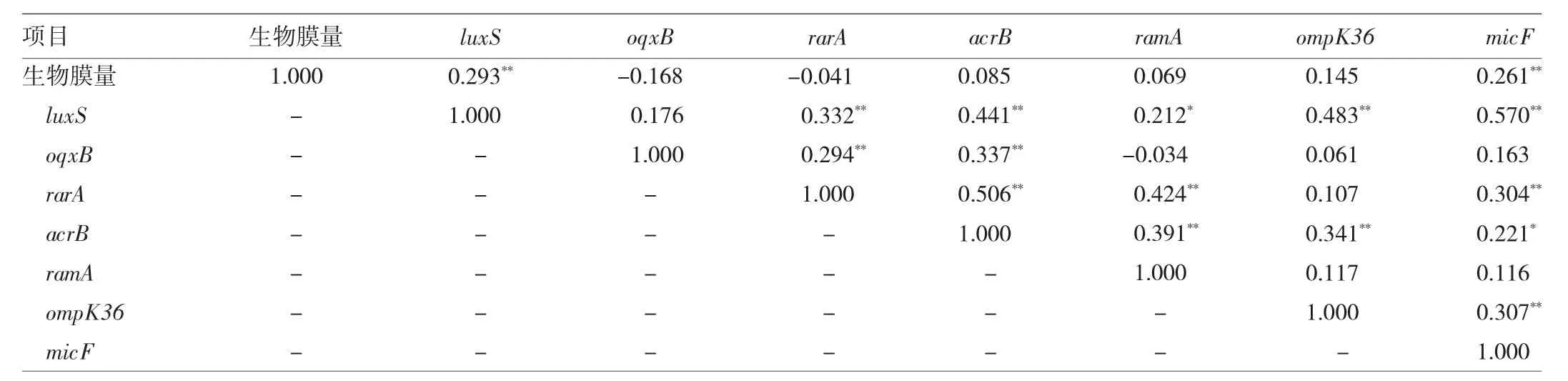
表3 肺炎克雷伯菌生物膜量与其相关基因表达量相关性分析(r值)
多项研究证实luxS基因可调控临床病原菌生物膜的形成,如大肠埃希菌、肺炎链球菌和肺炎克雷伯菌等[11-13]。本文结果显示:强生物膜形成能力组luxS基因的表达水平分别是中等生物膜形成能力组和弱生物膜形成组的5.98倍和3.37倍,笔者分析,luxS作为高阶调控基因,在生物膜形成的过程中起主要调控作用,但肺炎克雷伯菌生物膜形成能力除了与luxS基因表达量有关外,还受细菌黏附等因素的影响,具体调控机制尚需进一步研究。
在肺炎克雷伯菌中关于外排泵的研究主要涉及到外排泵、外膜蛋白缺失介导的细菌多重耐药等相关机制,但缺乏外排泵等与细菌生物膜形成之间的关系的研究,本研究探讨了肺炎克雷伯菌多重耐药相关的luxS、oqxB,rarA、acrB、ramA,ompK36以及micF与生物膜形成的关系,结果显示luxS基因表达水平与外排泵和外膜蛋白编码基因及其调控基因的表达水平之间存在一定的相关性,且各个外排泵和外膜蛋白编码及其调控基因的表达水平之间也具有相关性。而其他外排泵基因以及调控基因在生物膜形成中的作用,则需进一步通过敲除等试验验证。
综上所述,luxS作为一个高阶调控基因,与上述各基因之间构成错综复杂的调控网络共同决定了肺炎克雷伯菌形成生物膜的能力。本研究首次较为深入地研究了肺炎克雷伯菌生物膜形成能力与多种外排泵基因、外排泵调控基因、外膜蛋白基因之间的相关性,为有效防控病原菌生物膜相关感染提供了一定的理论依据。
