围场县马铃薯中典型药物污染特征及健康风险评价
2019-01-23苏佰礼贲伟伟
潘 寻,苏 都,苏佰礼,贲伟伟*
(1.生态环境部环境保护对外合作中心,北京 100035;2.中国科学院生态环境研究中心,北京 100085;3.济南市环境监测中心站,济南 250101)
药物是人类日常生活和生产过程中大量使用并具有潜在生态效应的一类新型化学物质,因具有较强的环境持久性、生物活性、生物累积性和生物难降解性,成为各国学者和公众关注的焦点问题[1-2]。蔬菜是我国居民的重要食品,也是我国主要出口商品之一。一般来说,蔬菜中的有毒有害物质主要来源于土壤,其污染特征与土地用途、经营模式、管理方式及周围环境密切相关。农田土壤中药物残留主要来源于畜禽粪便等有机肥的施用,畜禽粪便的施用频率及药物残留水平直接影响药物进入农田的总量及其在农田及农产品中的积累。残留药物在一定程度上干扰土壤微生物的群落结构与功能,影响土壤中有机质的腐烂和分解,进而影响土壤肥力[3];影响蔬菜的正常生理和生长,降低了蔬菜的营养品质,如四环素在一定程度上增加了生菜和小白菜的气孔导度和蒸腾速率,从而抑制蔬菜的生长[4-5];磺胺嘧啶对小白菜和西红柿具有生态毒性效应[6]。此外,长期通过食物链摄入暴露于低含量药物的食品对人体健康也存在潜在危害[7-8]。
围场县位于河北省最北部,东经116°32′~118°14′,北纬41°35′~42°40′,是我国重要的马铃薯生产基地,被评为中国马铃薯之乡。2015年,围场县全县马铃薯种植面积3.8万hm2,总产量16.4万t,总产值7.2亿元[9]。马铃薯对于围场县具有举足轻重的意义,其质量的优劣直接关系到人们的身体健康、农村经济发展和社会稳定。畜用药物使用缺乏科学指导、畜禽粪便无害化水平低、复种指数高等当地农耕特点都可能导致药物在农田中不断累积,成为制约当地马铃薯产业发展的重要因素,也从源头上为食品安全带来隐患[10]。当前,国内外食品中药物残留污染相关标准主要针对动物性食品制定,植物性食品中药物的污染水平调查和健康风险评估也多围绕单类抗生素开展[11-13]。因此,本研究以围场县为对象,调查了全县农田马铃薯中5大类25种药物的污染水平及富集效果,并对健康风险进行了分析评价,为掌握典型药物在农作物中的污染现状,减缓污染风险,保障农产品质量安全,促进当地农业生产可持续发展提供数据支持和科学依据。
1 材料与方法
1.1 样品采集
采样点覆盖围场县全部37个乡镇,以及红松洼、御道口、后沟、机械林场4个省管牧场和林场。每个乡镇选取有代表性农田采样点1个,共采集马铃薯样本41个,采样点位置详见图1。样本贴好标签,带回实验室,用自来水清洗后再用蒸馏水洗2次。取样品约100 g,冷冻干燥后按四分法缩减样品,研磨过100目筛,供分析测试所用。
1.2 仪器与试剂
选择25种目标药物作为检测对象,按照种类性质分为磺胺类(Sulfonamides,SAs)、四环素类(Tetra⁃cyclines,TCs)、氟喹诺酮类(Fluoroquinolones,FQs)、大环内酯类(Macrolides,MLs)和其他类(Others),其主要理化性质和分子结构见表1。药物标准品购自美国Sigma-Aldrich公司和德国Dr.Ehrenstorfer公司,纯度均大于98%。甲醇、乙腈和甲酸均为色谱纯,分别购自于比利时Fisher公司和美国Dikma公司。试验所用其他试剂均为分析纯,购自北京化学试剂公司。Agilent 1290高效液相色谱,配自动进样器;Agi⁃lent 6420A三重四极杆串联质谱仪,配有电喷雾电离源(ESI)及MassHunter Workstation数据处理系统。其他仪器包括:24孔固相萃取装置(Supelco),12位氮吹仪(DC-12型,上海安谱),离心机(J2-HS,Beckman),冷冻干燥机(FD-1-50,北京博医康),真空泵(DOA-504-PN,Gast),超声波清洗器(KQ5200-DE,上海昆山),固相萃取柱(Oasis HLB,500 mg·6 mL-1,购自美国Waters公司)。
1.3 样品预处理
图1 围场县马铃薯采样点位Figure 1 Sampling sites of potatos in Weichang County
准确称取1 g(精确至0.001 g)经预处理后的马铃薯样品,置于50 mL玻璃离心管中,加入萃取液(1∶1甲醇和 0.2 mol·L-1柠檬酸溶液,pH=4.4)10 mL,漩涡混合30 s后超声萃取30 min(40 KHz,120 W),离心并收集上清液,重复萃取2次,步骤同上。将3次操作收集的上清液合并,加水稀释至300 mL,用GF/F玻璃纤维滤膜过滤以去除颗粒杂质,随后加入0.1 g Na2EDTA。采用固相萃取法对样品中的目标物进行富集,同时去除样品中的干扰基质。详细步骤如下:(1)先后用5 mL的甲醇、5 mL的0.5 mol·L-1HCl和5 mL的超纯水活化萃取柱;(2)样品以5 mL·min-1的流速通过萃取柱;(3)用5 mL的5%甲醇水溶液和5 mL超纯水对HLB小柱进行清洗;(4)真空抽吸至少60 min,干燥小柱;(5)用2×5 mL的洗脱液淋洗小柱,洗脱液流速控制在1~2 mL·min-1,用锥形底玻璃试管接受洗脱液;(6)35 ℃水浴中氮吹近干;(7)用400 μL 甲醇和 600 μL 超纯水复溶样品;(8)样品经过 0.2 μm PES针式过滤器过滤后进入UPLC-MS/MS分析。
1.4 HPLC-MS/MS分析
采用Agilent Zorbax SB-C18液相色谱柱(100 mm×2.1 mm,1.8 μm);柱温30 ℃;流速0.3 mL·min-1;进样量5 μL。流动相组成:A为0.2%的甲酸水溶液,B为ACN;采用流动相线性梯度洗脱,洗脱程序为[时间(min),流动相 B 的比例(%)]:(0,5),(2,5),(5,13),(8,15),(13,20),(18,30),(25,60),(27,100),(30,100),(30.1,5),(33,5)。质谱采用电喷雾正离子模式(ESI+),在多反应监测模式(MRM)对目标物进行精确定性定量检测,毛细管电压4.0 kV,脱溶剂气温度300℃,气流量12 L·min-1,喷雾气压为241 kPa。
1.5 质量控制
方法的验证主要包括标准曲线线性、方法回收率和方法检出限等,具体数据如表1所示。25种药物的线性范围为0.5~500 μg·L-1,相关系数值(r2)均大于0.99,除CIP、LOM、NOR 和 PROP的回收率稳定在50.2%、56.1%、55.7%和48.4%外,其他药物的回收率均在60%~120%,日内和日间标准偏差均小于15%,说明方法具有较强的稳定性及适用性,可以用来进行多种目标物的定性和定量分析。目标药物在马铃薯中的检出限为0.05~1.42 μg·kg-1,能够满足痕量污染物的检测要求。为保证测定过程的稳定性,每隔25个样品进行1次标准工作液校正。

表1 目标药物主要理化性质及检测方法相关参数Table 1 Major physicochemical properties and detection parameters of the target pharmaceuticals
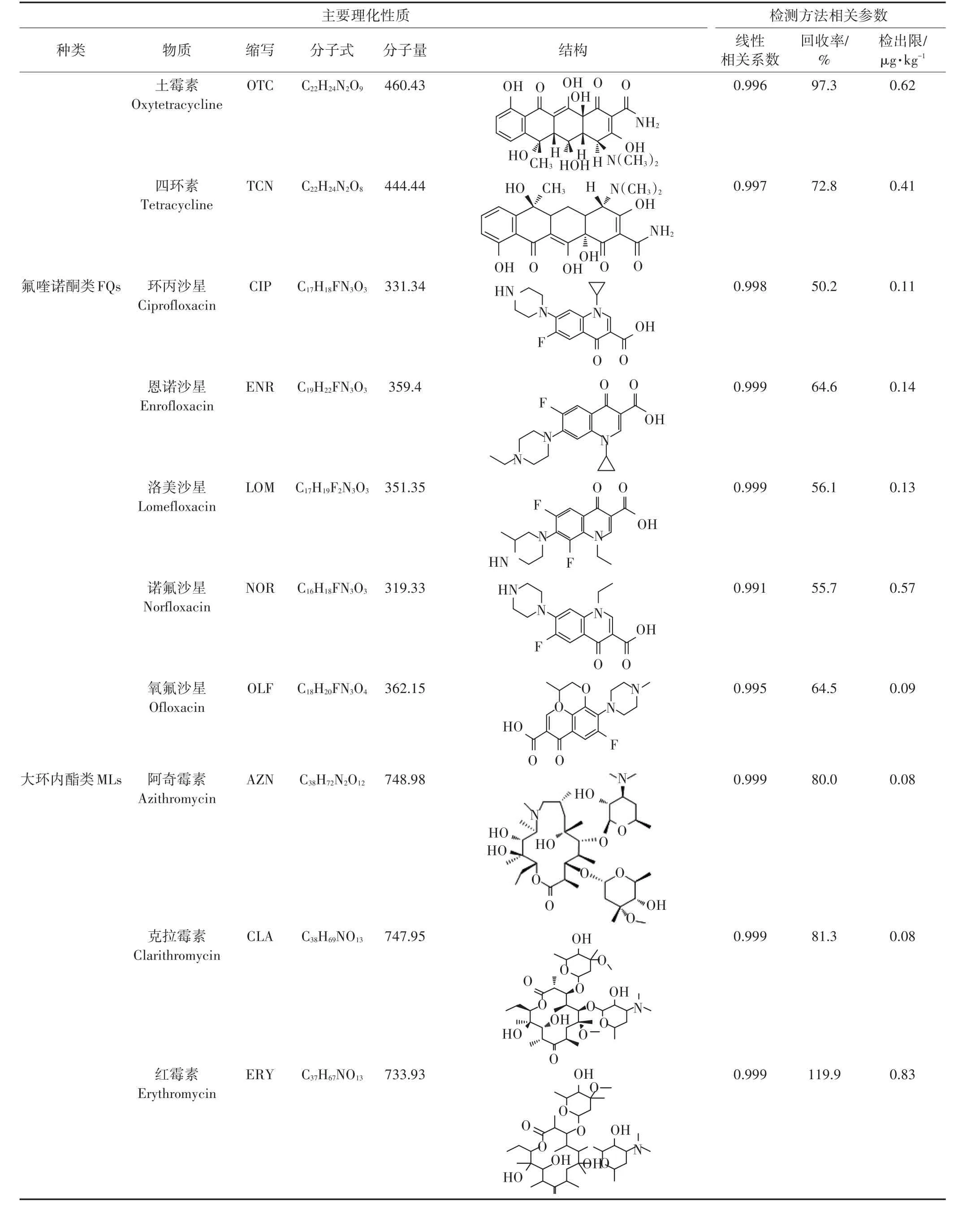
续表1目标药物主要理化性质及检测方法相关参数Continued table 1 Major physicochemical properties and detection parameters of the target pharmaceuticals

续表1目标药物主要理化性质及检测方法相关参数Continued table 1 Major physicochemical properties and detection parameters of the target pharmaceuticals
2 结果与分析
2.1 污染特征
对25种药物在马铃薯样品中的检出率、检出范围和检出含量(干质量,中位值)进行了统计分析,结果见表2。25种目标物中有20种被检出。以检出率划分,DOX、OTC、OLF、BF和CAF 5种药物的检出率均超过了70.0%,其中DOX的检出率高达95.1%;SMX、CIP、ENR和ATE的检出率范围在22.0%~65.9%之间;除此之外,其他11种检出药物的检出数均不超过3个,检出率均低于7.3%。以检出含量划分,20种检出药物的检出含量普遍达到μg·kg-1水平。SML、DOX、OTC、NOR、AZN、ERY、ROX和ATE 8种药物的检出含量超过1 μg·kg-1,其中SML的检出含量为3.67 μg·kg-1,在20种检出目标物中最高,DOX的最大检出含量17.0 μg·kg-1,为单种药物最高检出值;其他12种检出药物的检出含量均不超过1 μg·kg-1,含量检出范围为0.26~0.99 μg·kg-1。
蔬菜中药物残留含量与不同粪肥类型、灌溉条件、土壤性质和环境条件等因素有关,与目标物本身的亲脂性、离子化率和蛋白结合率有关,亦与蔬菜本身组织结构和pH值有关。目前,国内外针对马铃薯中药物残留含量检测的研究较少。吴小莲等[14]对马铃薯中4种FQs的含量进行了检测,其中CIP、LOM和ENR的检出含量分别为16.5、0.78、5.13 μg·kg-1;罗丹等[15]对马铃薯中8种SAs的含量进行了检测,其中磺胺胍的检出含量为 79 μg·kg-1;Dolliver等[16]对马铃薯中的磺胺甲嘧啶的含量进行了检测,检出含量低于10 μg·kg-1。同这些研究相比,围场地区马铃薯中药物残留含量相对较低。但是,值得关注的是,虽然农业部已先后于2005年和2015年禁止CLA、ROX、ATE、LOM、NOR和OLF 6种药物作为兽药在食品动物中的使用[17-18],但其均在马铃薯中检出,其中OLF的检出率高达87.8%。此外,BF、CAF两种人用药在马铃薯中的检出率均高于73.0%,和围场地区农户收集人粪尿作为农田一大肥源这一传统农耕模式有关。
2.2 富集效果
蔬菜对药物具有一定的吸附累积效应,吸附累积能力以富集系数(蔬菜与土壤中药物含量的比值)来表示。不同蔬菜对不同药物富集能力存在差异,茄子和辣椒从土壤中吸附NOR的富集系数较高,分别为6.81和6.20;菠菜和茼蒿较低,分别为1.47和1.58[19]。玉米、洋葱和甘蓝只吸收CTC而不吸收泰乐菌素[20]。此外,药物更容易在直接接触土壤的块茎及块根的外皮中积累,萝卜及马铃薯的外皮中药物的含量最高,并由外到内逐渐降低[16,21]。小白菜和生菜地下部对TC、OTC和CTC的富集系数均高于地上部分[4]。
25种药物中有20种在土壤和马铃薯样品中同时检出,对这20种药物在马铃薯中的富集系数进行了统计分析,结果如表2所示(相同采样点位土壤中药物含量见参考文献[10])。3种SAs和4种MLs的富集系数均不超过1,表明这两大类药物在马铃薯中的含量均不超过在土壤中的含量。相比之下,马铃薯对其他三大类药物的富集系数差异显著。TCs中,DOX、OTC和TCN的富集系数中位值分别为23.0、5.96、0.52;5种FQs中,CIP、OFL、ENR、NOR和LOM的富集系数中位值由高到低依次为8.29、6.79、4.59、0.81、0.09;5种其他类药物中,ATE富集系数最高值为61.8,为单种药物富集系数最高检出值,其富集系数中位值为39.6,也为20种药物中最高;此外,BF、CAF、CBZ和TMP的富集系数中位值均不超过0.48。
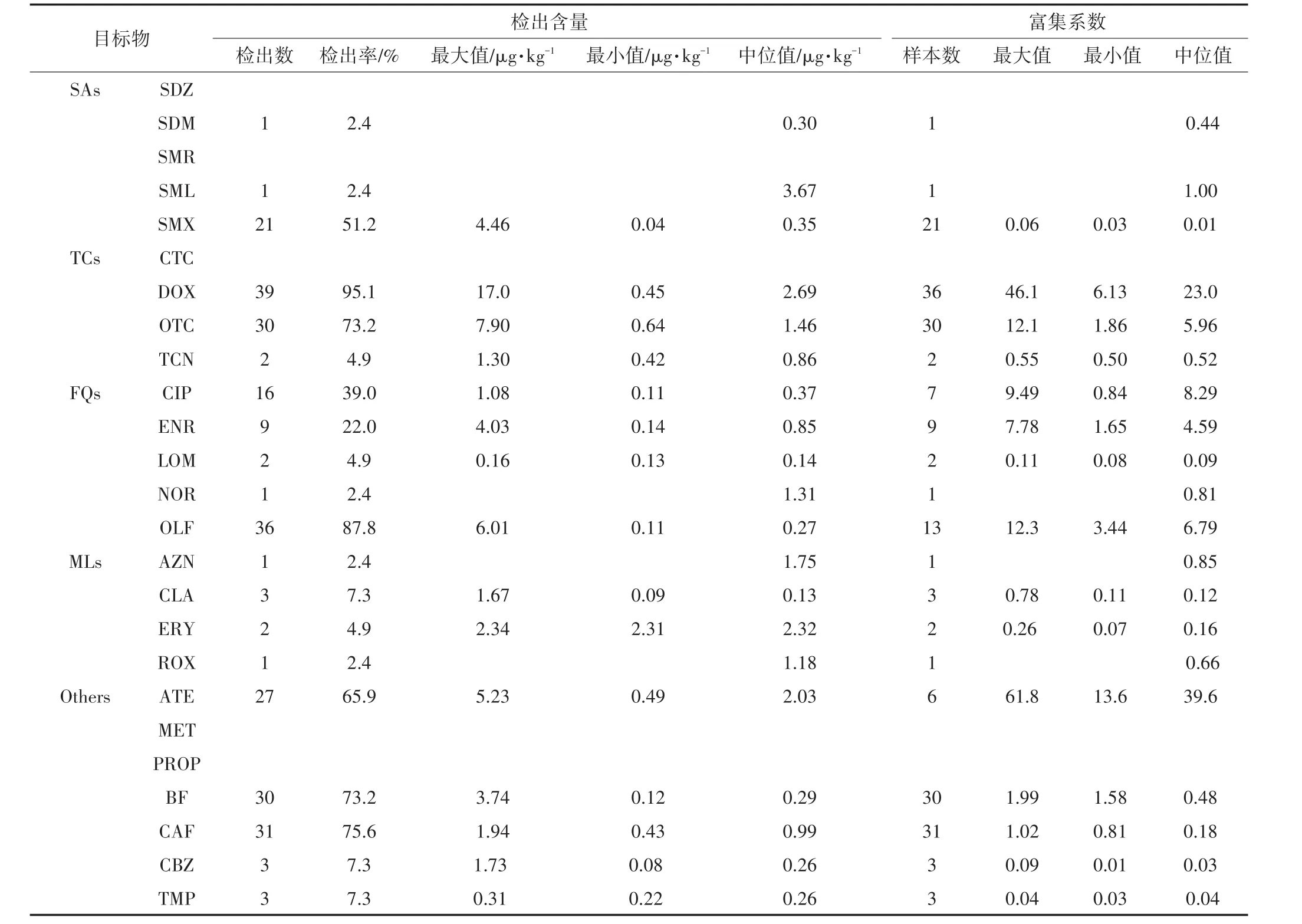
表2 马铃薯中药物的含量及富集系数Table 2 Concentrations and enrichment coefficients of target pharmaceuticals in potato samples
2.3 健康风险评价
目前,我国尚未对植物性食品中药物的最高残留限量(Maximum residue limit,MRL)做任何限制。对蔬菜中药物的健康风险评价,主要参考原农业部公告第235号《动物性食品中兽药最高残留限量》以及我国居民植物性食物膳食习惯开展。前者在内容中规定,动物性食品中SAs、TCs、FQs(以CIP+ENR计)、MLs(以ROX计)最严格标准分别为100、100、100、40 μg·kg-1;日允许摄入量(Acceptable daily intake,ADI)上限分别为50、30、2、5 μg·kg-1·d-1[22]。2016年全新修订的《中国居民膳食指南》中建议我国成年人每日食用薯类最高为100 g[23]。马铃薯含水率通常在80%左右,人均体重按60 kg计算。
日摄入量=马铃薯中污染物干重含量(μg·kg-1)×0.1 kg·d-1×20%÷60 kg
如表3所示,41个马铃薯样品中,SAs、TCs、FQs和MLs四大类污染物最大残留值分别为0.91、3.65、1.46、1.38 μg·kg-1,远低于相关标准限值;日摄入量最大值分别为0.001 5、0.006 1、0.002 4、0.002 3 μg·kg-1·d-1,日摄入量对ADI值的最高贡献率为0.003%~0.120%。
从总体上看,围场县马铃薯中各类药物对人体的健康风险较小。但是,除马铃薯外,人体每日还摄入其他食物,如肉类、鱼虾、谷类、水果和饮用水等。由于禽畜、鱼虾养殖中普遍使用药物,因此要评价成人每日摄入药物所带来的健康风险还需要结合其他食物摄入量及药物含量进行综合考虑。另外,有研究报道一些含量极低的药物在长期暴露和联合作用下也会对生物产生危害,特别是对孕妇、儿童产生健康风险,应予以关注[8,13]。

表3 马铃薯中各类药物最大残留量及最大日摄入量(鲜质量)Table 3 Maximum residual concentrations and maximum daily intake of different pharmaceutical categories in potato samples(fresh weight)
3 结论和建议
(1)25种目标药物中有20种被检出,检出含量中位值为0.13~3.67 μg·kg-1,单种污染物最高检出含量为17.0 μg·kg-1。
(2)马铃薯对目标污染物的富集系数中位值为0.01~39.6,最大富集系数为61.8。
(3)围场县马铃薯中各类药物对人体的健康风险较小,畜禽粪便是马铃薯中药物残留的主要来源,兽药滥用、粪便自然堆沤等传统农耕模式有造成药物在食物链中持续累积的趋势。
基于上述结论,提出以下建议:一是强化畜禽养殖业药物使用监管;二是推进畜禽粪便安全资源化利用;三是对围场地区农产品中药物残留进行定期监测,并建立完善的风险评价系统;四是关注各种药物的联合毒性效应,为保障农田环境质量和农产品质量安全提供科学依据。
