栀子苷磷脂复合物的制备与评价
2019-01-23王金悦叶青卓张向荣
吴 桐,王金悦,叶青卓,张向荣
栀子苷磷脂复合物的制备与评价
吴 桐1,王金悦1,叶青卓1,张向荣2*
(1. 沈阳药科大学 中药学院,辽宁 沈阳 110016; 2. 沈阳药科大学 功能食品与葡萄酒学院,辽宁 沈阳 110016)
将水溶性栀子苷制备成栀子苷磷脂复合物,以提高栀子苷的脂溶性。采用溶剂蒸发法制备栀子苷磷脂复合物,以复合率和载药量为评价指标,利用单因素试验优化制备工艺,并对最优处方的表观油水分配系数进行评价,以紫外 (UV)、红外 (FTIR)、差示扫描量热法 (DSC)、X射线粉末衍射 (PXRD)和扫描电镜 (SEM)对理化性质进行表征。优化的制备工艺为:无水乙醇为反应溶剂,栀子苷与蛋黄卵磷脂的质量比为1∶3.6,栀子苷质量浓度1.0 g·L-1,40 ℃下反应1 h。以此工艺制备的栀子苷磷脂复合物可得载药量为21.77%、复合率达99.93%的产物。物化表征结果显示成功制备了磷脂复合物,且表观油水分配系数的对数值lgapp由-2.10提高为1.05。栀子苷磷脂复合物制备工艺简单,复合率较高且性质稳定,药物的脂溶性得到明显改善。
药剂学;磷脂复合物;溶剂蒸发法;栀子苷;复合率;水溶性药物
栀子苷(geniposide, GS)是从茜草科植物栀子(Ellis)的干燥成熟果实中提取精制而成的环烯醚萜苷类成分,具有多种药理作用,如抗炎镇痛、保肝利胆、降糖及抗肿瘤等[1],有很高的临床应用价值。并且在《中华人民共和国药典》2015版一部中,栀子苷被列为包括龙胆泻肝片、清开灵软胶囊和栀子厚朴汤在内的近20种中成药质量评价的定量成分。但由于栀子苷的水溶性强,脂溶性弱,膜渗透性差,生物利用度低,其临床应用与开发受到了极大地限制,选择合适的剂型来提高它的生物利用度尤为必要。磷脂复合物(phospholipid complex, PLC)是某些药物和磷脂通过电荷迁移作用或分子间作用力形成的相对稳定的复合物[2]。栀子苷化学结构式如图1所示,其中负电性较高的部位,在一定条件下可与磷脂带正电荷的极性端发生相互作用,形成氢键或以分子间的疏水作用结合在一起形成磷脂复合物,且不破坏磷脂的理化性质[3]。磷脂作为一种两亲性物质,既可以增强水溶性药物的脂溶性也可以增强脂溶性药物的水溶性[4],与药物复合后改善药物的生物膜透过性,从而增加在胃肠道中的吸收,提高其口服生物利用度和疗效。作者结合栀子苷理化性质,用磷脂复合技术使其与磷脂分子在适宜的条件下形成一种理化性质有所改变的复合载体系统[5],即栀子苷磷脂复合物(GS-PLC),并对其进行制备工艺优化与理化性质表征,以期制备出复合率(complex yield ratio, CR)较高的磷脂复合物,为实现工业化生产、改善栀子苷的吸收性能和提高生物利用度等相关研究奠定基础。
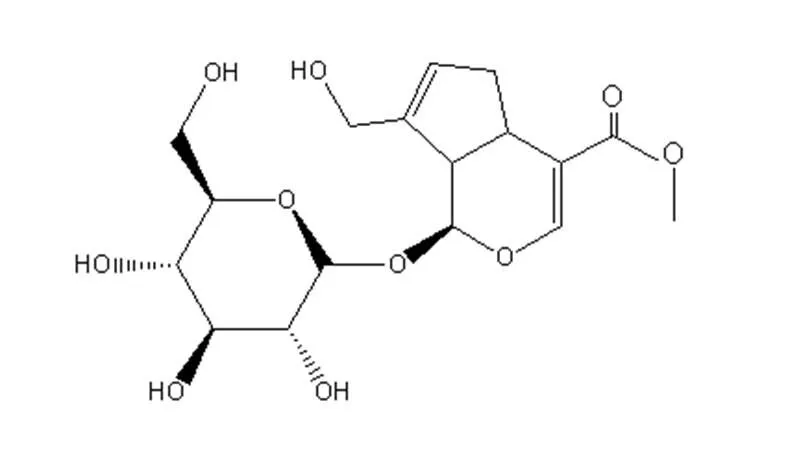
Fig. 1 The chemical structural formula of geniposide(GS)
1 仪器与材料
BS124S Sartorius分析天平(德国赛多利斯仪器系统有限公司),L-7000高效液相色谱仪(日本日立公司),DF-101S 集热式恒温加热磁力搅拌器(河南予华仪器有限公司),KQ3200E超声波清洗器(昆山超声仪器有限公司),TG16G 高速离心机(天津广丰科技有限公司),UV-5100紫外可见分光光度计(上海元析仪器有限公司),Bruker EQUINOX 55傅立叶变换红外光谱仪(瑞士Bruker仪器公司),Netzsch DSC200F3 Maia®差示扫描量热分析仪(德国Netzsch公司),PANalytical X'Pert PRO MPD型X-射线衍射仪(荷兰新加坡思百吉公司),S-4800场发射扫描电镜(日本Hitachi公司)。
栀子苷原料药(纯度质量分数> 95%,临川之信生物技术有限公司),蛋黄卵磷脂(德国Lipoid公司,批号510300-1134048),甲醇(色谱纯,山东禹王和天下新材料有限公司)、水(色谱纯,杭州娃哈哈集团有限公司),其余试剂(分析纯,市售)。
2 方法与结果
2.1 磷脂复合物的制备
采用溶剂蒸发法制备栀子苷磷脂复合物。精密称取质量比为1∶3.6的栀子苷与蛋黄卵磷脂适量,加入适量无水乙醇充分溶解,使栀子苷质量浓度为1.0 g·L-1,在40 ℃水溶中、磁力搅拌条件下反应1 h。在65 ℃温度下,采用旋转蒸发法仪回收溶剂,溶剂蒸干后即得栀子苷磷脂复合物。用过量石油醚进行溶解过滤并收集滤液,经减压蒸干溶剂后得淡黄色蜡状固体,于真空干燥条件下贮存。
2.2 磷脂复合物中栀子苷的分析方法
2.2.1 色谱条件
色谱柱:Diamonsil C18柱(250 mm× 4.6 mm, 5 μm,迪马公司);柱温:25 ℃;流动相:甲醇-水(体积比35∶65);流速:1.0 mL·min-1;检测波长:238 nm;进样量:10 μL。
2.2.2 标准曲线的制备
精密称定栀子苷25 mg置于50 mL量瓶中,用甲醇溶解并定容为质量浓度500 mg·L-1栀子苷的储备液。精密量取该储备液配制成质量浓度分别为5.0、25.0、50.0、75.0、100.0、150.0、200.0、250.0和300.0 mg·L-1的系列溶液,将上述溶液过0.45 μm的微孔滤膜,取续滤液按“2.2.1”条色谱条件进样分析,记录峰面积,以峰面积()对质量浓度()进行线性回归,得回归方程为=1.308 0×104+2.960 5×104(=0.999 6)。即,栀子苷质量浓度在5~300 mg·L-1内与峰面积线性关系良好。
2.2.3 精密度试验
取50、150和300 mg·L-1低、中、高3种质量浓度的标准溶液,在同一日内按照2 h的时间间隔,进样10mL检测,每个质量浓度平行测定3次,按所测峰面积积分值,求取日内相对标准差,计算日内精密度。同时,将该试验样品在第1~5 d分别测定,计算日间精密度。由表1可知,根据本方法所求得的日内及日间精密度的RSD均小于2%,证明精密度符合要求。
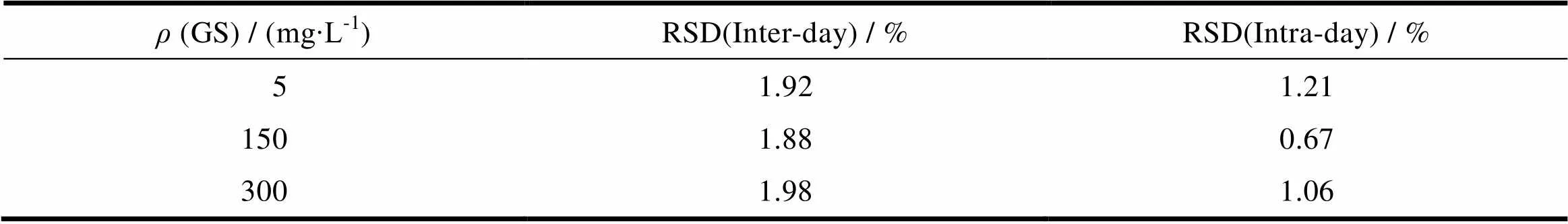
Table 1 Precision assay of the HPLC method for GS determination
2.2.4 重复性试验
配置50、150和300 mg·L-1低、中、高3种质量浓度的栀子苷水溶液各6份,取上述样品过0.45 μm的微孔滤膜,按“2.2.1”条色谱条件在同一日内将6份续滤液依次连续进样10mL,测定其峰面积求取相对标准差,计算得RSD为1.15%,表明方法重复性良好。
2.2.5 稳定性试验
取标准溶液适量,分别在0、2、4、6、12 h取续滤液10mL,按“2.2.1”条色谱条件进样分析,记录峰面积以考察其稳定性。经计算求得峰面积的RSD值为0.85 %,可见样品溶液在12 h内的稳定性良好。
2.2.6 检测限和定量限的确定
精密称取栀子苷用甲醇稀释成不同质量浓度后,取10 μL进行HPLC检测,测得其检出限 (/=3) 质量浓度为2 mg·L-1,定量限 (/=10) 质量浓度为5 mg·L-1。
2.2.7 样品含量测定
精密称定栀子苷并制备磷脂复合物,用适量甲醇溶解后置于20 mL量瓶中,再用甲醇定容。上述溶液过0.45 μm的微孔滤膜,按“2.2.1”条色谱条件测定其中栀子苷的含量。
2.3 磷脂复合物复合率的测定
在磷脂复合物中加入过量石油醚,充分溶解后过滤收集滤渣,即为未复合的栀子苷,用适量甲醇溶解至确定浓度,HPLC法测定栀子苷的含量,复合率的计算公式为:CR=(0–1)/0×100%。
式中:0为初始所投药物质量;1为未复合的药物质量。
2.4 磷脂复合物工艺条件的优化
以复合率为评价指标,对栀子苷的质量浓度、栀子苷与磷脂的质量比、反应时间及温度进行单因素考察以确定栀子苷磷脂复合物的制备工艺,即为,以无水乙醇为反应溶剂,栀子苷与磷脂质量比为1∶3.6,栀子苷质量浓度为1.0 g·L-1,40 ℃下水浴搅拌反应1 h,此条件下制备的复合物复合率最高可得99.87%,且工艺稳定。具体考察参数见表2。
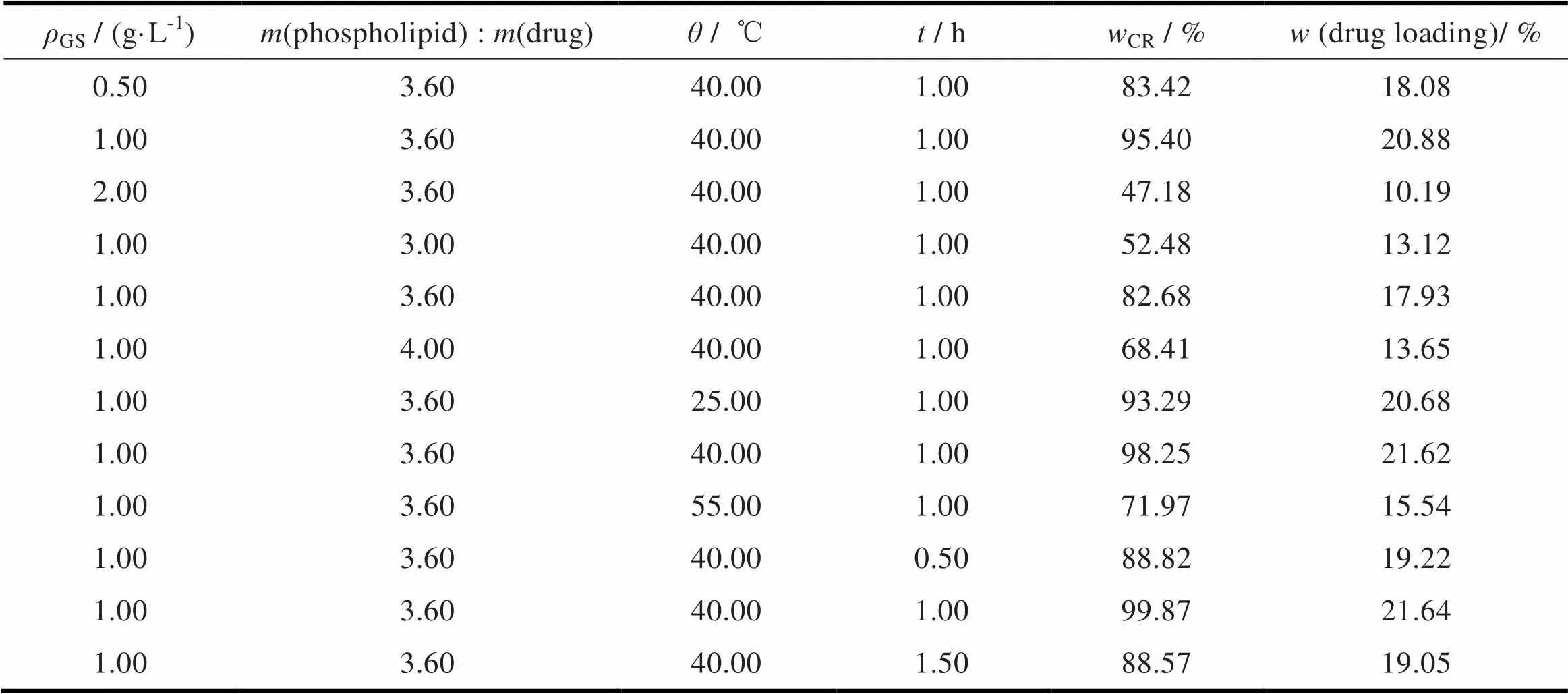
Table 2 The experiment values of different factors of GS-PLC preparation
2.5 优化工艺验证
根据单因素考察过程对制备方法进行优化,将按原方法制备出的样品充分溶于足量石油醚中,过滤后取滤液蒸干溶剂作为最终的磷脂复合物。按上述方法制备3批栀子苷磷脂复合物,计算该磷脂复合物的复合率分别为99.92%、100.00%和99.89%,药物载药量分别为21.74%、21.67%和21.90%,表明制备工艺稳定可行。
2.6 表观油水分配系数的测定
2.6.1 样品处理
称取过量的栀子苷、栀子苷与磷脂的物理混合物(physical mixture, PM)和栀子苷磷脂复合物各2份,分别置于50 mL具塞三角瓶中,一份加入10 mL正辛醇饱和的水,另一份加入10 mL水饱和的正辛醇,加塞,封口膜封口,超声30 min分散均匀后于恒温空气浴振荡器中震摇24 h(25 ℃,100 r·min-1)后,以8 050 r·min-1离心25 min,取上清液适量,用甲醇稀释一定倍数,经0.22 μm微孔滤膜过滤,即得供试溶液。
2.6.2 样品测定
取供试溶液,按“2.2.1”条色谱条件测定,测定各样品中栀子苷在水中及正辛醇中的含量,计算其溶解度,并根据公式app=o/w计算表观油水分配系数,结果见表3。
式中:o为在正辛醇中的饱和溶解度;w为在水中的饱和溶解度。

Table 3 Apparent oil-water partition coefficient of GS, PM and GS-PLC in water or n-octanol
栀子苷的lgapp= -2.1,表明栀子苷的水溶性特别好,脂溶性较差[6],而药物的lgapp在1~4时可达到较为理想的体内吸收[7],本实验制得的栀子苷磷脂复合物的lgapp增大至 1.05,表明将栀子苷制备成磷脂复合物后,在一定程度上改善了栀子苷的亲脂性,并有望改善栀子苷的体内吸收,提高其生物利用度。
2.7 磷脂复合物的表征
2.7.1 紫外(UV)分析
将栀子苷、磷脂、处方比例的栀子苷与磷脂的物理混合物(质量比1∶3.6)以及磷脂复合物(质量比1∶3.6),分别溶于适量甲醇,制成等栀子苷质量浓度的甲醇溶液,在波长210~400 nm内进行扫描,结果见图2。由图2可知,栀子苷的最大吸收波长是238 nm,而磷脂在248 nm处有最大吸收,其余波长均无吸收,故磷脂对栀子苷的测定无干扰作用,可用于GS-PLC制备的分析。同时可看出,物理混合物与磷脂复合物的紫外图谱均呈现出栀子苷的特征,均在238 nm处有最大吸收峰。紫外图谱结果表明栀子苷与磷脂形成复合物后栀子苷发色团的结构未发生变化,即反应后没有新的化合物的形成。
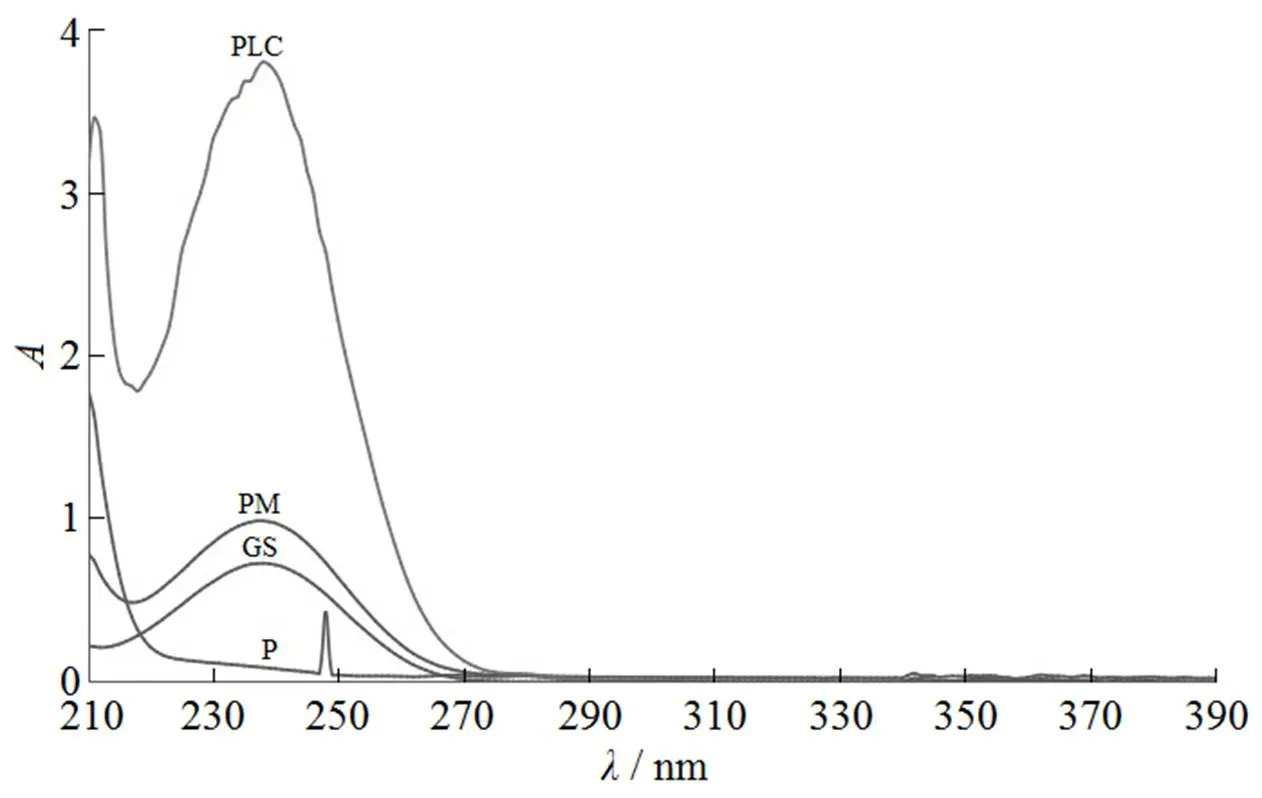
Fig. 2 UV curves of GS(GS), egg phospholipid(P), PM and GS-PLC(PLC)
2.7.2 差式扫描量热法(DSC)分析
取适量栀子苷、磷脂、栀子苷与磷脂的物理混合物和磷脂复合物进行DSC扫描,范围为30~200 ℃,升温速度为10 ℃·min-1,结果可见(图3),栀子苷在164.1 ℃有尖锐的特征吸热峰,磷脂复合物中栀子苷特征峰消失,并在151.6 ℃处出现一平缓吸热峰,推测栀子苷形成磷脂复合物后晶型发生了改变,这可能是由于栀子苷与磷脂的极性基团部分发生分子间相互作用,磷脂对栀子苷进行包裹,栀子苷高度分散于磷脂中。而磷脂在140.8 ℃处出峰,物理混合物在145.0 ℃处出峰,两者比较接近,可能是峰发生了位移,但晶型并没有发生改变。
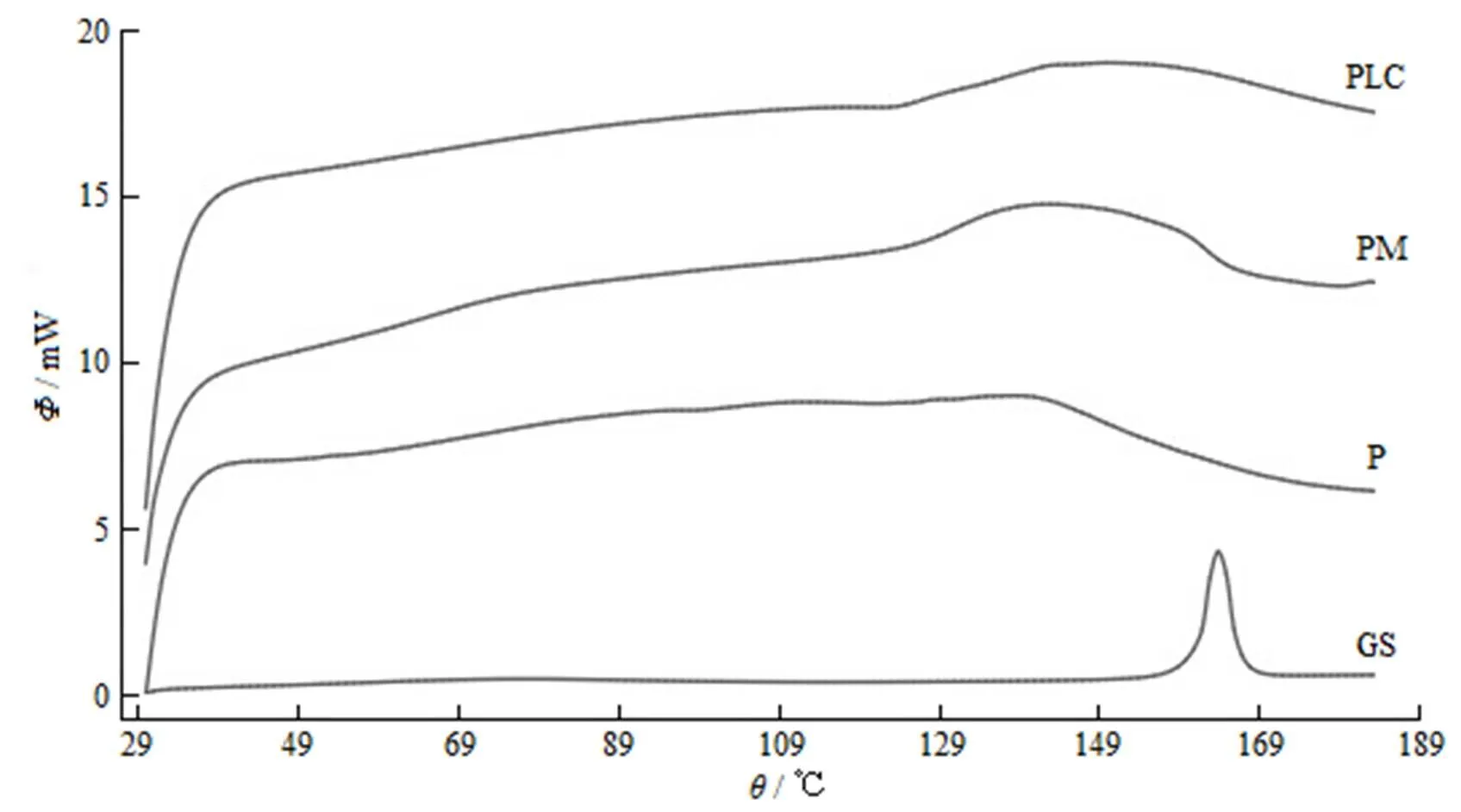
Fig. 3 DSC thermograms of GS (GS), egg phospholipid (P), PM and GS-PLC (PLC)
2.7.3 红外(FTIR)分析
取栀子苷、磷脂、栀子苷与磷脂的物理混合物和磷脂复合物用KBr压片法在4 000~400 cm-1进行红外光谱分析,结果表明(图4),栀子苷与磷脂的红外光谱是完全不同的。栀子苷的特征吸收峰为3 427.0 cm-1处的羟基峰,磷脂的特征吸收峰是2 920.7 cm-1,2 850.8 cm-1(—CH),1 732.0 cm-1(C=O),1 428.4 cm-1(=C—H),1 238.2 cm-1(P=O),1 088.5 cm-1(O—C),970.4 cm-1(P—O)和831.7 cm-1(—C=CH),表明有饱和烷基、酯、磷酸盐、甲基的存在。栀子苷与磷脂的物理混合物红外光谱基本为两者的简单叠加,且基本呈现磷脂的红外特征,而栀子苷磷脂复合物的图谱与之完全不同,3 427.0 cm-1处的—OH伸缩振动峰迁移至3 384.1 cm-1处,且宽度加宽,强度变弱,1 104.0 cm-1处的C—O伸缩振动峰消失,烷基的C—H伸缩振动只有2 922.5和2 852.7 cm-1两处,这说明栀子苷结构中的羟基可能受磷脂分子的极性基团的影响。而1 631.0 cm-1处吸收峰的形状和宽度也发生了一定的变化,说明磷脂的结构也同样受到栀子苷的影响。红外分析表明磷脂复合物中栀子苷与磷脂的基本化学结构没有发生根本的改变,未形成新的化合物,也不同于物理混合物,而是由分子间相互作用形成的磷脂复合物。
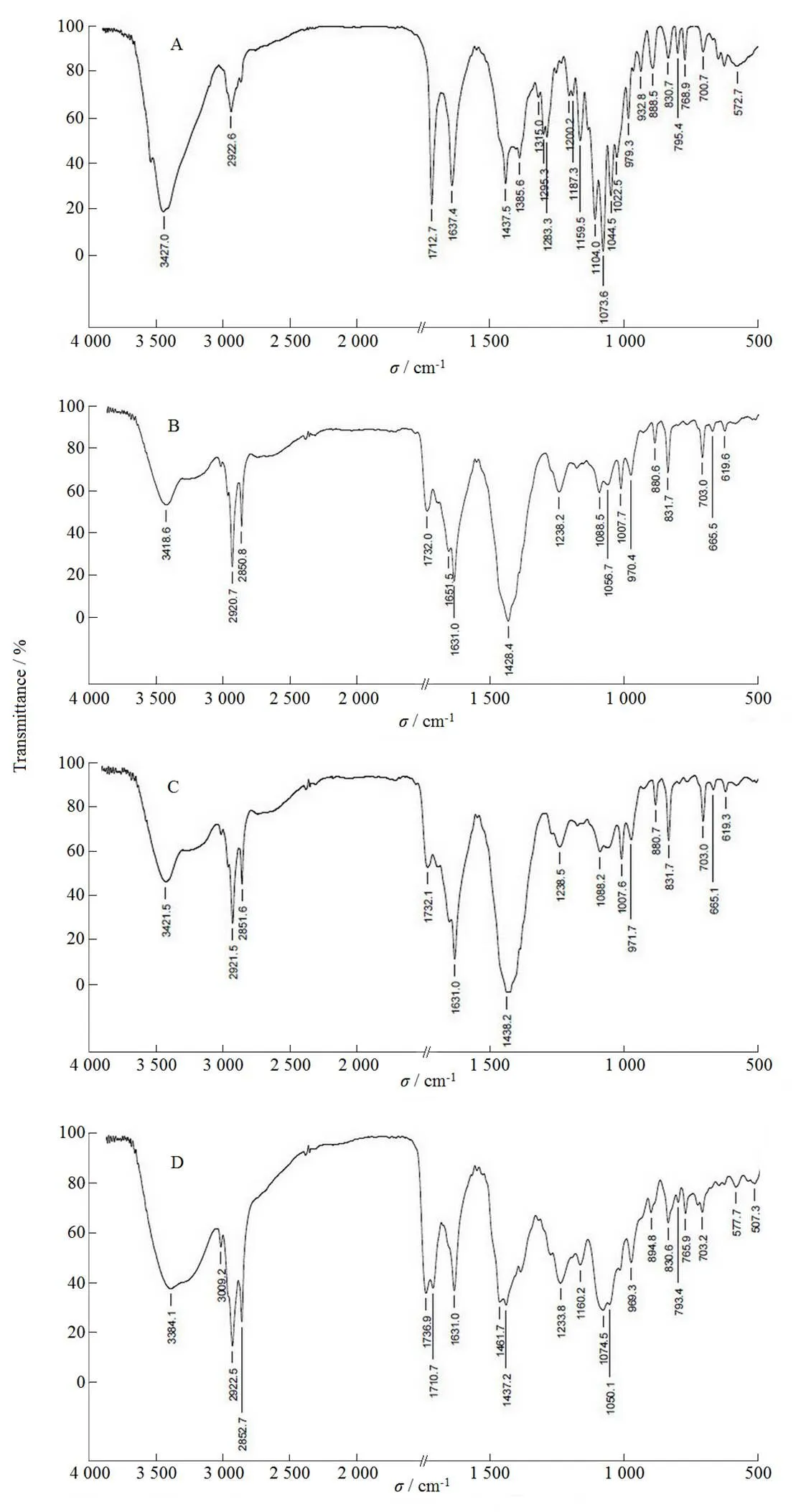
Fig. 4 FTIR spectra of GS (A), egg phospholipid(B), PM(C) and GS-PLC (D)
2.7.4 X-射线衍射(PXRD)分析
取适量栀子苷、磷脂、栀子苷与磷脂的物理混合物和磷脂复合物分别填塞于样品皿中,使用Ni-滤波器,CuKα 射线,40 kV电压和40 mA电流,在10°~90°的2范围内以4°·min-1速率进行扫描,绘制其X射线衍射图(图5)。栀子苷的XRD图谱显示出一个尖锐的峰,证明其具有高度结晶态,而磷脂的缓峰证明了其无定型态。栀子苷与磷脂的物理混合物仍有栀子苷的一部分特征峰。相反,磷脂复合物的衍射模式却是缓峰,即说明栀子苷在磷脂复合物形态下结晶度有所损失。
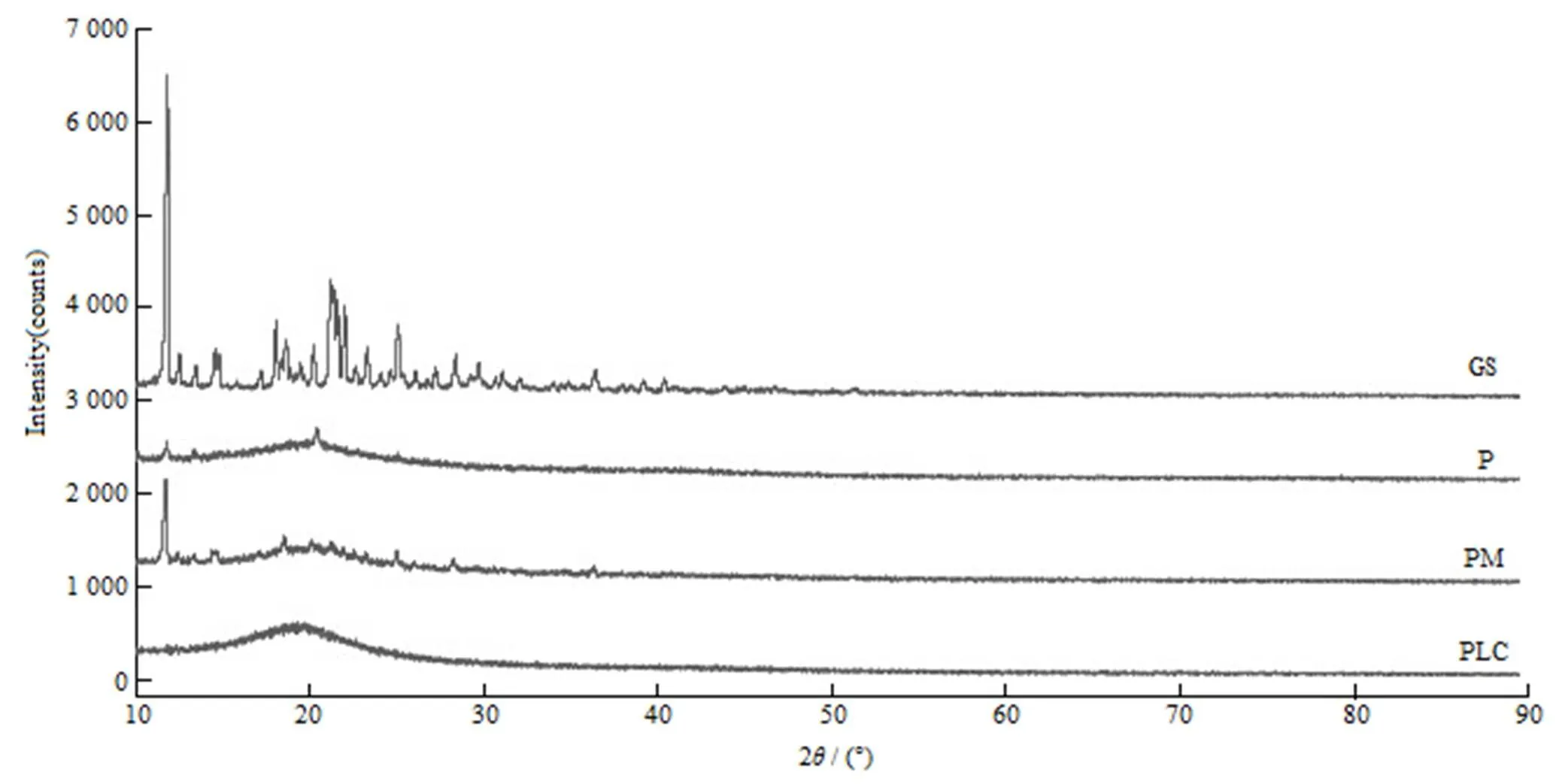
Fig. 5 PXRD Patterns of GS (GS), egg phospholipid (P), PM and GS-PLC (PLC)
2.7.5 扫描电镜(SEM)分析
称取栀子苷和栀子苷磷脂复合物适量,喷铂后在5.0 kV加速电压下,利用扫描电镜在适当放大倍数下对其表面形态进行观察。结果发现(图6),栀子苷为柱状结晶,多呈块状,颗粒较大;而磷脂复合物中栀子苷被磷脂包裹,结晶状消失,说明栀子苷与磷脂间发生了相互作用。
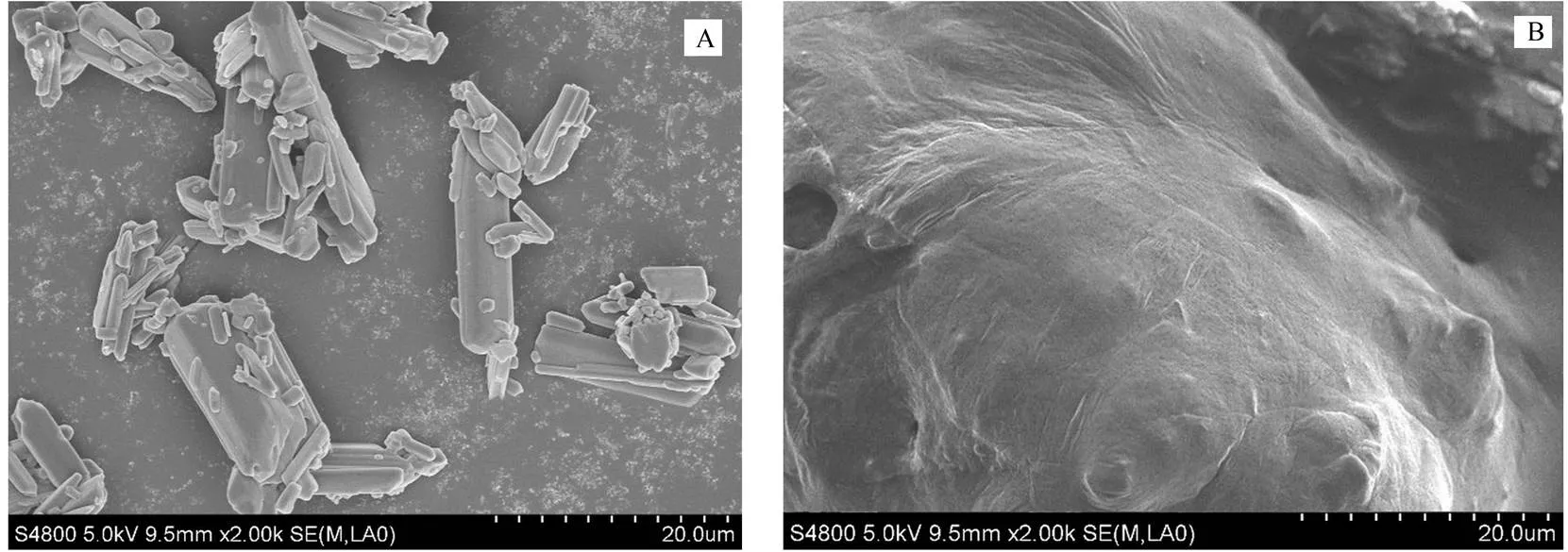
Fig. 6 SEM analysis (×2 000) of GS (A) and GS-PLC (B)
3 结论与讨论
a. 根据栀子苷理化性质及参考的大量文献,作者采用溶剂蒸发法制备栀子苷磷脂复合物,以栀子苷与磷脂复合的复合率作为评价指标[2-5, 8-10],进行单因素考察,单因素试验结果以磷脂复合物的复合率和载药量为评价指标,对制备栀子苷磷脂复合物的影响因素:药物质量浓度、反应物投料比、反应时间和反应温度进行了筛选,再经石油醚溶解、过滤并蒸干,进一步优化了栀子苷磷脂复合物的制备工艺,按所得的优化条件所制备的磷脂复合物复合率可达100%。通过本实验可以发现,栀子苷与磷脂间的复合反应比较容易进行,反应条件较易得,这可能是因为栀子苷与磷脂间生成了氢键或分子间作用力。
b. 测定油水分配系数的实验采用了摇瓶法,但物理混合物和磷脂复合物在正辛醇与水的界线处形成了宽的乳化带,导致正辛醇相与水相难以分离,这可能是由于磷脂本身的乳化作用。因此,实验中分别测定了物质在水和正辛醇中的平衡溶解度[11],再根据公式计算油水分配系数,以保证实验结果的准确性。根据实验结果,测得栀子苷磷脂复合物的lgapp= 1.05,在一定程度上提高了栀子苷在正辛醇中的溶解度,究其原因可能是由于复合物中磷脂的极性基团与栀子苷相互作用,在一定程度上掩蔽了极性基团,增加了亲脂性。
c. 紫外光谱分析结果显示复合过程中并未生成新物质,表明栀子苷磷脂复合物不属于新的化合物,而红外光谱分析结果中磷脂复合物的特征峰吸收强度发生了显著的变化,特征峰的位置也有发生一定的变化,可能是由于两种物质虽没产生新基团,但可能栀子苷的官能团与磷脂分子的P—O键之间发生了相互作用,如氢键或分子间作用力等。结合差示扫描量热分析、X射线粉末衍射分析及SEM电镜分析结果,表明栀子苷磷脂复合物并不是磷脂分子与栀子苷简单的物理混合,而可能是分子间相互作用力形成的。
d. 作者成功制备了栀子苷磷脂复合物,处方简单,载药量较高。在后续研究中,将根据《中药、天然药物稳定性研究技术指导原则》,通过影响因素试验、加速试验等进一步考察栀子苷磷脂复合物的稳定性,并进行动物体内的药代动力学研究,为该复合物的开发和应用提供参考。
[1] SHAN Mingqiu, YU Sheng, YAN Hui, et al. A review on the phytochemistry, pharmacology, pharmacokinetics and toxicology of geniposide, a natural product[J]. Molecules2017, 22 (10): 1-29.
[2] KHAN J, ALEXANDER A, SARAF S, et al. Luteolin–phospholipid complex: preparation, characterization and biological evaluation[J]. J Pharm Pharmacol2014, 66 (10): 1451-1462.
[3] KHAN J, ALEXANDER A, SARAF S, et al. Recent advances and future prospects of phyto-phospholipid complexation technique for improving pharmacokinetic profile of plant actives[J]. Journal of Controlled Release2013, 168 (1): 50-60.
[4] 薛海平, 高婷婷, 杨骏, 等. 红景天苷磷脂复合物的制备与表征[J]. 中草药, 2015, 22 (46): 3333-3337.
[5] 贺小玲, 苏冰, 王东凯, 等. 羟基喜树碱磷脂复合物的溶解性考察与表征[J]. 中国新药杂志, 2010, 19 (6): 541-543.
[6] 赵文娜, 尚平平, 孙文基, 等. HPLC法测定龙胆苦苷的表观油水分配系数[J]. 药物分析杂志, 2009, 29(7): 1093-1095.
[7] 阎雪莹, 张玉华, 匡海学, 等. HPLC法测定莫诺苷的表观油水分配系数:中国科技论文在线[EB/OL]. (2008-02-22). http://www.paper.edu.cn/releasepaper/content/200802226.
[8] PU Yiqiong, ZHANG Xitong, ZHANG Tong, et al. 20()-Protopanaxadiol phospholipid complex: process optimization, characterization,dissolution and molecular docking studies[J]. Molecules, 2016, 21 (10): 1396-1416.
[9] KHURANA R K, BANSAL A K, SINGH B, et al. Enhancing biopharmaceutical attributes of phospholipid complex-loaded nanostructured lipidic carriers of mangiferin: Systematic development, characterization and evaluation[J]. International Journal of Pharmaceutics, 2017, 518 (1/2): 289-306.
[10] 王梦姝, 吕晓玲, 李静, 等. 黑米花色苷磷脂复合物的制备及生物利用度[J]. 食品科技, 2017, 42(5): 242-245.
[11] 赵颖, 陈剑, 管海燕, 等. 松萝酸磷脂复合物的制备及表征[J]. 中国实验方剂学杂志, 2018, 24 (21): 20-25.
Preparation and evaluation of geniposide phospholipid complex
WU Tong1, WANG Jinyue1, YE Qingzhuo1, ZHANG Xiangrong2*
(1.,,110016,; 2.,,110016,)
To develop a carrier system incorporating geniposide (GS) with phospholipid for improving the liposolubility of geniposide.Geniposide phospholipid complex (GS-PLC) was prepared by using solvent evaporation method. Through a single-factor experiment, according to the complex yield ratio (CR%) and drug loading (DL), the effects of the concentration of geniposide, the ratio of geniposide and egg phospholipid, reaction temperature and reaction time on GS-PLC were investigated. The physicochemical properties of geniposide, physical mixture of geniposide and egg phospholipid (PM) and GS-PLC were characterized by ultraviolet (UV) spectra, Fourier transform infrared spectrum (FTIR), differential scanning calorimetry (DSC), powder X-ray diffraction (PXRD), scanning electron microscope (SEM) and the apparent oil-water partition coefficient (app).The optimal preparation of GS-PLC was as follows: the geniposide and egg phospholipid with a mass ratio of 1∶3.6 were dissolved in ethanol to ensure the concentration of 1.0 g·L-1geniposide and the reaction was carried out at 40 °C for 1 h. The CR%was about 99.93% and DL was about 21.77% by the optimal preparation. After preparation of GS-PLC, the lgappwas increased from -2.10 to 1.05.This optimized preparation technology in this research is feasible and easy, the CR% is high, and the lipid solubility of the geniposide is obviously improved.
pharmaceutics;phospholipid complex; solvent evaporation method; geniposide; complex yield ratio; soluble drug
2018-12-06
辽宁省科学技术基金(20170540864)
吴桐(1994-), 女(汉族), 吉林辽源人, 硕士研究生, E-mail 15590343399@163.com;
张向荣(1969-), 女(汉族), 辽宁沈阳人, 副教授, 博士, 主要从事药物新剂型研究, Tel. 15802498045, E-mail xrzhxr@126.com。
(2019)01–0001–11
10.14146/j.cnki.cjp.2019.01.001
R94
A
(本篇责任编辑:赵桂芝)
