血清胱抑素C水平与脑小血管病关系的研究
2019-01-19张新奇张杰文
张新奇 张杰文 黄 月
郑州大学人民医院神经内科,河南 郑州 450003
研究报道,慢性肾脏疾病(CKD)与无症状脑梗死,脑白质病变和脑微出血有关[1]。由于两个器官的微血管在解剖学和功能上相似,所以肾和脑具有独特的血管损伤易感性[2]。脑小血管病和脑白质病变是由血管内皮功能障碍、缺血性动脉硬化、低灌注和血脑屏障破坏引起[3-5]。肾功能损害的特征主要是肾小球内皮功能障碍和脂质沉积,两者都是小动脉疾病的特征[6-7]。因此,肾脏的损伤标记物可以用来当作小血管病和白质病变的存在和严重程度的预测性标记物[8]。胱氨酸蛋白酶抑制剂C(胱抑素C)作为代替肌酐评估肾小球滤过率的标记物,表现出更高的灵敏性和准确性[9]。本次研究探讨半胱氨酸蛋白酶抑制剂C与CSVD的相关性。
1 对象与方法
1.1对象回顾性分析2017-01—2018-04在郑州大学人民医院就诊的98例发病2周内的因各种原因住院并行头颅MRI检查诊断为脑小血管病的患者和同期进行体检的正常人134例为研究对象。记录病史,并进行详细的诊断评估,包括神经系统检查、血液检查、MRI和尿液检查。腔隙性脑卒中定义为急性脑卒中综合征,伴有MRI上最小直径(最大直径15 mm)的梗死与临床结果相符。受试者一般资料差异无统计学意义(P>0.05),具有可比性。
1.2方法纳入标准:符合以下1个或多个临床表现:(1)1个月内新发腔隙性梗死患者(临床腔隙性卒中综合征,MRI、DWI序列证实有症状相关病灶<20mm,临床无皮层症状);(2)1个月内新发非外伤性脑实质出血患者;(3)头颅MRI显示血管源性脑白质高信号患者(FAZEKAS评分≥2分);(4)头颅MRI病灶显示腔隙病灶≥1个;(5)年龄≥18岁;(5)改良Rankin评分≤3分(1个月内新发腔隙性梗死或新发非外伤性脑实质出血患者改良Rankin评分≤4分);(6)签署知情同意书。
临床表现和影像学检查符合《2013中国脑小血管病诊治专家共识》的诊断标准,影像学表现:(1)腔隙性梗死;(2)脑白质疏松;(3)脑微出血;(4)血管周围间隙扩大。
排除标准:(1)合并其他严重疾病,预期寿命<2 a;(2)不能进行MRI检查;(3)新发腔隙性梗死患者,病灶同侧颈内动脉、大脑中动脉或其他可能供血该病灶的大动脉狭窄>50%;(4)新发腔隙性梗死患者,有重要的心源性栓塞证据;(5)本次卒中由外伤导致;(6)非血管源性的脑白质病变;(7)其他无关的严重精神疾病或严重神经系统疾病;(8)合并痴呆或帕金森病。
1.3影像学检查所有患者均在发病2周内进行头颅磁共振(T2WI、DWI、FLAIR等序列)检查。多模式磁共振成像扫描采用西门子3.0T(trio tim)磁共振成像系统(Siemens AG,Erlangen,Germany),头颅12通道线圈。1名受过训练的医生对MRI进行评估,该医生对受试者的临床细节不知情。Fazekas量表用于评估WMH。
1.4血样的收集与检测过夜禁食后06:00~08:00获取患者血样。通过950全自动生化分析仪(American Johnson&Johnson,Rochester,New York,United States)测量血清CysC水平。采用全自动生化仪测定血清总胆固醇(TC)、甘油三酯、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和糖化血红蛋白。检测项目均由专业人员操作。
2 结果
2.1各种危险因素和WMH严重程度的关系根据WMH严重程度将对照组与患者分为无WMH(Fazekas评分0),中度WMH (Fazekas评分2~3分),重度WMH(Fazekas评分4~6分)。。如表1所示,较高的血清CysC水平与WMH严重程度相关。WMH患者的年龄高于对照组。三个等级的WMH之间的比较表明,具有严重WMH的受试者具有较高年龄、高糖化血红蛋白的趋势(然而,甘油三酯、HDL、LDL、肌酐含量呈逆向趋势)。
2.2脑小血管病各相关危险因素Logistic回归分析在多因素调整Logistic分析中(表2),糖化血红蛋白、总胆固醇、甘油三酯、HDL、LDL、肌酐、Cysc均P<0.01,每增加一个变量单位患cSVD的OR值和95%CI分别为:年龄0.942(0.888~0.998),糖化血红蛋白0.038(1.178~2.693)、总胆固醇12.085(3.130~52.380)、甘油三酯0.398(0.206~0.771)、HDL0.013(0.002~0.109)、LDL0.038(0.008~0.182)、肌酐0.941(0.901~0.981)、Cysc1.081(1.041~1.122)。Cysc的OR值大于1,表明Cysc升高为导致cSVD的危险因素。
2.3 Cysc水平升高和WMH严重程度的关系多因素逻辑回归分析如表3所示,有序多分类Logistic回归分析显示患者的CysC水平与未经调整的WMH严重程度显著相关。校正年龄和性别后,CysC水平升高仍与WMH严重程度有关。最后,对所有纳入的混杂因素进行调整,包括年龄,性别,糖化血红蛋白,总胆固醇,甘油三酯,HDL,LDL,肌酐,CysC水平升高仍与WMH严重程度显著相关,混杂因素对对结果影响不大。结果解释为Cysc每增长1 mg,WMH分级增高一个等级的优势比为(1.064),95%置信区间为(1.033~1.095)。

表1 各种危险因素与WMH严重程度的关系Table 1 Relationship between various risk factors and severity of WMH
注:数值是百分比,未调整平均值(SD)。使用单因素方差分析对三组间的差异进行测试,卡方检验用于比较比例;TG甘油三酯,TC总胆固醇,HDL高密度脂蛋白,LDL低密度脂蛋白,CREA肌酐,Cysc半胱氨酸蛋白酶抑制剂C
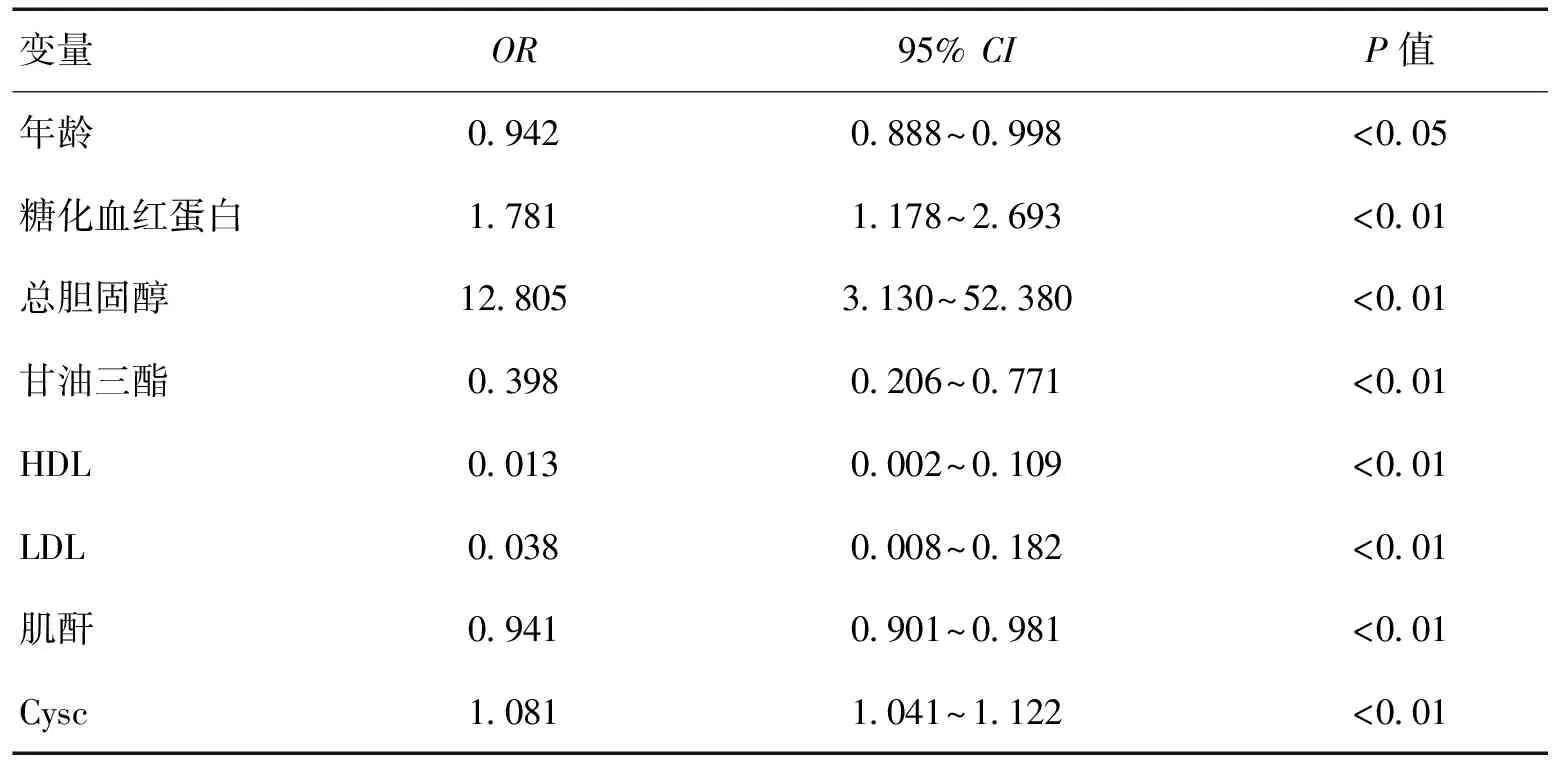
表2 脑小血管病各相关危险因素Logistic回归分析Table 2 Logistic regression analysis of risk factors associated with cerebral small vessel disease

表3 Cysc水平升高和WMH严重程度的关系多因素逻辑回归分析Table 3 Multivariate Logistic regression analysis of the relationship between elevated Cysc levels and severity of WMH
注:CI,confidence interval;cSVD,cerebral small vessel disease;CysC,cystatin C;OR,odds ratio.模型1:针对年龄,性别进行调整。模型2:针对年龄,性别,糖化血红蛋白,总胆固醇,TC,LDL,HDL,肌酐,Fazekas评分进行调整,*P<0.05,**P<0.001
3 讨论
本研究观察到CSVD患者的血浆Cys C水平显著高于对照组(P<0.01),对CSVD各危险因素进行Logistic回归分析显示,CysC水平升高与CSVD的WML严重程度显著相关。Cys C水平升高是CSVD发生的独立危险因素。以前的研究表明CKD与CSVD相关[10]。因为两个器官的微血管系统的血管调节在解剖学和功能上相似[11-12],所以肾和脑具有独特的血管损伤易感性。髓质肾单位的肾小球入球小动脉和大脑穿支动脉都是小而短的血管,直接发自大的高压动脉。动脉因此暴露于高压下,并且它们必须保持强烈的血管紧张度以在短距离内提供大的压力梯度。有人将这些血管称为“应变血管”,并将冠脉微循环和视网膜动脉列为其他应变血管。高血压性血管损伤首先发生在此类血管[13-14]。Cys C具有能自由通过肾小球滤过以及不被肾小管吸收和分泌、肾脏为清除循环Cys C的惟一器官的特点,并且与肌酐相比,Cys C可在所有组织中持续恒定地转录与表达,受肾外因素如甘油三酯水平及年龄、性别、种族、体质量等影响较小[10,15],因此Cys C是相对于EGFR或蛋白尿,反映肾小球滤过功能变化的更为理想的内源性标志物。最终,CysC水平可能是CSVD更好的预测指标[16]。
研究表明,CysC与炎症相关[17-18],其是脑血管疾病的一项潜在风险[19]。CSVD的相关研究显示,胱抑素C与脑白质病变或无症状脑梗死有密切关系[20-21]。心血管健康研究发现,老年人中胱抑素C和多变量调整后SBI的患病率呈正相关[22]。韩国的一项研究支持这些先前的发现,由肌酐或胱抑素C测量结果得出的较差的肾功能与WML有关[23]。有研究报道,血清CysC水平升高与腔隙性梗死或中度WMLs(Fazekas 2和3级)患病率增加有关[24]。此外,CysC水平越高的受试者,腔隙梗死越多,WMLs级别越高[25-26]。
本研究不足之处:(1)胱抑素C水平未被重复测量,伴随卒中或卒中严重程度的急性期反应可能会影响胱抑素C的水平。(2)这项研究是在卒中患者中进行的,与基于社区的人群相比,纳入的各方可能有更多的合并疾病,如糖尿病和高血压,这些也是CSVD的危险因素。(3)我们无法精确地获得一些患者以前使用心血管药物史,这可能是研究中的一个混杂因素。(4)大部分选择的病人病情较轻。因此,选择偏倚可能会导致低估CysC水平与CSVD之间的关联。
CSVD患者CysC升高为导致CSVD的危险因素,血清CysC水平与WML严重程度相关,并且在未来的试验中应该评估控制CysC水平是否可以预防或减轻CSVD。
