三种土壤条件下紫茎泽兰根际的酶活性及细菌群落状况
2019-01-18王玉书焦玉洁彭丽媛郭明全陈玉蓝
刘 海,王玉书,焦玉洁,彭丽媛,郭明全,王 勇,陈玉蓝,袁 玲,*
1 西南大学资源环境学院,重庆 400716 2 贵州省农业科学院农业科技信息研究所,贵阳 550006 3 四川省烟草公司凉山州公司,西昌 615000
紫茎泽兰(Eupatoriumadenophorum)属菊科泽兰属杂草,原产中美洲。20世纪40年代从中缅边境传入我国,现已遍布云南、贵州、四川、重庆和广西等西南地区,并以每年30—60 km的速度向我国东部和北部蔓延[1]。目前,人们采用化学、生物、人工等多种方法防除紫茎泽兰,但效果欠佳,难于有效遏制其蔓延[2- 5]。
土壤是植物生长的场所,二者之间相互作用和影响。根际土壤的理化生物学性质直接影响植物吸收水分、养分和生长发育;另一方面,根系生命活动深刻改变根际环境的物理、化学,尤其是微生物学性质。在紫茎泽兰侵入过程中,土壤自生固氮菌、氨氧化细菌和真菌数量增加,氮磷有效性提高,有益于养分吸收[6- 9]。紫茎泽兰根际还存在拮抗病原微生物的细菌群落,使其免患土传病害[10]。因此,从土壤微生物的角度看,紫茎泽兰存在自我促进的侵入机制[11]。但祖元刚等[12]报道,在紫茎泽兰根际土壤中,真菌和细菌的数量显著低于喜树,其蔓延扩散不改变土壤真菌和细菌的多样性。此外,紫茎泽兰还通过根系分泌、植株残体和降雨淋溶向土壤中大量释放化感物质,如单萜类、倍半萜类、甾体类、三萜类、苯丙素类、黄酮类及各类衍生物等[13- 14]。其中,泽兰酮、香叶醛、香茅醛、香豆素、乙酸龙脑酯和樟脑等含量较高,对微生物具有选择毒性,导致土壤细菌数量减少,真菌和放线菌数量增加[15- 16]。尽管紫茎泽兰分泌的部分化感毒物含有苯、奈、菲、蒽等多环芳烃,但假单胞菌(Pseudomonas)、反硝化产碱菌(Alcaligenesdenitrificans)、诺卡氏菌(Nocardia)、解环菌(Cycloclasticus)、多色节杆菌(Arthrobacterpolychromogenes)和乙酸钙不动杆菌(Acinetobactercalcoaceticus)等土壤微生物能利用其中的碳、氮而使其降解,故对其生长和繁殖影响不大[17- 18]。由此可见,紫茎泽兰入侵对土壤微生物的影响十分复杂,目前尚无定论。
微生物是土壤的重要组成部分,参与土壤有机质循环,养分转化,结构形成、毒物降解等物理、化学和生物学过程,与土壤健康质量密切相关[19-21]。紫茎泽兰残体和根系分泌物进入土壤后,可能影响微生物繁殖、生长和新陈代谢,进而改变微生物数量、活性和群落结构。明确紫茎泽兰对土壤微生物的影响有益于揭示其侵入机制,为有效防除紫茎泽兰提供科学依据。四川省凉山州是紫茎泽兰入侵的重灾区,危害面积超过幅员面积的20%。试验选择当地的主要土壤-红壤,黄壤和紫色土,采用常规与高通量测序技术,研究了紫茎泽兰根际和非根际土壤(距离根系约20 cm)的酶活性和细菌群落结构。
1 材料与方法
1.1 研究区概况
研究地点位于四川省凉山州西昌市(27°47′—28°02′N,102°10′—102°16′E),属亚热带高原印度洋季风气候,年均日照2423.1 h,年均雨量1013.1 mm,5月中旬—10月中旬的降雨量约占全年的90%,年均蒸发量1945 mm。当地的主要土壤类型为红壤、黄壤和紫色土,是凉山州紫茎泽兰分布最广和面积最大的地区之一。
1.2 样地选择及取样
每年8月中旬是当地紫茎泽兰生物量最大的时期。试验于2016年8月中旬进行,分别选择典型、具有代表性的红壤、黄壤和紫色土(表1),分别在紫茎泽兰生长茂盛、形成单优种群的每种土壤上,各选择5个10—15 m2的样地,在每个样地内选5点用抖根法采集根际土壤,并在紫茎泽兰群体外约20 cm处的空地选择5点同步采集非根际土壤,充分混匀并拣除杂物,置于冰盒,迅速带回实验室测定微生物量碳氮,剩余土样一分为二,一份风干过筛,备测土壤酶活性(过氧化氢酶、酸性磷酸酶、脲酶、蔗糖酶);另一份-20℃保存,用于细菌高通量测序。
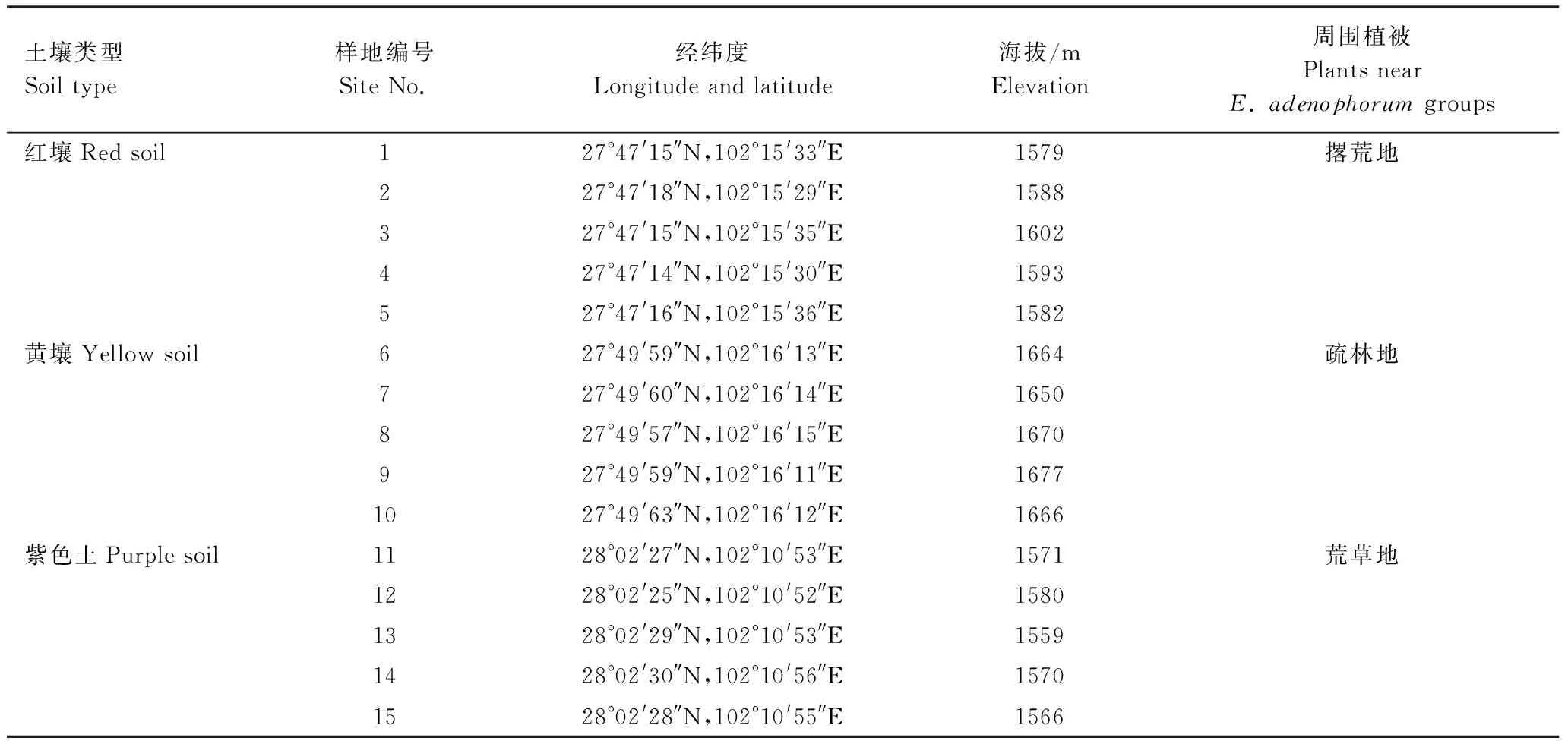
表1 紫茎泽兰样地的地理信息
1.3 测定方法
采用氯仿熏蒸-K2SO4浸提,重铬酸钾氧化法和靛酚蓝比色法分别测定土壤微生物量碳、氮[22]。分别采用靛酚蓝比色法、3,5-二硝基水杨酸比色法、磷酸苯二钠法和高锰酸钾滴定法测定脲酶、蔗糖酶、酸性磷酸酶和过氧化氢酶活性[17]。其中,过氧化氢酶活性用20 min每克土壤分解的过氧化氢(毫升)表示,脲酶、蔗糖酶及酸性磷酸酶活性则依次用24 h每克土壤产生的NH3-N、葡萄糖和酚(毫克)表示。
取-20℃保存的新鲜土样,参照454高通量测序方法,用E.Z.N.A Soil DNA试剂盒(OMEGA,USA),提取土壤基因组,纯化后用1%琼脂糖凝胶电泳检测DNA大小及片段完整性,NanoDrop2000检测DNA纯度,TBS- 380检测DNA浓度。用ABI GeneAmp® 9700型 PCR 仪,扩增细菌16S rDNA V3—V4区,引物为338F (5′-ACTCCTACGGGAGGCAGCA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)。PCR反应体系:FastPfu缓冲液4.0 μL、dNTPs(2.5 mmol/L)2.0 μL、引物(5 μmol/L)各0.8 μL、FastPfu聚合酶0.4 μL、BSA 0.2 μL、模板DNA10 ng、补ddH2O至20 μL。PCR扩增程序:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,共28个循环,72℃终延伸10 min结束。每个样品重复3次,将同一样品的PCR产物混合后用2%琼脂糖凝胶再次电泳检测,用AxyPrepDNA 凝胶回收试剂盒(AXYGEN,USA)切胶回收PCR产物,并用QuantiFluorTM-ST蓝色荧光定量系统定量检测。基因组测序在上海美吉生物科技有限公司进行,测序平台为454 GS-FLX(454 Life Sciences/Roche Diagnostics,CT,USA)。测序结束后,对有效序列进行去杂、修剪、去除嵌合体序列等过滤处理,得到优化序列。利用Usearch(vsesion 7.1)软件对优化序列进行聚类分析,根据序列97%的相似性形成操作分类单元(Operational taxonomic units,OUTs),对比GenBank(http://ncbi.nlm.nih. gov)中的已知序列,得到OTUs的分类学信息[23]。
1.4 数据处理
试验数据用Excel 2007和SPSS 19.0软件进行计算和统计分析,采用配对t检验法对根际和非根际土之间的微生物量碳、氮含量进行差异性检验(P<0.05)。利用16S rDNA序列数计算细菌群落丰富度[24]。
丰富度指数:
R=Ni/N
式中,N为序列总数,Ni为细菌i的16S rDNA读数。
2 结果与分析
2.1 土壤酶活性
由表2可知,在紫茎泽兰根际,土壤酶活性显著高于非根际(黄壤和紫色土的过氧化氢酶,以及紫色土的脲酶除外,其增幅未达显著水平),依次增加2.74%—62.84%(过氧化氢酶)、7.66%—439.68%(磷酸酶)、2.69%—92.73%(脲酶)和89.18%—562.68%(蔗糖酶)。

表2 紫茎泽兰根际和非根际土壤的酶活性
表中数据为平均值±标准差(n=5);*表示根际与非根际间差异达到5%显著水平(t检验)
2.2 土壤微生物量
配对t检验表明,在紫茎泽兰根际,微生物量碳氮显著高于非根际(红壤微生物量氮除外,其增幅未达显著水平),微生物量碳分别高于非根际39.60%(红壤)、47.47%(黄壤)和26.71%(紫色土);微生物量氮分别高于非根际18.51%(红壤)、48.13%(黄壤)和59.77%(紫色土)(图1)。
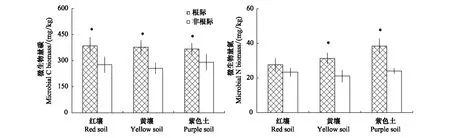
图1 紫茎泽兰土壤中的微生物量碳、氮Fig.1 Microbial biomass carbon and nitrogen in soil with E. adenophorum *表示根际与非根际间差异达到5%显著水平,t 检验
2.3 土壤细菌
2.3.1 序列数和分类单元数
由表3可见,454高通量测序从3种土壤中获得21284—39974条16S rDNA序列,分别代表820—1222个分类单元。配对t检验表明,红壤非根际序列数显著高于根际,紫色土根际序列数显著高于非根际,而黄壤根际与非根际相似;红壤根际细菌分类单元数显著低于非根际,黄壤和紫色土根际与非根际相似。
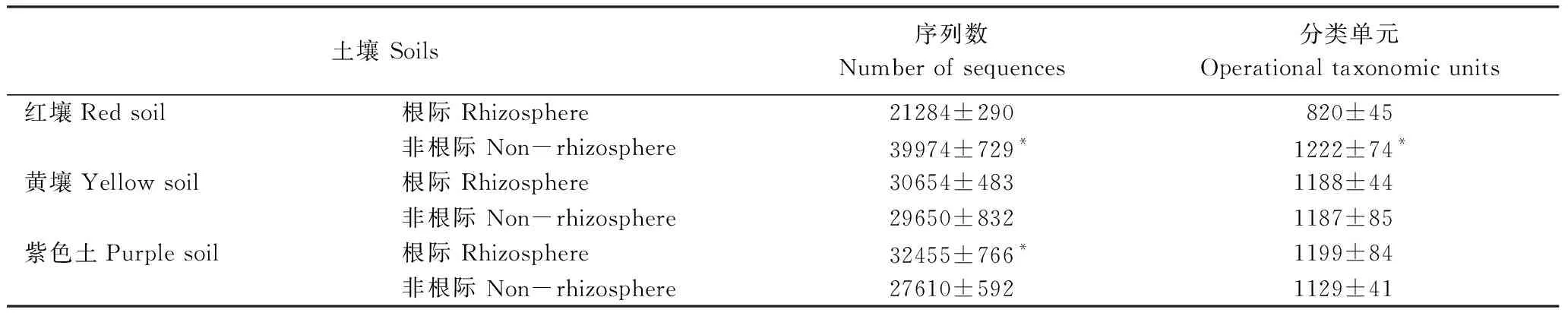
表3 紫茎泽兰根际和非根际16S rDNA序列数和分类单元数
表中数据为平均值±标准差(n=5);*表示根际与非根际间差异达到5%显著水平(t检验)
2.3.2 主成分分析
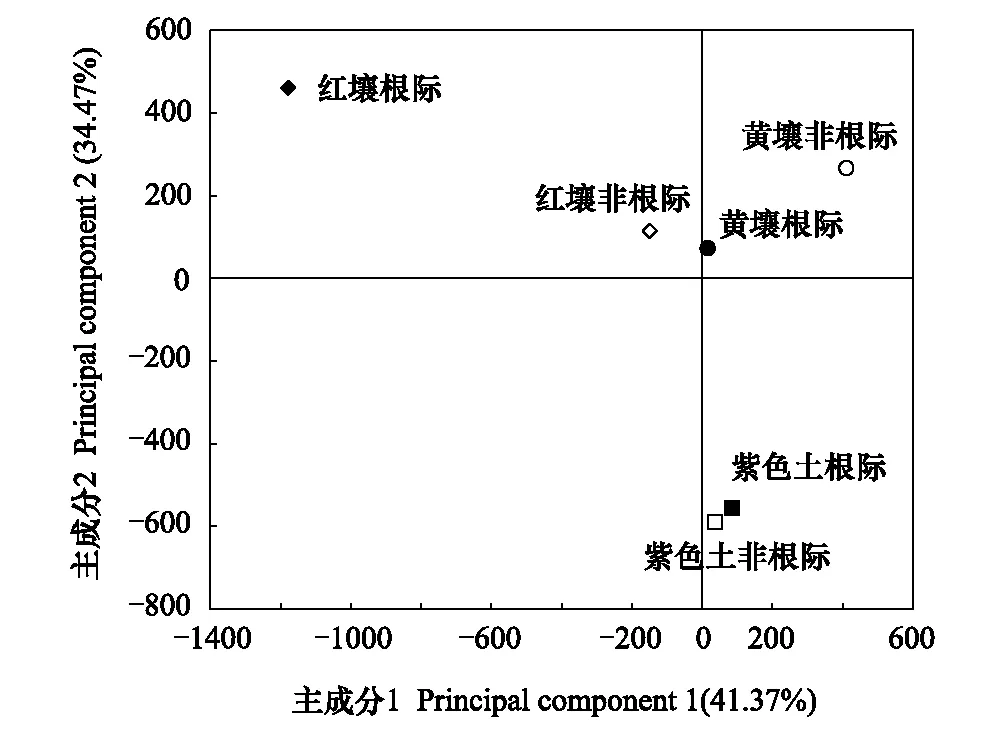
图2 土壤细菌群落的主成分变异Fig.2 Principal components variation of soil bacterial community
图2是土壤细菌群落的主成分变异情况。其中,PC1和PC2分别表示土壤细菌群落41.37%和34.47%的变异度。在红壤和黄壤中,根际细菌群落的主成分方差和在PC轴上的得分系数与非根际差异显著,其坐标点处于不同位置,相距较远;而紫色土则相反,根际细菌群落的主成分方差和在PC轴上的得分系数与非根际无显著差异,其坐标点相距较近。
2.3.3 细菌门类
由图3可见,在紫茎泽兰根际和非根际,细菌种群归属于放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和蓝藻门(Cyanobacteria)等16个门类。其中,放线菌门、变形菌门和拟杆菌门合占总量的60.69%—78.75%。
在根际和非根际之间,细菌门类的丰富度因土壤类型和细菌门类不同而异。从前3种优势门类看,红壤的优势细菌依次为放线菌门、拟杆菌门和变形菌门,根际放线菌门的丰富度与非根际相似,变形菌门根际低于非根际,但拟杆菌门则相反;黄壤的优势细菌依次为放线菌门、变形菌门和绿弯菌门,根际放线菌门的丰富度与非根际相似,变形菌门根际低于非根际,但绿弯菌门显著高于非根际;紫色土根际的优势细菌依次为变形菌门、拟杆菌门和放线菌门,非根际的则是变形菌门、拟杆菌门和酸杆菌门,其中变形菌门显著高于拟杆菌门,且二者非根际的丰富度均高于根际。
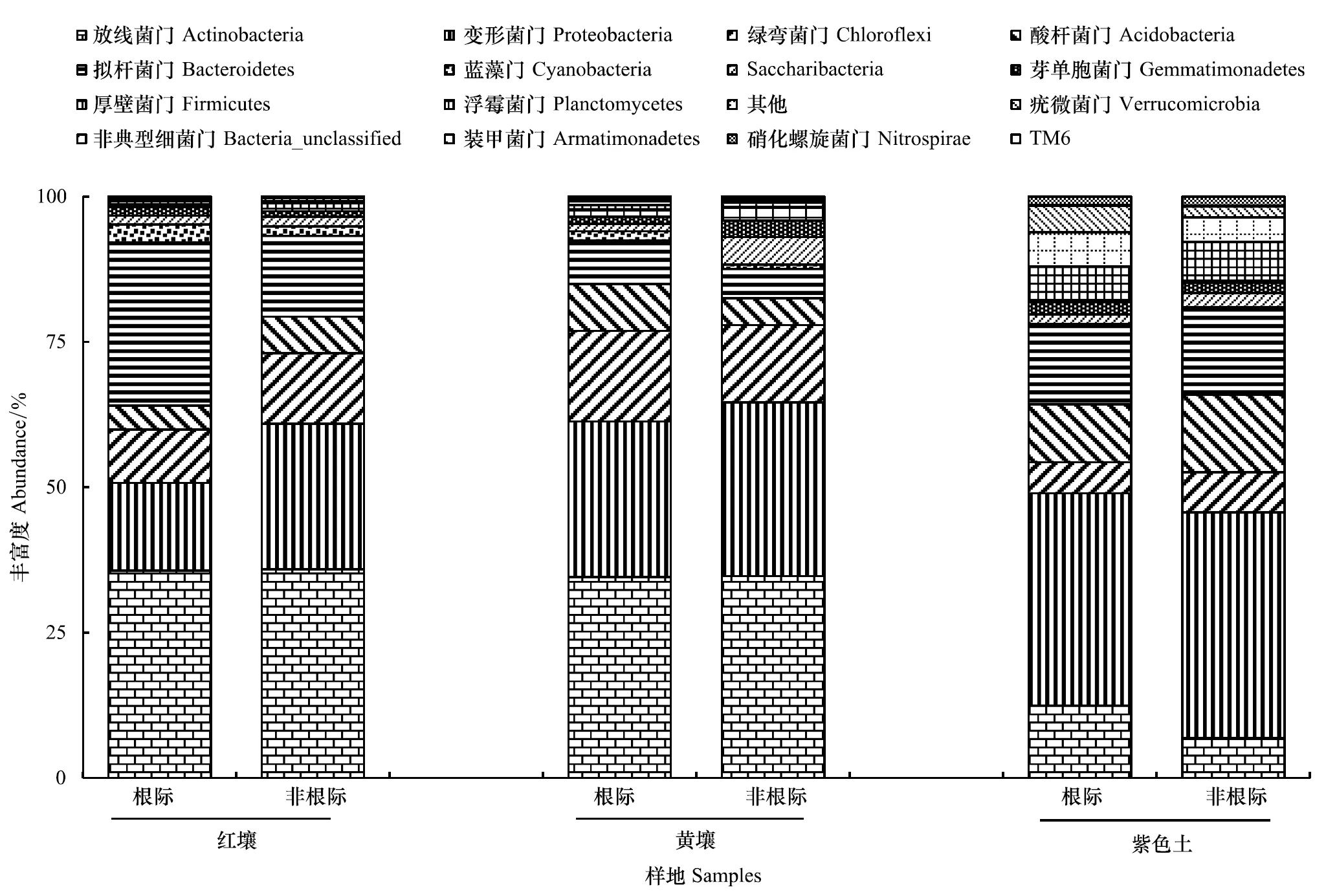
图3 紫茎泽兰根际和非根际土壤中的细菌门类及丰富度Fig.3 Bacterial phyla and abundances in rhizosphere and non-rhizosphere soil of E. adenophorum
2.3.4 优势类群
由表4可见,在紫茎泽兰根际和非根际土壤中,前20种优势细菌的丰富度合计占细菌总量的17.40%—36.57%。在不同土壤之间,20种优势细菌中仅链霉菌1(Streptomyces1)为紫茎泽兰根际的共有细菌,绿弯菌(Chloroflexi KD4- 96)为非根际共有细菌。在红壤中,紫茎泽兰根际和非根际有11种相同的细菌,它们是黄杆菌1(Flavobacterium1)、黄杆菌2(Flavobacterium2)、黄杆菌3(Flavobacterium3)、慢生根瘤菌(Bradyrhizobium)、芽生球菌(Blastococcus)、节杆菌(Arthrobacter)、链霉菌1、不可培养鞘脂单胞菌(unculturedKaistobactesp.)、不可培养红色杆菌(uncultured Solirubrobacterales)、不可培养间孢囊菌(uncultured Intrasporangiaceae)和小单孢菌2(Micromonosporaceae 2)。其中,黄杆菌1、黄杆菌3、黄杆菌2、不可培养鞘脂单胞菌、芽生球菌和不可培养间孢囊菌在根际的丰富度依次高于非根际6.24、4.48、4.41、1.43、1.38、1.11倍;而小单孢菌2、节杆菌、不可培养红色杆菌、慢生根瘤菌和链霉菌在根际的丰富度则不同程度地低于非根际。在黄壤中,紫茎泽兰根际和非根际有8种相同的细菌,分别为慢生根瘤菌、链霉菌1、节杆菌、不可培养鞘脂单胞菌、不可培养生丝微菌(uncultured Hyphomicrobiaceae)、绿弯菌、不可培养间孢囊菌和类诺卡氏菌1(Marmoricola1)。其中,慢生根瘤菌、链霉菌1、不可培养生丝微菌和不可培养鞘脂单胞菌在根际的丰富度分别高非根际3.46、1.76、1.58、1.30倍;而绿弯菌、不可培养间孢囊菌、类诺卡氏菌1和节杆菌在根际的丰富度显著低于非根际。在紫色土中,紫茎泽兰根际与非根际有10种相同细菌,依次为不可培养噬纤维菌(uncultured Cytophagaceae)、不可培养待鉴定菌Latescibacteria、变形菌(Proteobacteria)、不可培养浮霉菌(uncultured Planctomycetes)、绿弯菌、不可培养产碱菌(uncultured Alcaligenaceae)、黄杆菌2、丛毛单胞菌(Comamonadaceae)、黄杆菌(FlavobacteriumenshienseDK69)和黄杆菌3。其中,变形菌和不可培养浮霉菌在根际的丰富度分别高于非根际1.45—1.05倍;但是,不可培养噬纤维菌和不可培养待鉴定菌Latescibacteria在根际和非根际的丰富度无显著差异,其余菌属(种)的丰富度根际低于非根际。
3 讨论
土壤酶催化土壤生物化学反应,与土壤养分转化供应密切相关[17]。脲酶水解尿素,提高土壤氮素的生物有效性;蔗糖酶参与蔗糖降解,关系到土壤有机质矿化;磷酸酶催化有机磷水解,供植物吸收;过氧化氢酶促进过氧化氢分解,涉及到土壤解毒过程[25]。尽管土壤类型不同,但在紫茎泽兰根际土壤中,上述土壤酶的活性显著高于非根际,类似李会娜等和戴莲等的研究结果[26- 27],说明在紫茎泽兰根际,有机质转化活跃,氮磷有效性较高,有益于增加土壤养分供应,促进植物生长,提高紫茎泽兰生存竞争能力。此外,紫茎泽兰根际的微生物量碳氮显著高于非根际,意味着紫茎泽兰根系生命活动促进微生物生长繁殖,数量增加,活性增强,与李会娜等的研究结果相似[28],但不同于Sun等的报道[29]。土壤酶来源于有机肥、动物、植物和微生物等,其中微生物是土壤酶的重要来源之一[30- 31]。因此,在本项研究中,紫茎泽兰根际微生物量提高,可增加酶分泌量,增强土壤酶活性。
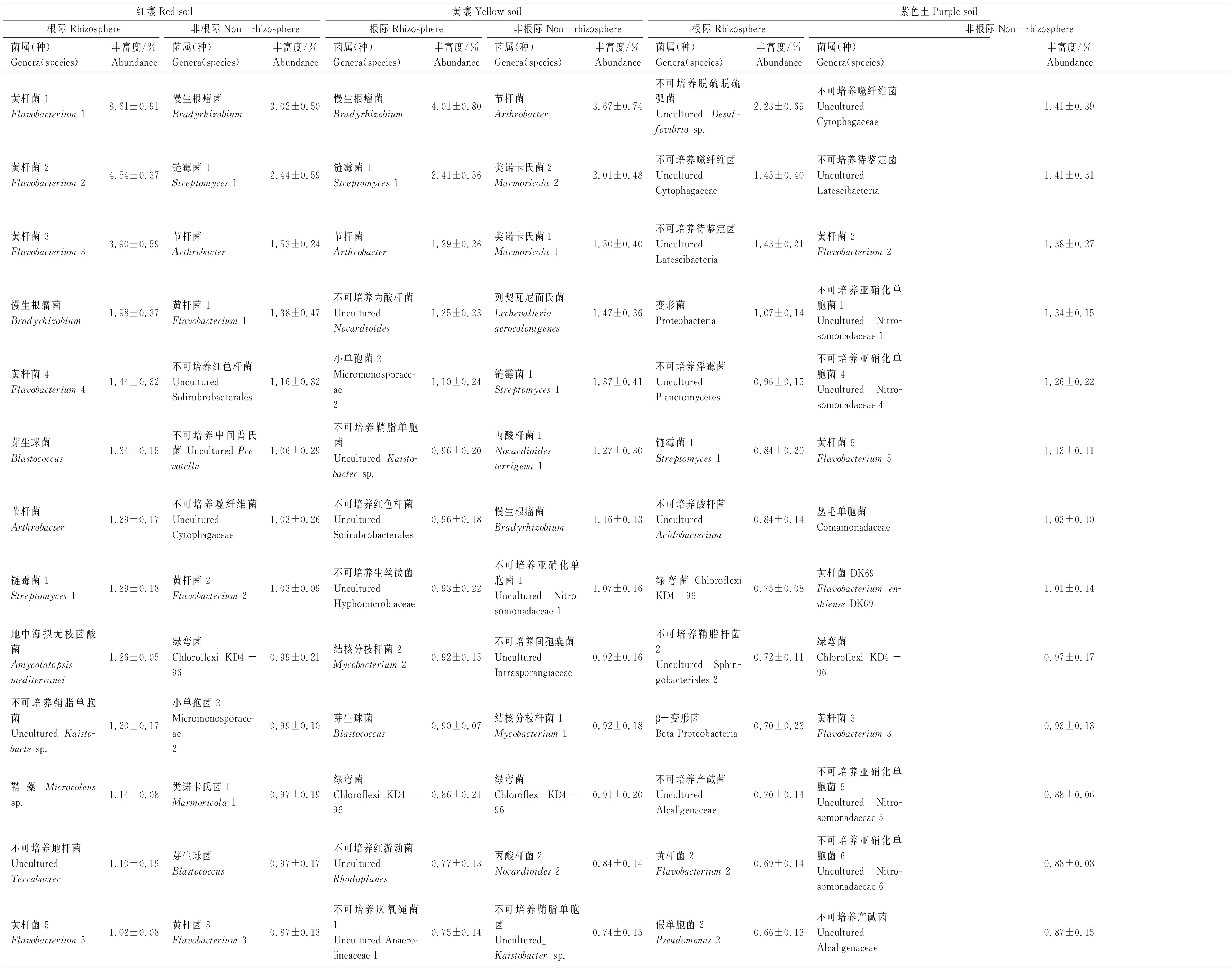
表4 在紫茎泽兰根际与非根际土壤中,前20种优势细菌的组成与丰富度
红壤根际的16S rDNA分类单元数显著低于非根际,黄壤和紫色土的根际与非根际相似;主成分分析表明,在红壤和黄壤根际土壤中,细菌群落的主成分方差和在PC轴上的得分系数与非根际差异显著,其坐标点处于不同位置,而紫色土根际和非根际则相反。说明紫茎泽兰对根际细菌种群数量和结构的影响因土壤类型不同而异,对红壤和黄壤细菌群落结构的影响较大,但对紫色土的影响较小。众所周知,土壤类型不同,微生物种群结构也不一样[32]。微生物种类不同,对各类化学物质如抗菌素、重金属等的敏感性和抗性也存在显著差异[33- 34]。例如,水稻细菌性条斑病菌[35]、枯草杆菌[36]对链霉素敏感,但交替单胞菌[37]、酪酸梭菌[38]的敏感性较差;贫营养细菌[39]、费氏弧菌[40]对重金属敏感,但弗兰克氏菌[41]、慢生根瘤菌[42]的敏感性差。紫茎泽兰根系分泌的化感物质内含苯、奈、菲、蒽等多环芳烃等结构,故对根际细菌群落结构的影响表现出土壤类型间的差异和多样性,由此解释了前人有关报道不尽相同的原因[8, 10, 15],深入研究紫茎泽兰侵入与不同土壤细菌群落演变的生理生态学意义很有必要。此外,尽管红壤、黄壤和紫色土的细菌群落不同,但紫茎泽兰表现出极强的适应性,均可旺盛生长,排除其他植物,形成单优种群。
在不同类型土壤之间,优势菌株的群落结构的差异极大。在根际的20种优势细菌中,仅链霉菌1(Streptomyces1)相同,在非根际只有绿弯菌(Chloroflexi KD4- 96)为共有菌株,意味着紫茎泽兰具有极强的适应性,能在细菌群落结构不同的土壤上生长。但就同一种土壤而言,紫茎泽兰根际和非根际细菌的优势门类均为放线菌、变形菌和拟杆菌,合计占总量的60.69%—78.75%;在前20种优势细菌中,根际和非根际之间有8—11株相同,也表现出较高的相似性。说明土壤可能是决定根际微生物种群的重要因素,但因紫茎泽兰根系生命活动而发生不同程度地变化。此外,放线菌门、变形菌门和拟杆菌门中,很多微生物参与土壤有机质矿化,具有分解纤维素、半纤维素、蛋白质和木质素等功能[43],加之当地气候属于温暖湿润的亚热带气候,这可能是供试红壤、黄壤和紫色土有机质含量较低的重要原因之一。
总之,在紫茎泽兰根际,土壤酶活性及微生物量碳氮含量显著高于非根际;紫茎泽兰能在细菌群落结构不同的土壤上生长,表现出极强的适应性,对根际细菌群落结构的影响因土壤类型不同而异;土壤是决定细菌群落的主要因素,但紫茎泽兰侵入会导致其发生一定程度的变化。
