首发未治疗精神分裂症血清脑源性神经营养因子水平研究☆
2019-01-18周亚楠翟金国陈敏
周亚楠 翟金国 陈敏
在首次有效干预以前,精神分裂症患者的精神病症状已持续一段时间,这段时间称为精神病未治期(duration of untreated psychosis,DUP)[1]。 多项研究表明缩短DUP可明显改善精神分裂症患者的预后[2]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养家族中含量最丰富的神经营养因子,在神经元和神经递质的多个方面发挥作用,进而影响学习和记忆功能[3]。研究表明精神分裂症患者的外周血清BDNF水平低于正常[4],而DUP与首发精神分裂症患者血清BDNF水平之间是否存在关联,相关研究甚少,且为数不多的研究结果也不尽一致[4-6]。故本研究拟探索首发未治疗精神分裂症患者血清BDNF水平变化,及DUP对其血清BDNF水平的影响。
1 对象与方法
1.1 研究对象精神分裂症组来自2016年2月至12月济宁医学院第二附属医院住院的首发精神分裂症患者。纳入标准:①符合《国际疾病与相关健康问题统计分类》(International Statistical Classification of Diseases and Related Health Problems,ICD-10)精神分裂症的诊断标准,由2位主治医师及以上职称精神科医生诊断;②首次发病,未经治疗,并且病程≤2年[7];③年龄16~50岁;④小学及以上文化程度。排除标准:①伴有其他精神障碍;②伴有脑器质性疾病或其他严重躯体疾病;③既往有精神科药物使用史;④近1个月内服用影响认知功能的药物;⑤有电休克治疗史;⑥有药物或酒精滥用史;⑦妊娠或哺乳期妇女。共纳入患者93例。
对照组来自周边社区健康志愿者。纳入标准:①年龄16~50岁;②小学及以上文化程度;③无现患精神疾病及精神疾病史;④无精神疾病家族史。排除标准:①患有脑器质性疾病或其他严重躯体疾病;②近1个月内服用影响认知功能的药物;③有药物或酒精滥用史;④妊娠或哺乳期妇女。共纳入93名对照。
本研究获得济宁医学院第二附属医院医学伦理委员会的审核批准。所有受试者均签署知情同意书。
1.2 研究方法首先针对研究方案、样本收集方法、相关量表使用方法及血清BDNF水平测定方法等对研究者进行培训,达到一致性标准后实施研究。
1.2.1资料收集 以入院时间为节点,向精神分裂症患者的知情人采集病史,记录患者自发病至入院时累计未治疗的时间。以精神分裂症组93例患者的DUP中位数为界值,将其分为长DUP组和短DUP组。同时,患者在入院当天由精神科主治医师采用阳性和阴性症状量表(positive and negative symptoms scale,PANSS)评定精神症状的严重程度。
1.2.2血清BDNF检测 所有受试者于清晨5:30-6:30从肘静脉抽取空腹静脉血5mL置于促凝管中,常温下静置1h后置于4℃下冷藏4h,离心(赛默飞世尔科技公司生产的离心机75007211)10min(590g/min)后分离血清,-80℃保存待用。采用酶联免疫吸附法测定血清BDNF浓度,使用的 BDNF ELISA试剂盒 (Chemicon International Inc.提供)检测敏感度为7.8pg/mL,批号为CYT306,测定过程严格按说明书操作。在酶联免疫检测仪(Bio-Rad美国伯乐imark酶标仪)上检测血清BDNF浓度。建立BDNF校正曲线并进行浓度分析。
1.3 统计学方法采用SPSS19.0进行统计分析。精神分裂症组和对照组之间,以及长DUP组和短DUP组患者之间年龄、受教育年限、PANSS评分及血清BDNF浓度的比较采用两独立样本t检验,婚姻状况、性别、家族史比较采用χ2检验;精神分裂症组DUP与PANSS评分、血清BDNF之间的相关关系采用Pearson积差相关分别分析。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料精神分裂症组和对照组在性别(χ2=2.682,P=0.102)、年龄(t=1.853,P=0.066)、受教育年限(t=0.434,P=0.666)及婚姻状况(χ2=2.171,P=0.141)方面差异均无统计学意义。见表1。
93例患者DUP为1~24个月,中位数10个月。按照DUP的中位数将其分为短DUP组49例(DUP为1~10个月) 和长DUP组44例 (DUP为11~24个月)。长DUP组和短DUP组患者在性别(χ2=2.377,P=0.123)、年龄(t=-1.538,P=0.128)、受教育年限 (t=-0.997,P=0.332)、 婚姻状况 (χ2=1.142,P=0.565)及精神疾病家族史(χ2=2.982,P=0.084)方面差异均无统计学意义。长DUP组患者PANSS得分中阴性症状分高于短DUP组,差异具有统计学意义(t=3.767,P=0.010);两组间 PANSS总分(t=-1.886,P=0.064)、阳性症状分(t=-0.060,P=0.696)、一般精神病理分(t=1.302,P=0.621)、攻击危险分(t=0.216,P=0.758)差异无统计学意义。见表2与表3。
2.2 精神分裂症组与对照组血清BDNF浓度精神分裂症组血清BDNF浓度低于对照组,且两组间差异有统计学意义(t=2.191,P=0.033)。见表1。
2.3 长DUP组和短DUP组血清BDNF浓度长DUP组患者的血清BDNF水平低于短DUP组,但差异无统计学意义(t=0.733,P=0.466)。见表3。
2.4患者血清BDNF相关因素精神分裂症患者血清BDNF水平与DUP相关性无统计学意义(r=-0.070,P=0.570), 与 性 别 (r=-0.202,P=0.098)、年龄(r=0.065,P=0.600)、受教育年限(r=0.010,P=0.938)、婚姻(r=0.130,P=0.292)、家族史(r=-0.139,P=0.259)、PANSS 总 分 (r=0.110,P=0.372)、阳性症状分(r=0.078,P=0.525)、阴性症状分(r=0.215,P=0.079)、一般精神病理分(r=-0.049,P=0.692)和攻击危险分(r=0.185,P=0.132)等均无统计学相关性。
3 讨论
与既往大多数同类研究结果[4,8-9]相一致,本研究也发现首发未治疗精神分裂症患者血清BDNF水平显著低于健康人群,但也有少数研究[10]表明精神分裂症与血清BDNF水平没有关联。这可能与研究对象(首发未治疗患者/慢性患者/经药物治疗患者)、检测样本(血清/血浆)、未治期、发病年龄、病程甚至种族的差异有关。

表1 精神分裂症组和对照组社会人口学资料及血清BDNF水平
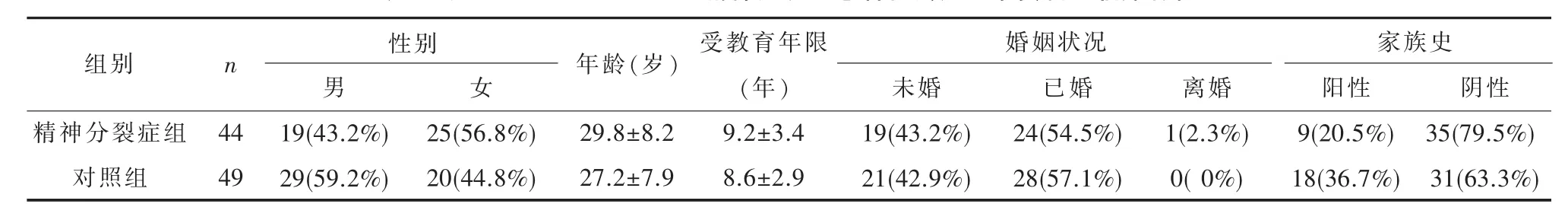
表2 长DUP组和短DUP组精神分裂症患者社会人口学资料和临床特征

表3 长DUP组和短DUP组精神分裂症患者PANSS评分和血清BDNF水平
BDNF与脑中神经元生长和突触可塑性有关,其浓度可以在外周血中检测。既往有动物研究表明血清和脑中BDNF有着相似的成熟和衰老过程[11],而且精神分裂症患者血清和脑脊液中BDNF水平呈正相关[12],这表明外周血中的BDNF水平可以反映其在大脑中的水平。所以首发未治疗精神分裂症患者血清BDNF水平下降可能提示其大脑神经发生病理性改变,进一步支持了精神分裂症发病机制中神经发育障碍这一假说。
关于DUP与首发未治疗精神分裂症患者血清BDNF之间关系的研究尚少,且既往研究也存在一定争议。已有一些研究显示,首发未治疗精神分裂症患者的DUP越长,其血清BDNF浓度越低[5-6]。但SIMSEK等[4]的研究并没有发现DUP与首发精神分裂症患者血清BDNF浓度水平有相关性。与SIMSEK等[4]研究结果相一致,本研究也没有发现其相关性。这种差异可能与本研究的局限性有关,如BDNF测量局限在单一时间点进行横断面观察,可能造成血清BDNF浓度存在差异,以及研究样本量较小,仅纳入DUP≤2年的患者,不能充分代表首发患者等。
与既往研究结果[13-14]相同,本研究也发现血清BDNF水平与PANSS各因子分均无相关性,提示血清BDNF水平可能不能用来评估精神分裂症疾病严重程度。
综上所述,虽然本研究并没有发现DUP对首发未治疗的精神分裂症患者血清BDNF水平的影响及血清BDNF水平与临床症状之间的相关性,但发现首发未治疗精神分裂症患者血清BDNF水平较对照组低。所以,BDNF可能参与了精神分裂症的发生、发展。但如上所述,本研究尚存在一定的缺陷。另外,有系统综述表明压力可能降低BDNF的表达[15],而精神分裂症患者由于患有精神疾病而承受一定的压力,所以精神分裂症组和对照组承受的压力可能不同,然而,本研究并没有对各组压力及其他潜在的混杂因素进行评估,未来研究可以对与压力相关的激素 (如下丘脑—垂体—肾上腺轴)进行检测。而不同治疗阶段精神分裂症患者血清BDNF水平及其影响因素也将是今后进一步研究的方向。
