基于Notch1信号通路探讨白藜芦醇对人结肠上皮细胞炎症损伤的保护作用
2019-01-18胡承莲
赵 丽,华 夏,谭 晔,胡承莲,熊 刚
(恩施土家族苗族自治州中心医院 急诊科,湖北 恩施 445000)
“肠粘膜屏障”遭到破坏会引起肠道上皮粘膜的持续性受损,进一步引发溃疡性结肠炎[1]。然而研究报道结肠上皮细胞分化异常是导致肠粘膜屏障破损的主要致病机制[2-3]。早期发现Notch1信号传导能介导结肠上皮细胞的分化过程[4-5],提示Notch1信号传导激活会诱发靶基因Hes-1活化而介导信号向下游传导,诱导肠道祖/干细胞增殖,调控结肠上皮细胞的分化,从而修复肠粘膜屏障损伤及促使结肠上皮再生,是治疗溃疡性结肠炎的重要环节[6]。白藜芦醇(Resveratrol,Res)主要分布于葡萄、虎杖、花生、桑葚等多种植物,在抗肿瘤、降血脂及抗炎等方面表现出较强的生物活性[7]。近期报道Res能抑制结肠癌细胞的迁移及侵袭,降低了结肠癌细胞的增殖,起着抗肿瘤的作用[8];还发现Res能通过抑制Notch1信号传导降低肝缺血/再灌注损伤大鼠的炎性反应及氧化损伤,从而起着保护作用[9]。但是Res是否通过调节Notch1信号传导来影响结肠上皮细胞分化尚不清楚,于是本文采用人结肠上皮(NCM460)细胞为模型,探讨了Res对LPS诱导细胞炎性损伤的保护作用及其对Notch1信号通路的影响。
1 材料与方法
1.1 仪器与材料 SPX-250型细胞培养箱及DNM-9602G酶标仪(美国Thermo公司);CX31-P型倒置显微镜(中国奥林巴斯公司);BBS-V800型单人超净台(香港Heal Force公司); NCM460细胞株(中国Auragene公司);胎牛血清、1640培养基(美国Hyclone公司);双抗(美国MP公司);白藜芦醇(湖北盛天恒创生物有限公司,经HPLC测定含量高于98%);Notch1激动剂(NSC 22423,美国Sigma公司);脂多糖(LPS,Sigma公司);IL-6、IL-1β 及TNF-α ELISA试剂盒(武汉华美生物有限公司);SDS-PAGE凝胶配制试剂盒(武汉谷歌生物有限公司);兔抗鼠β-actin、iNOS、COX-2、Notch1、Hes-1及Math-1一抗均购自美国CST公司;HRP标记山羊抗兔IgG二抗购自武汉谷歌生物有限公司。
1.2 细胞培养及分组 采用1640培养基培养NCM460细胞,条件为37 ℃、5% CO2恒湿培养箱,待细胞长满至95%左右时用PBS清洗后加入胰酶消化,显微镜下观察待细胞变圆后加入培养基终止消化,分装于3个培养瓶进行传代培养。待细胞生长状态较佳,用对数生长期细胞进行后续实验。实验分为空白对照组、LPS诱导组、LPS+低剂量Res组、LPS+高剂量Res组、LPS+高剂量Res+NSC组。采用LPS(1 mg/L)干预细胞构建炎性损伤模型,低、高剂量Res(40、120 μmol/L)及Notch1激动剂NSC 22423(2 μmol/L)处理细胞24 h后,收集细胞及培养液进行相关指标检测。
1.3 CCK8实验 按照“1.2”分组将适量密度细胞接种于96孔板,培养过夜后进行相关药物干预,24 h后弃去旧培养液,每孔加入10 μL CCK8试剂,继续培养2 h后,在酶标仪中于450 nm波长处测定吸光度A值,每组实验设置3个复孔。细胞相对存活率(%)=A实验组/A对照组×100%。
1.4 ELISA实验 按照“1.2”分组将适量密度细胞接种于6孔板,培养24 h后进行相关药物干预,24 h后收集培养液及细胞,每组设置3个复孔。细胞培养液用于ELISA检测,细胞用于Western Blot检测。细胞培养液中炎性因子IL-6、IL-1β及TNF-α水平检测步骤按照ELISA试剂盒说明书进行操作。具体操作如下:将细胞培养液离心,取标准品及标本上清100 μL加入酶标板中,37 ℃孵育2 h;弃去上清液,加入100 μL生物素化抗体工作液,37 ℃孵育1 h;洗涤3次,加入100 μL酶结合物工作液,37 ℃孵育1 h;洗涤5次,加入90 μL底物溶液,37 ℃孵育10 min;加入50 μL终止液;5 min内在450 nm波长处测量OD值。
1.5 Western blot实验 将“1.4”项收集的细胞用RIPA裂解液冰上充分裂解制备匀浆,超声破碎、12 000 rpm离心12 min后收集上清,BCA试剂盒测定上清蛋白浓度。每个样本上样50 μg进行凝胶电泳,待蛋白完全分离后进行转膜实验。结束后加入5%脱脂奶粉封闭液于摇床上室温封闭1h后,分别加入iNOS、COX-2、Notch1、Hes-1及Math-1抗体(体积稀释比例均为1∶1 000)4 ℃反应过夜。次日TBST洗膜3次后加入HRP标记的山羊抗兔IgG(体积稀释比例为1∶3 000),室温反应1 h。再用TBST洗膜3次,每次10 min,以ECL试剂显影后进行蛋白条带灰度值分析。每组设置1个复孔,重复实验3次,以β-actin作为内参,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
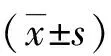
2 结果
2.1 Res对NCM460细胞增殖的影响 CCK8实验结果提示LPS干预能明显抑制NCM460细胞增殖,而不同剂量Res能促使NCM460细胞增殖,其相对存活率显著高于LPS诱导组(P<0.05);然而加入Res和NSC共同孵育NCM460细胞,发现细胞相对存活率与LPS诱导组相比没有明显差异(P>0.05,见图1)。
2.2 Res对NCM460细胞培养液中炎性因子释放的影响 ELISA实验结果提示:LPS干预能明显促使NCM460细胞分泌炎性因子IL-6、IL-1β及TNF-α,细胞培养液中炎性因子水平显著高于空白对照组(P<0.05);NCM460细胞经过低、高剂量Res处理后培养液中IL-6、IL-1β及TNF-α水平相对LPS诱导组显著降低(P<0.05);而经Res和NSC共同干预后培养液中炎性因子水平与LPS诱导组相比没有显著差异(P>0.05,见表1)。

与空白对照组比较,*:P<0.05;与LPS诱导组比较,#:P<0.05;与LPS+高剂量Res组比较,+:P<0.05。图1 各组细胞相对存活率比较
表1各组炎性因子水平比较

组别IL-6(pg/mL)IL-1β(pg/mL)TNF-α(pg/mL)空白对照612.6±104.760.8±11.486.3±12.4LPS诱导1526.4±295.4∗156.4±28.6∗182.6±17.3∗LPS+低剂量Res1131.5±253.9#116.3±21.5#136.1±15.2#LPS+高剂量Res825.7±185.6#76.4±14.6#103.8±12.7#LPS+高剂量Res+NSC1452.8±305.7+160.8±31.4+195.6±20.7+
与空白对照组比较,*:P<0.05;与LPS诱导组比较,#:P<0.05;与LPS+高剂量Res组比较,+:P<0.05。
2.3 Res对NCM460细胞iNOS及COX-2蛋白表达的影响 Western blot实验结果显示:LPS干预能明显促使NCM460细胞表达炎性蛋白iNOS及COX-2,细胞中炎性蛋白iNOS及COX-2表达显著高于空白对照组(P<0.05);NCM460细胞经过低、高剂量Res处理后细胞中炎性蛋白iNOS及COX-2表达相对LPS诱导组显著降低(P<0.05);而经Res和NSC共同干预后细胞中炎性蛋白iNOS及COX-2表达与LPS诱导组相比没有显著差异(P>0.05,见图2)。

与空白对照组比较,*:P<0.05;与LPS诱导组比较,#:P<0.05;与LPS+高剂量Res组比较,+:P<0.05;A:Western blot检测iNOS、COX-2、β-actin蛋白的表达水平;B:各组iNOS/β-actin蛋白的表达比较;C:各组COX-2/β-actin蛋白的表达比较。图2 各组间iNOS及COX-2蛋白表达比较
2.4 Res对NCM460细胞Notch1、Hes-1及Math-1蛋白表达的影响 Western blot实验结果显示:LPS干预能明显促使NCM460细胞表达Notch1和Hes-1、抑制Math-1蛋白表达(P<0.05);NCM460细胞经过低、高剂量Res处理后细胞中Notch1和Hes-1表达相对LPS诱导组显著降低,而Math-1蛋白表达显著升高(P<0.05);而经Res和NSC共同干预后细胞中Notch1、Hes-1及Math-1蛋白表达与LPS诱导组相比没有显著差异(P>0.05,见图3)。

与空白对照组比较,*:P<0.05;与LPS诱导组比较,#:P<0.05;与LPS+高剂量Res组比较,+:P<0.05;A:Western blot检测Notch1、Hes-1、Math-1、β-actin蛋白的表达水平;B:各组Notch1/β-actin蛋白的表达比较;C:各组Hes-1/β-actin蛋白的表达比较;D:各组Math-1/β-actin蛋白的表达比较。图3 各组间Notch1、Hes-1及Math-1蛋白表达比较
3 讨论
溃疡性结肠炎属于常见的消化道疾病,主要表现为结肠粘膜持续性损伤,其可能的病理机制与肠上皮细胞分化异常有关。因此,本文采用NCM460细胞株为模型探讨了白藜芦醇对细胞炎性损伤及相关分化蛋白表达的影响。实验结果发现Res能促使NCM460细胞增殖,并降低细胞培养液中炎性因子IL-6、IL-1β及TNF-α的释放,并抑制细胞中炎症蛋白iNOS及COX-2表达。
早期报道肠道上皮细胞分化受多个信号传导影响,主要包括Notch、Wnt及BMP等[10],然而研究证实Notch1蛋白是结肠上皮层分化、再生的关键性解控因子,在调节上皮细胞增殖、分化、维持上皮层微环境稳定及维持上皮层抗菌信号通路的活性等方面具有重大作用[11]。研究发现Notch1基因表达水平能够关键性调控肠道上皮细胞中分泌型及吸收型细胞的命运[12]。Notch1作用的下游靶基因属于碱式螺旋-环-螺旋家族转录因子,而Hes-1及Math-1属于介导人类肠道上皮细胞分化方向的关键因子[13],Hes-1蛋白高表达可诱导肠上皮细胞分化为吸收型细胞,Math-1蛋白高表达可诱导肠上皮细胞分化为分泌型细胞。当Notch1信号传导活化时可诱导Hes-1蛋白表达升高、Math-1蛋白表达降低,从而诱导吸收型细胞增多、分泌型细胞减少,改变了肠上皮细胞功能[14]。分泌型细胞可分泌黏蛋白、上皮结膜蛋白、三叶因子多肽及抵抗素样因子β、Fc-γ结合蛋白等,这些因子在肠道上皮层起着防御作用,可抵制肠道内微生物的侵害[15]。研究发现在溃疡性结肠炎部位分泌型细胞数明显减少,而且上述因子表达水平也明显降低,破坏了上皮层正常的防御功能,从而引起微生物入侵导致炎性反应[16]。本研究实验结果提示,Res对Notch1信号通路有一定的调节作用,能够抑制Notch1的活化,进一步抑制Hes-1蛋白表达、诱导Math-1蛋白表达,从而促使细胞向分泌型分化,降低LPS诱导的炎症反应。并且采用Notch1激动剂与Res共同干预细胞后,发现Notch1激动剂能够逆转Res对Notch1蛋白表达的抑制作用,说明Res可能通过Notch1信号通路调节结肠上皮细胞的分化及炎症反应。激动剂诱导Notch1信号通路活化及相关蛋白表达,Res能够抑制Notch1信号通路活化及相关蛋白表达,可能是二者竞争性与Notch1结合,哪个结合能力更强,那么发挥的相关作用就越显著。本文发现Notch1激动剂能够逆转Res对Notch1蛋白表达的抑制作用,说明该激动剂与Notch1相互作用的强度更强。综上所述,Res可通过Notch1信号通路调节人结肠上皮细胞的增殖和分化,对溃疡性结肠炎具有保护作用。
