斑叶香妃草的组培快繁
2019-01-18时玲玲
兰 伟, 时玲玲
(阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037)
斑叶香妃草(Plectranthuscoleoides)又名银斑香妃草、白边延命草,为唇形科香茶菜属多年生草本植物。其枝条拱形下垂,丛生,茎秆四梭形,叶对生,叶片绿色,边缘银白色。性喜全日照及温暖湿润的栽培环境,生长室温15 ℃,夜温10 ℃以上[1]。香味柔和,株形优雅,可用作室内观赏、茶饮、美容、佐料,等,作为芳香植物亦可提取精油,广泛用于化妆品、沐浴露、食品、牙膏、高级香水和其他生活用品,加工后的残渣可以用作动物饲料添加剂,可以刺激禽畜的食欲,提高采食量和饲料转化率,还能抑菌防病,调节机体代谢,降低抗生素的用量,改善禽畜肉品质,缩短存栏时间等功效[2-3]。另外,斑叶香妃草的药用价值很高,具有强身、健胃、镇痛、抑菌、去疤痕、抗抑郁等功效[4-5],故民间称其为白边延命草。
随着人们对高品质生活的追求,斑叶香妃草的市场需求量较大,常规的繁殖方式不能满足市场的需求。植物组织培养常用于植物离体快速繁殖,使用此种方法每年可以数百万的倍数进行繁殖[6]。现今植物组织培养技术已经在多种芳香植物中运用[7-9],如洋苷菊、玫瑰、羽叶薰衣草等。植物组织培养中使用的培养基各种成分中,植物激素是必需的成分。它对外植体的分化起关键性作用,其中影响最为显著的是生长素和细胞分裂素。本试验主要探究6-苄基氨基嘌呤(6-BA)和萘乙酸(NAA)配比对斑叶香妃草试管苗增殖的影响,以及不同浓度的吲哚乙酸(IAA)和NAA对试管苗增殖的影响,以及不同浓度IAA和NAA对试管不定根分化的影响,以期为斑叶香妃草的组培快繁提供理论及技术支持。
1 材料与方法
1.1 材料
试验材料为生长健壮、无病虫害的斑叶香妃草植株,来源于阜阳师范学院生命与食品工程学院植物组织培养中心。6-BA、NAA、IAA等均购于国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 无菌材料的获取 选取带顶芽的斑叶香妃草嫩茎,每株茎段约有两片嫩叶,外植体大小为0.5~1.0 cm,流水冲洗2 min后,先用70%乙醇浸泡20 s,再用 0.1% HgCl2浸泡8~10 min,无菌水冲洗5~6 次,置于无菌纱布中吸干水分,将消毒好的外植体接种于MS+30 g/L蔗糖+7.0 g/L琼脂的培养基上,每培养瓶接种外植体3个,接种95瓶。待接种完毕后,将外植体放入组培室进行培养,光照强度为2 000~3 000 Lx,培养温度(23±2) ℃,光照时间12 h/d。
1.2.2 试管苗增殖培养 选用培养30 d,长势良好、规格基本一致的试管苗两个节茎段,接种于附加不同浓度6-BA和NAA配比的9组MS培养基中(表1),以MS+30 g/L蔗糖+7.0 g/L琼脂基本培养基为对照组,每瓶接种3株外植体,每处理10瓶。各培养基pH均为5.8,光照强度为2 000~3 000 Lx (12 h/d),温度为(23±2) ℃的条件下培养。30 d后,每处理随机选取6瓶,每瓶3株,观察植株增殖情况。观测指标主要是植株的成活率,叶片数目,芽增殖倍数等状况。其中,增殖倍数=出芽数(>0.5 cm)÷接种时的总芽数。
1.2.3 试管苗生根培养 MS培养基中分别附加不同浓度的生长素NAA或IAA,进行试管苗生根诱导(表2~3)。切取长势良好、规格一致的试管苗两个节茎段,接种到生根培养基上,每瓶3株无根苗,每处理组8瓶,每组3个重复,并于7 d后,随机选取6瓶观测并记录,15 d后观测并记录植株存活状况及生根状况。
1.2.4 数据处理 使用Excel 2007软件对数据进行处理,SPSS 19.0软件进行方差分析,采用LSD法进行多重比较置信区间为95%。
2 结果与分析
2.1 不同浓度配比的6-BA、NAA对植株外植体增殖的影响
基本培养基中分别附加不同浓度配比的6-BA、NAA时,对植株的生长有较大影响(表1)。一般情况下,培养基中附加一定浓度配比的植物生长激素有利于植株的生长,但激素浓度过高则可能抑制植株生长。试验结果表明,NAA浓度分别为0.025、0.05、0.1 mg/L时,随着6-BA浓度增高,斑叶香妃草植株增殖倍数呈现先增长后下降的趋势,可见6-BA浓度为0.1 mg/L时,抑制了斑叶香妃草试管苗增殖。在6-BA、NAA交互作用下,诱导斑叶香妃草腋芽分化的最适宜培养基为MS+6-BA 0.3 mg/L+NAA 0.1 mg/L,增殖倍数较其他试验组明显增多,为73个,平均增殖倍数最高,为4.06倍,植株叶片较多且嫩绿,茎段较粗壮,生长趋势最好(图1B)。培养基中附加6-BA 0.3 mg/L+NAA 0.025 mg/L,斑叶香妃草出芽数最少,为32个,平均增殖倍数最小,为1.78倍,植株长势相对健壮。空白对照组出芽数为49个,平均增殖倍数为2.72倍,但植株生长较为缓慢(图1F)。6-BA、NAA对外值体的增殖是极显著影响及显著影响,并且对外植体的增殖存在极显著影响(P<0.01)。试验结果表明(图1A、B),一定浓度范围内,低浓度6-BA与较高浓度NAA成正比,植株叶片肥厚、叶色浓绿、大小正常,茎杆粗壮,长势健壮。

表1 不同浓度配比的6-BA、NAA对试管苗增殖的影响
注:同列内相同字母表示在0.05水平上差异不显著。下同。

A.6-BA 0.3 mg/L+NAA 0.05 mg/L B.6-BA 0.3 mg/L+NAA 0.1 mg/L C.6-BA 0.5 mg/L+NAA 0.05 mg/L
D.6-BA 1.0 mg/L+NAA 0.025 mg/L E.6-BA 1.0 mg/L+NAA 0.1 mg/L F.不加任何生长素
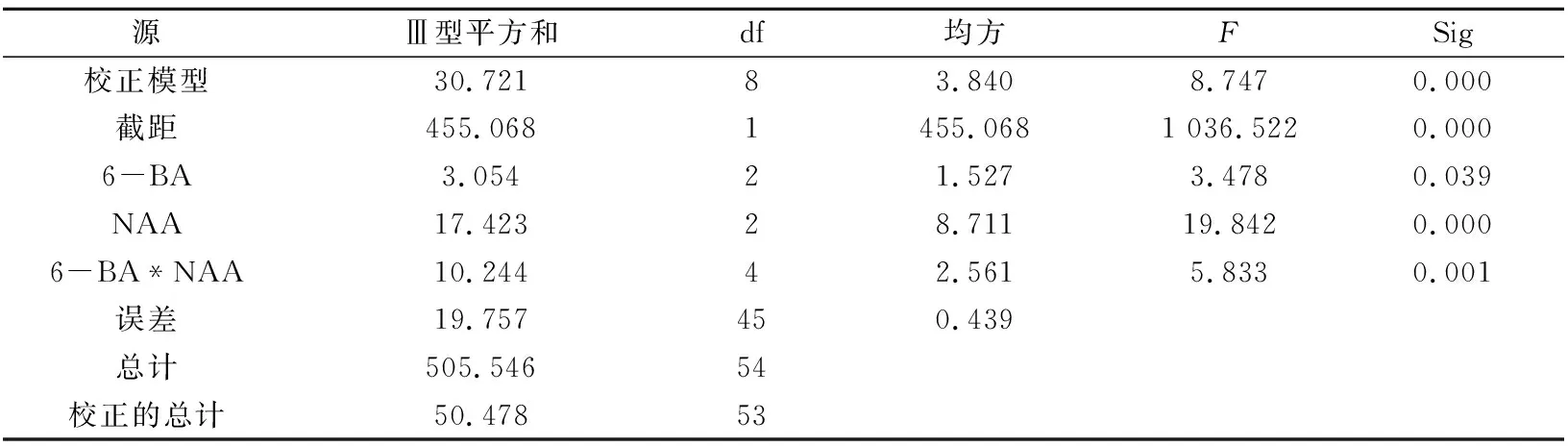
图1 不同浓度配比下试管苗生长情况
2.2 不同浓度NAA对外植体生根的影响
培养7 d后,植株长出少许不定根,长势良好,15 d后,形成的白色根系较为发达。由表3可知,加入一定浓度的NAA能够促进斑叶香妃草生根,植株和根系生长状况良好,生根率为100%。NAA浓度处于0.03~0.09 mg/L时,植株的平均根数和平均根长总体呈增加趋势,当NAA浓度高于0.09 mg/L时,植株的平均根数和平均根长呈下降趋势,由试验结果可知,当NAA浓度为0.09 mg/L时,平均根数和平均根长较其他组生长优势更为明显,平均根数为8.75 个,平均根长为2.54 cm,最有利于斑叶香妃草的不定根分化。单因素方差分析结果显示(表4),根数的组间方差为16.066,组内方差为0.127,根长的组间方差为0.803,组内方差为0.039,根长和根数对应的概率P值小于0.05,所以认为NAA浓度对试管苗生根有极显著差异。
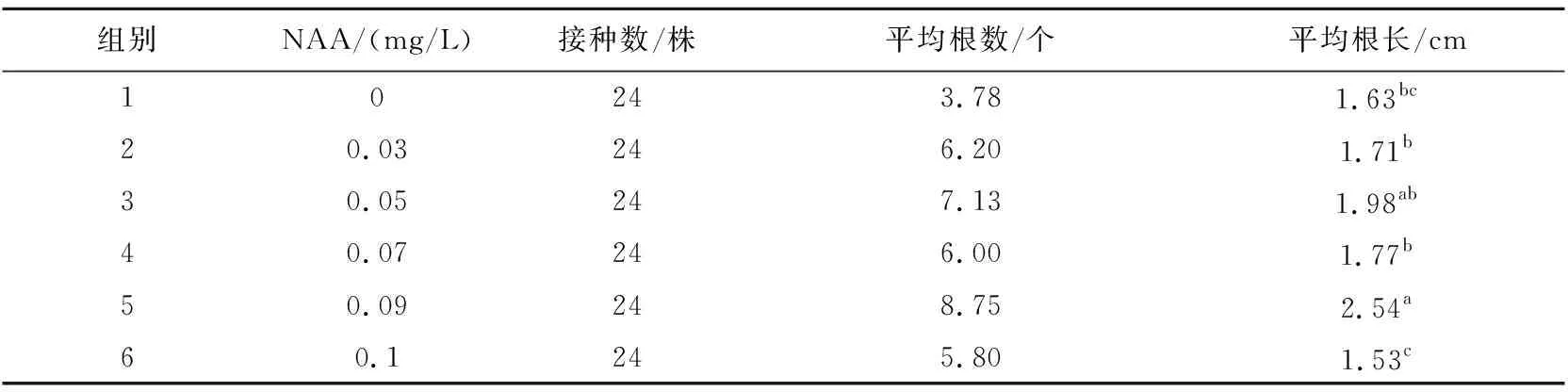
表3 不同浓度NAA对试管苗生长的影响
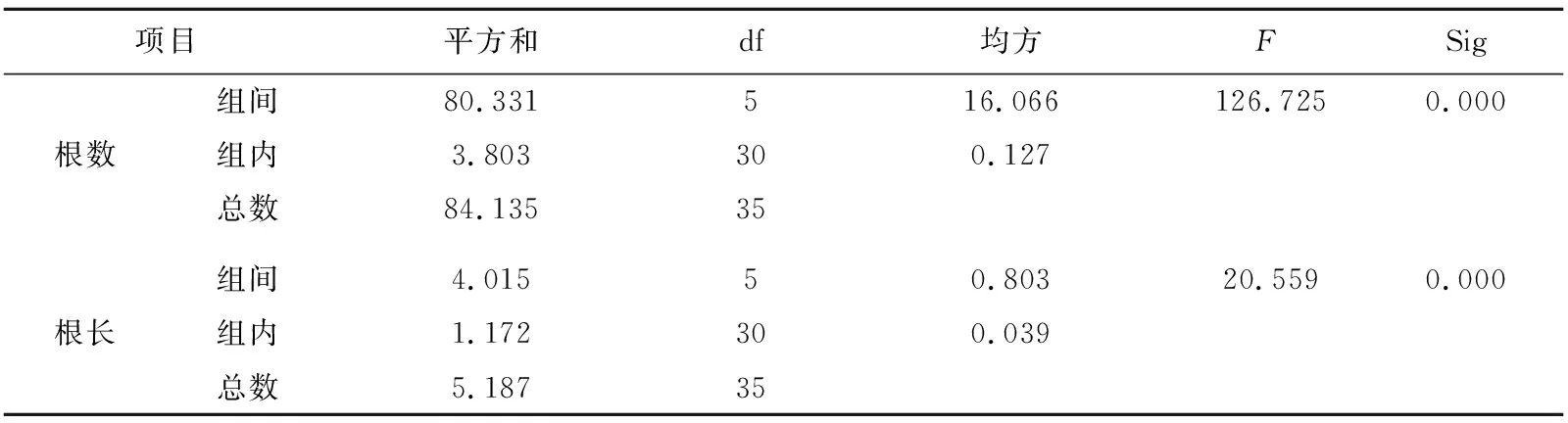
表4 不同浓度NAA对试管苗生根的方差分析
2.3 不同浓度IAA对外植体生根的影响
由表5可知,MS基本培养基添加不同浓度的IAA,7 d统计1次,15 d后各组试管苗的生根率达到100%,不同浓度的IAA对植株的平均根数和平均根长的影响趋于平缓,对外植体不定根分化影响最为显著的生长素浓度为0.03 mg/L,平均根数为5.96 个,平均根长为1.59 cm。各组差异均不显著(P>0.05)。IAA浓度对试管苗生根没有影响。
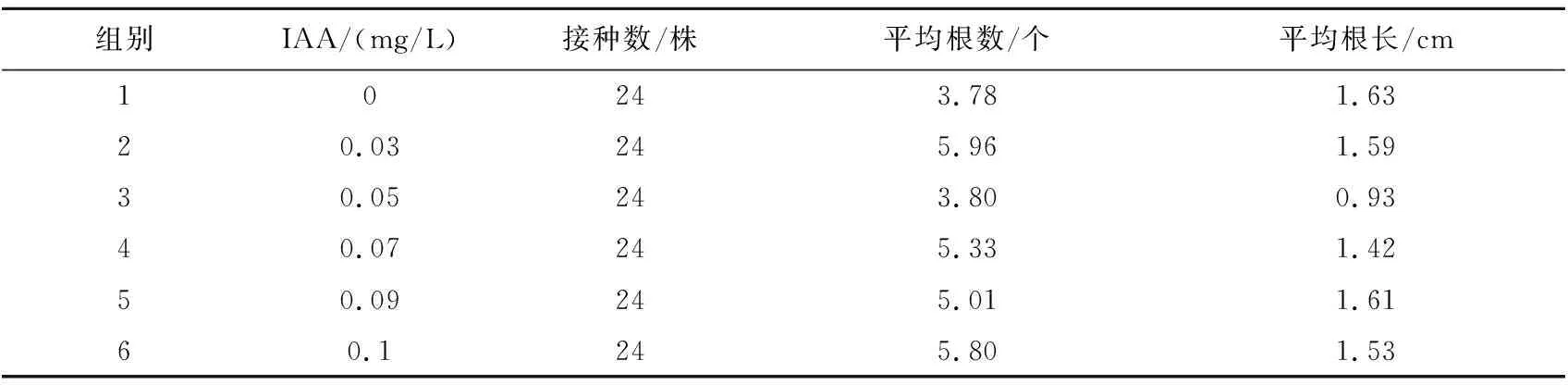
表5 不同浓度IAA对试管苗生长的影响
相同浓度条件下,NAA对斑叶香妃草的生根影响比IAA更佳,且长势更好。NAA浓度为0.09 mg/L时,更适宜外植体不定根的分化。由方差分析结果可知,NAA对斑叶香妃草的生根作用比IAA更为显著(表6)。
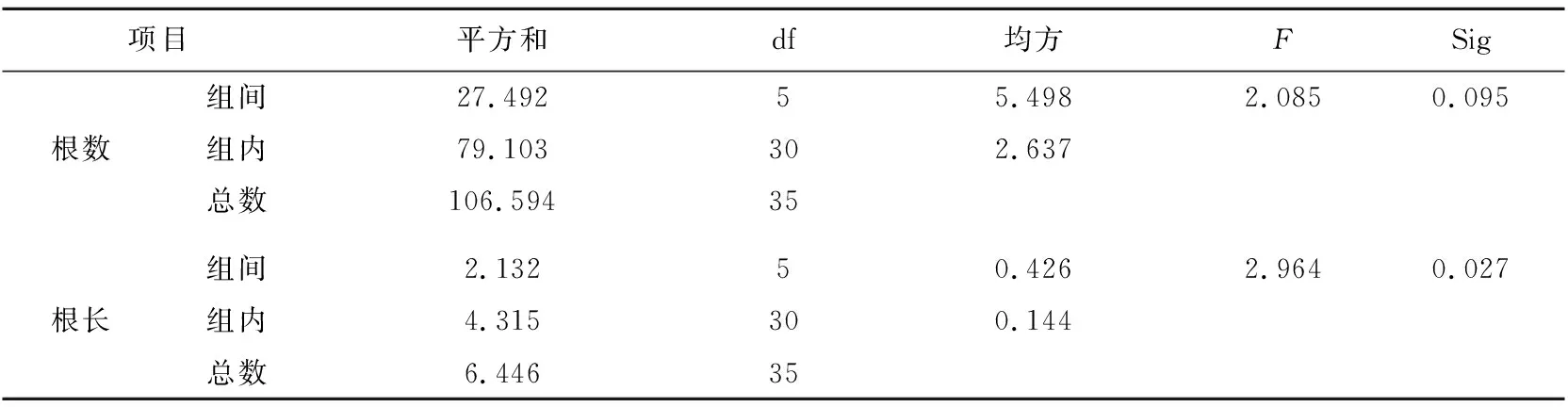
表6 不同浓度IAA对试管苗生根的方差分析
3 结论与讨论
目前,植物组织培养已成为一种植物学研究的常用方法,特别是在植物的个体发育,器官再生等方面。在运用此种技术时,一般植物都适用的培养基为MS培养基[10]。植物生长调节剂是通过调整植物内源激素的比例进而使植株发生形态上的差异,在培养基中加入适宜激素,能显著提高植物生长效果[11-12],不同植株对相同浓度激素的敏感程度不同,因此最适于植株生长的激素浓度配比不同,如最适宜黄金香柳试管苗快速增殖的培养基是MS+0.1 mg/L 6-BA +0.05 mg/L NAA[13],最适宜斑叶百里香种子的培养基是MS+0.25 mg/L 6-BA+0.25 mg/L NAA[14]。
本文探究斑叶香妃草生长调节剂组合和不同浓度配比对诱导试管苗腋芽及不定根分化的影响及组培苗生长发育情况。试验结果表明,6-BA/NAA的浓度配比为3∶1时,斑叶香妃草出芽率最高,生长状况最佳,每组出芽数为73个,增殖倍数为4.06倍,方差分析结果也表现为影响极为显著。在一定条件下,NAA对斑叶香妃草试管苗的不定根生长作用比IAA更为显著,培养基中NAA 0.09 mg/L时,斑叶香妃草生长效果最好,平均根长为2.54 cm,平均生根数为8.75 个。综上所述,MS+0.3 mg/L 6-BA+0.1 mg/L NAA对试管苗增殖倍数的影响最为显著,MS+NAA 0.09 mg/L促进试管苗生根的效果最佳。
