红王子锦带花药愈伤组织诱导启动因子分析
2019-01-17赵学丽王颖李晶黄金龙
赵学丽,王颖,李晶,黄金龙
(1.黑龙江省林业科学研究所,黑龙江 哈尔滨 150040;2.黑龙江省林业监测规划院,黑龙江 哈尔滨 150080;3.黑龙江丰林国家级自然保护管理局,黑龙江 伊春 153000)
红王子锦带(Weigelafloridacv.‘Red-prince’)为忍冬科锦带花属落叶灌木,系锦带花变种,株高1.5~2.0 m,冠幅1.5 m,花冠胭脂红色,花期长,适应性和抗逆性强,园林中可孤植、丛植,对氯化氢气体抗性强[1],是一种极具潜力的抗污染园林绿化新品种。
红王子锦带是我国近年来从美国引进的新品种。有关红王子锦带离体培育的报道很少,仅限于红王子锦带无菌苗体系的建立、增殖培养和生根培养及培养条件等的研究。王进茂[2]报道光强度和GA3对芽增殖的影响;王丽娟等[3]对红王子锦带离体培养的外植体类型及采集时间进行了研究;李瑜明等[4]研究了红王子锦带的夏芽和冬芽培养的区别;袁秀平[5]对红王子锦带叶片愈伤组织进行了系统研究,分析了影响愈伤组织诱导的相关因子及影响再生的因素和内在机理进行了系统的研究,并建立高效的花粉植株培养技术体系。开展红王子锦带花药离体培养为其高效利用及开发奠定基础。
1 材料与方法
1.1 材料采集与处理
红王子锦带花药采自黑龙江省森林植物园生长健壮的母树。花蕾采集分别于6月、7月、8月、9月生长季节进行,每个月采集不同发育时期的花药,从现蕾到开花期间每隔2 d采集一次,采集后将花蕾放置4 ℃的冰箱内冷藏处理备用。在接种前,进行花粉发育时期鉴定。
1.2 消毒方法及接种
将低温预处理后的花蕾取出,先进行表面清洗,然后放在超净工作台进行灭菌处理后,无菌水冲洗并放在滤纸上吸干花蕾表面水分,接种到诱导启动培养基上。
1.3 培养条件
培养条件采用光照培养和暗培养相结合的方法。光照培养光源采用日光灯,培养室内白天温度为24~28 ℃,照明12~14 h,光照强度15~20 μmol·m-2·s-1;暗培养温度控制在24~26 ℃。
2 结果与分析
2.1 材料处理对花粉愈伤组织诱导的影响
花蕾预处理在花药离体培育中至关重要,预处理分为低温处理、高温处理及离心处理,本文采用低温处理。将不同时期采集的花蕾放入4 ℃的冰箱中冷藏预处理,预处理时间分为24、48、72、96 h,见表1。

表1 不同低温处理花粉愈伤组织诱导效果
冷藏处理是从形态上改变其极性分布,从生理生化上改变其细胞生理状态,以改变其分裂方式和发育途径。由表1可见,花蕾经过预处理和未经过预处理对于诱导花粉愈伤组织有很大的差异,未经过预处理和处理时间过长诱导率都较低,其中表现最好的是预处理24 h,诱导率最高,达到35.56%。冷藏处理时间过短或不处理未能改变生理状态,因此诱导率低,冷藏处理时间过长,花蕾开始出现萎蔫,花药自身活力下降,导致诱导率低下。
2.2 不同消毒试剂对花粉愈伤组织诱导的影响
红王子锦带花药离体培养中,外植体消毒仅对花蕾表面进行消毒,获得无菌材料是成功的保证。外植体取材选择在8月晴朗天气上午,对外植体进行表面清洁后,放入不同消毒试剂进行消毒处理,见表2。
结果表明,外植体的污染率随着消毒时间的延长而呈降低的趋势,但是其致死率却随消毒时间的延长而升高。单一使用乙醇消毒,材料致死率为0,但材料污染率较高;氯化汞消毒时间短于10 min时不能杀死病菌,消毒时间大于15 min时却会杀死整个材料,氯化汞是一种重金属化合物,浓度大及作用时间长,容易对材料产生毒害作用,但对花蕾表面消毒,对花药的杀伤率并不高;乙醇+氯化汞消毒时70%~75%乙醇10 s+氯化汞5 min组合污染率虽高于70%~75%乙醇10 s及氯化汞10 min,但对材料的杀伤率较低;采用漂白粉消毒,污染率较高,影响花药离体培养的进程。因此,消毒试剂选用70%~75%乙醇10 s+氯化汞5 min组合,即对接种的花蕾表面先用酒精消毒10 s,再用氯化汞消毒5 min,之后用无菌水清洗花蕾3-4次。
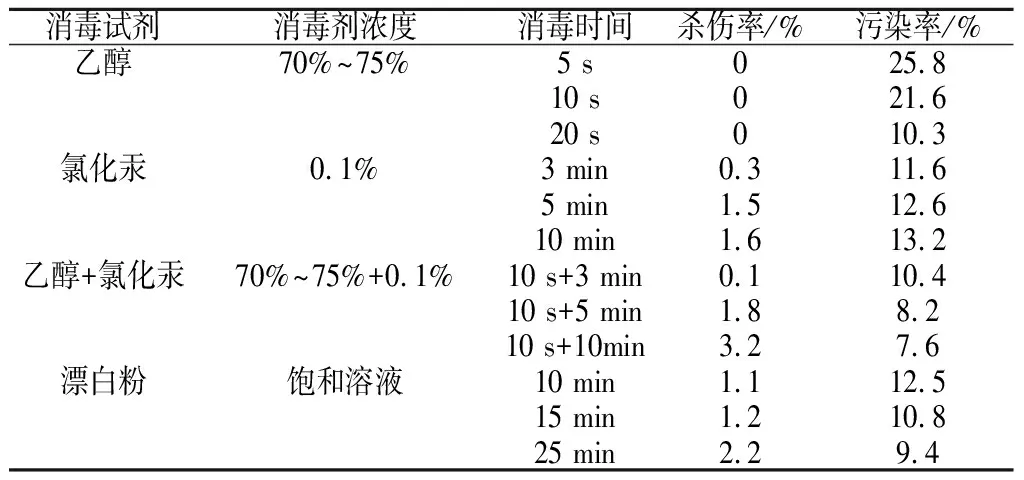
表2 不同消毒试剂花粉愈伤组织诱导效果
2.3 花药采集季节对花粉愈伤组织诱导的影响
红王子锦带花期从6—9月,不断形成花蕾,花蕾从6—9月连续开花不断。花蕾采集时间对花药愈伤组织的诱导影响较为显著,花蕾从6—9月连续开不断形成,但是花药的生命力有所不同,6月、7月和8月采集的花药生命力较强,诱导愈伤组织虽然有差异,但差异并不十分显著;9月采集的花药生命力较弱,未能诱导出愈伤组织。

图1 取材时间与启动关系
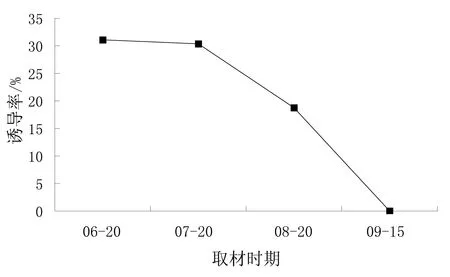
图2 取材时间与诱导率关系
由图1和图2可以看出,不同季节采集的花药对愈伤组织的诱导有显著的差别,6月采集的花药诱导率为31.11%,启动时间为14 d;7月采集的花药诱导率为30.36%,启动时间为16 d;8月采集的花药诱导率为18.75%,启动时间为18 d;9月采集的花药诱导率为0。因此,花药的采集应选在6~7进行。
2.4 花药发育时期对花粉愈伤组织诱导的影响
花药采集时期与诱导愈伤组织及形成植株有很大关系,尤其是花粉所处的发育时期,是花药培养成败的关键。诱导2周左右后观察发现,单核早期的花药开始启动,花药膨大,而四分孢子期、单核中期和单核后期的花药未见启动。接种1个月后调查,四分孢子期诱导率为8.70%;单核早期诱导率为48.00%;单核中期为20.00%;单核晚期为15.79%。
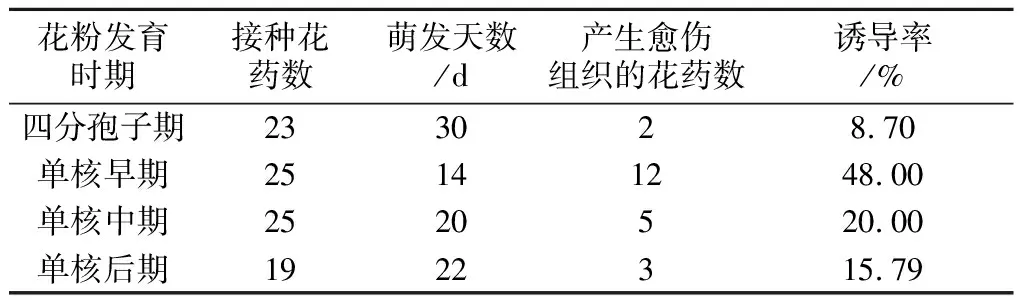
表3 花粉不同发育时期愈伤组织诱导效果
2.5 培养条件对花粉愈伤组织诱导的影响
光照通常会抑制愈伤组织的诱导,在本研究中采取暗培养和光培养交叉使用条件下诱导花药愈伤组织,培养结果表明:光照条件不同,愈伤组织诱导率之间存在着显著差异。

表4 不同培养条件愈伤组织诱导效果与多重比较
由表4可知,花粉在全暗、先暗后光照培养条件下愈伤组织诱导差异不显著,但与花粉在全光照、先光照培养后暗培养条件下愈伤组织诱导差异显著。全光照下诱导率为13.04%、愈伤组织深绿色、结构紧实、生长缓慢、分化能力差;全暗培养下诱导率为24%、愈伤组织灰白色;先全暗培养后光照培养诱导率为28%、愈伤组织为绿色、生长快、分化能力强;先光照培养后暗培养诱导率为14.28%。暗培养有利于气生根的诱导。
2.6 基本培养基对花粉愈伤组织诱导的影响
植物组织培养有许多种类,长期以来,根据所选材料及培养目标的不同,设计了许多不同种类的培养基。根据培养基的组分通常分为基本培养基和完全培养基,在红王子锦带花药愈伤组织诱导培养中首先要筛选适宜的基本培养基。
将红王子锦带花药接种于(表5)所列的培养基中,20 d后调查,比较基本培养基的诱导效果。
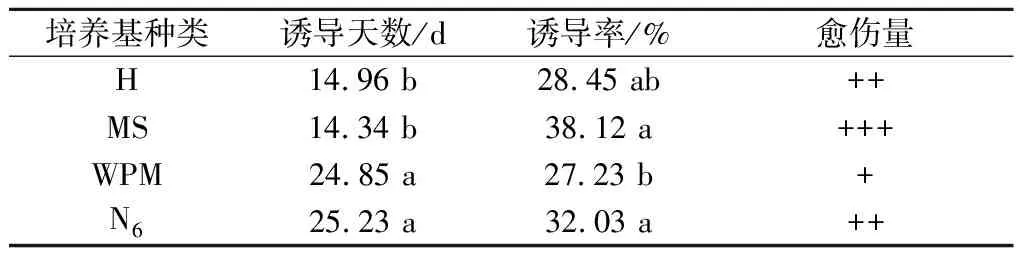
表5 不同培养基愈伤组织诱导效果与多重比较
试验结果表明:基本培养基对红王子锦带花药愈伤组织诱导率、启动时间及愈伤量存在显著差异。MS培养基的平均诱导率为38.12%,诱导时间较短,愈伤量较大,且生长快;H培养基诱导率及诱导时间次于MS培养基;N6培养基的平均诱导率及愈伤量仅次于MS培养基,但诱导时间过长;WPM培养基诱导效果最差。因此,红王子锦带花药愈伤组织诱导首选MS培养基。
2.7 激素种类及浓度对花粉愈伤组织诱导的影响
基础培养基采用MS,对诱导花药愈伤组织效果很好,同时附加不同浓度的2,4-D、BA、KT等促进花粉母细胞分裂的植物生长调节剂,加速愈伤组织的诱导。

表6 不同激素诱导花粉愈伤组织的效果
将花药接种到不同组合的培养基中,接种后放置于24~26 ℃的条件下进行暗培养。接种20 d后,有的花药膨大开裂,从中长出白色或乳白色愈伤组织,其中1号培养基诱导率最高,愈伤组织质地最好,这些愈伤组织多数质地疏松、柔软,呈半透明状。 接种30~40 d后,将其从原有的花药上取下转入相同的新鲜培养基中,将花药置于有光照条件下进行光照培养。培养4~5 d后观察发现,这些愈伤组织的颜色逐渐变绿。试验发现2,4-D浓度对愈伤组织的诱导影响较大,但高浓度的2,4-D并不利于愈伤组织的诱导。愈伤组织诱导2,4-D 0.2 mL·L-1,BA为1.0 mL·L-1较为适宜红王子锦带花药愈伤组织诱导。
3 结论
3.1 低温预处理24 h,诱导率最高,达到35.56%。
3.2 最佳消毒试剂选用70%~75%乙醇10 s+氯化汞5 min组合,即对接种的花蕾表面先用酒精消毒10 s,再用氯化汞消毒5 min,之后用无菌水清洗花蕾3~4次。
3.3 最佳花药的采集应选在6—7月进行。
3.4 单核早期花粉诱导效果较好,诱导率为48.00%。
3.5 红王子锦带花药愈伤组织诱导首选MS培养基。
3.6 愈伤组织诱导采用2,4-D 0.2 mL·L-1及BA为1.0 mL·L-1较为适宜红王子锦带花药愈伤组织。
