基于生物条形码结合杂交链式反应双重信号放大检测蓖麻毒素
2019-01-14霍冰洋白家磊媛宁保安高志贤
苑 帅 霍冰洋 张 曼 王 瑜 白家磊 彭 媛宁保安 陈 萍 高志贤*
1(吉林农业大学食品科学与工程学院, 长春 130118)2(军事科学院军事医学研究院环境医学与作业医学研究所,天津市环境与食品安全风险监控技术重点实验室, 天津 300050)
1 引 言
蓖麻毒素(Ricin toxin, RT)是从蓖麻种子中分离出来对真核细胞具有强烈毒性的蛋白, 是“化学武器公约”(CWC)附表1所列的唯一蛋白质毒素[1]。蓖麻毒素由两条多肽链RTA(约32 kDa)、RTB(约34 kDa)通过二硫键连接结合[2], 对人体具有很强的毒性, 通过呼吸、肌肉注射及皮肤接触摄入均可造成染毒者死亡, 成人蓖麻毒素吸入及肌注的半数致死量(LD50)约为22 μg/kg, 口服LD50约为1 mg/kg, 属于剧毒类毒素[3]。蓖麻毒素进入机体后, B链与细胞膜上的糖蛋白识别结合, 将A链送入细胞内。A链每分钟可失活近1500个核糖体, 强烈抑制蛋白质的合成, 最终导致细胞及机体受损死亡[4]。蓖麻毒素由于其毒性强, 易于制备, 自然状态下性质稳定的特点, 已有被用于威胁及暗杀的先例[5,6], 也极有可能被恐怖分子作为生物武器污染食品及水源, 威胁公共安全。因而, 无论从战争防护还是食品安全保障角度, 开发灵敏的蓖麻毒素检测技术十分必要。
目前, 蓖麻毒素的主要检测方法有免疫PCR技术[7]、酶联免疫吸附技术[8]、上转换发光免疫层析法[9]、质谱检测法[10,11]、表面增强拉曼检测法[12]、适配体检测法[13]、等离子体表面纳米孔比色传感器法[14]和表面等离子共振传感器法[15]等。大部分检测方法需要精密仪器, 检测灵敏度高, 但检测成本高; 近年开发的基于适配体的检测方法, 相对而言成本较低, 但灵敏度受温度、离子浓度等因素限制, 特异性及稳定性不高; 免疫分析方法成本优势虽不及适配体检测方法, 但成本低于大型仪器检测方法, 且具有灵敏度高、选择性好、稳定性高等优势。
2003年, Mkrkin等[16,17]首先报道了生物条形码(Bio-barcode assay)检测方法用于检测痕量蛋白或核酸, 在磁性微球上包被单抗制成磁探针(Magnetic microparticle, MMP), 纳米金上标记多抗和条形码DNA制成金探针(GNPs), 运用单多抗夹心靶标分子的原理, 纳米金上连接的数百条DNA作为信号放大的工具。该方法具有非常高的灵敏度, 甚至可检测到低至几百个目标物分子的浓度[18,19]。但传统的生物条形码检测方法使用的金标银染法虽有很高的灵敏度, 但仅能进行定性分析[18]; 而荧光定量PCR法虽然能进行定量分析[20], 但需要大型的精密设备, 步骤复杂, 难以达到便携、高效的要求。近年来, 核酸恒温扩增技术的优势逐步显现, 它是继PCR技术之后开发的新型扩增技术, 具有快速、高效、特异性好且不需要变温仪器设备支持等优势。其中, 杂交链式反应(Hybridization chain reaction, HCR)在分析检测方面得到了广泛应用[21~23]。该方法基于立足点(Toehold)的链置换的原理[24], 采用两种可形成发卡结构的单链DNA探针, 两种探针在头部形成环状区域, 中部碱基互补杂交形成茎部, 末端存在几个碱基长的单链作为打开发卡的识别区。其环状区域在解链后可与另外发夹的粘性末端杂交, 而正常状态下不会发生杂交情况。当存在引发单链DNA时, 发卡H1的粘性末端识别并与之杂交, H1暴露出茎部的单链从而与发卡H2进行杂交, 这样交互杂交形成带缺口的长DNA结构, 理论上反应一直可进行到发卡探针耗尽为止[25]。发卡探针上可标记荧光或生物素等, 可数十倍地放大信号。相比于其它扩增方法, HCR具有对反应条件要求低、成本低、可任意编码等优势[26]。
本研究结合生物条形码及杂交链式反应核酸信号放大优势, 开发了一种新型的灵敏检测蓖麻毒素的方法。原理如图1所示, 在黑色聚苯乙烯微孔板上包被抗蓖麻毒素单克隆抗体(mAb), 在蓖麻毒素目标物存在的条件下, 通过与吸附有多抗和连接条形码DNA的金纳米探针(GNPs)结合, 在微孔板底部形成mAb-Ricin-pAb/GNPs/Barcode DNA“三明治”夹心结构。随后加入生物素标记的发卡探针H1与H2, 修饰在金探针表面的条形码DNA作为引发链引发H1和H2循环杂交扩增, 形成带有许多生物素的长链DNA, 进一步加入辣根过氧化物酶标记链霉亲和素(HRP-SA),与长链上的生物素结合, 在化学发光底物鲁米诺与过氧化氢的存在下,利用化学发光进行检测, 目标物蓖麻毒素含量越高, 对应的化学发光值随之升高。本方法结合了生物条形码及杂交链式反应的双重优势, 经过了两次放大信号, 从而更大限度地提高了检测灵敏度。

图1 基于生物条形码结合杂交链式反应双重信号放大检测蓖麻毒素示意图Fig.1 Schematic illustration of dual signal amplification based on bio-barcode combined with hybridization chain reaction (HCR) for detection of ricin toxin (RT)GNPs, gold nanoparticles; HRP, horseradish peroxidase; SA, streptavidin; mAb, monoclonal antibody
2 实验部分
2.1 仪器与试剂
TGL-16C离心机(上海安亭科学仪器厂); HT7700 TEM 透射电子显微镜(日本日立公司); TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司); TGL-16M高速冷冻离心机(湘仪离心机仪器有限公司); DYY-11型电泳仪(北京六一仪器厂); IQ350凝胶成像系统(美国GE公司); OSE-96干式恒温金属浴(北京天根生化科技有限公司); 涡旋振荡器(德国IKA公司); 恒温培养箱(上海新苗医疗器械制造有限公司); MP-180化学发光免疫分析仪(北京泰格科信生物科技有限公司)。
蓖麻毒素标准品(1.3 mg/mL)及蓖麻毒素多克隆抗体(北京翰谱生物医药研究所); 蓖麻毒素单克隆抗体(5.3 mg/mL, 美国GeneTex公司); 牛血清白蛋白(BSA, 美国Sigma-Aldrich公司); PBST缓冲液(含0.05%(V/V)Tween-20)、辣根过氧化物酶标记链霉亲和素(HRP-SA, 1 mg/mL)、磷酸盐缓冲液(0.01 mol/L PBS), 均购自北京索莱宝生物科技有限公司; 黑色聚苯乙烯微孔板、ECL化学发光底物液(美国Thermo Fisher Scientific公司)。缓冲液:盐化缓冲液(1.37 mol/L NaCl, 0.01 mol/L PBS), 储备缓冲液(1% PEG20000, 1% BSA, 0.01 mol/L PBS), 碳酸盐缓冲液(0.05 mol/L, pH 9.6), 杂交缓冲液(20 mmol/L Tris-HCl, 0.4 mol/L NaCl, 5 mmol/L MgCl2, pH 7.5)。实验用水为超纯水(>18.0 MΩ cm)。所用核酸序列均由上海生工生物工程有限公司合成(经HPLC纯化), 核酸序列见表1。
表1 实验所用核酸序列
Table 1 DNA sequences used in this study
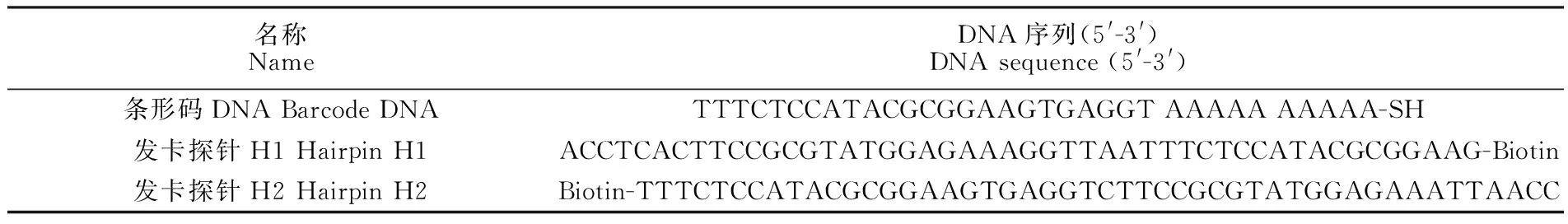
名称NameDNA序列(5'-3')DNA sequence (5'-3')条形码DNA Barcode DNATTTCTCCATACGCGGAAGTGAGGT AAAAA AAAAA-SH发卡探针H1 Hairpin H1ACCTCACTTCCGCGTATGGAGAAAGGTTAATTTCTCCATACGCGGAAG-Biotin发卡探针H2 Hairpin H2Biotin-TTTCTCCATACGCGGAAGTGAGGTCTTCCGCGTATGGAGAAATTAACC
核酸序列用杂交缓冲液溶解配制成10 μmol/L的储备液, 使用前于95℃加热5 min, 之后缓慢冷却至室温,备用。
2.2 实验方法
2.2.1金纳米探针的制备采用文献[27]的方法合成15 nm的胶体金, 4℃避光备用。加入0.1 mol/L Na2CO3调节胶体金pH值(8.5~9.0)。取1 mL胶体金, 加入45 μg/mL蓖麻毒素多抗(pAb)100 μL, 室温振荡混匀1 h; 将条形码DNA 4000 r/min离心30 s, 加入500 μL水溶解, 取100 μL条形码DNA加至胶体金混合液中, 混匀后置于4℃结合2 h; 加入10% PEG 20000使终浓度为1%, 再加入盐化缓冲液使其NaCl终浓度达到0.14 mol/L, 混匀后在4℃陈化2 h; 加入5% BSA使其终浓度达到1%(w/w), 4℃封闭1 h, 2000 r/min离心10 min, 弃沉淀, 13000 r/min离心20 min, 弃上清液, 加入1 mL储备缓冲液吹打复溶沉淀, 13000 r/min离心20 min, 最后加入800 μL储备缓冲液溶解金纳米探针, 于4℃保存, 备用。
2.2.2胶体金最佳多抗标记量的确定依照胶体金探针标记蛋白稳定化原理[28], 取胶体金溶液加入0.1 mol/L Na2CO3调整胶体金pH在8.5-9.0左右, 将使用0.01 mol/L PBS稀释成不同浓度(0, 10, 20, 30, 40, 50 μg/mL,用PBS做空白)的单抗溶液分别取100 μL加入至1 mL上述胶体金溶液中, 室温震荡混匀1 h, 然后分别加入200 μL 10%(w/V) NaCl, 静置2 h后, 测定524 nm处的吸收值
2.2.3琼脂糖凝胶电泳取浓度为10 μmol/L的发卡探针H1和H2各10 μL混合, 分别加入不同浓度的条形码引发链30 μL使其总浓度分别为0 μmol/L、0.125 μmol/L、0.25 μmol/L、0.5 μmol/L、1 μmol/L和2 μmol/L, 用杂交缓冲液作空白, 室温反应杂交1 h。HCR反应后,采用2%的琼脂糖凝胶电泳, 80 V下电泳1.5 h。
2.2.4检测方法的建立将蓖麻毒素单克隆抗体(1mg/mL)用CBS包被液按1∶2000稀释, 每孔加入100 μL, 4℃包被过夜或37℃温育2 h, PBST洗涤; 每孔加入120 μL 1% BSA, 37℃封闭1 h。每孔加入不同浓度的蓖麻毒素标准样品溶液100 μL, 阴性孔不加入蓖麻毒素仅加入PBS, 37℃结合1 h。重复洗涤, 每孔加入金纳米探针50 μL, 37℃孵育1 h。重复洗涤, 每孔加入发卡探针H1和H2各5 μL, 以及杂交缓冲液90 μL, 25℃下进行HCR杂交反应1 h。弃去反应液, 每孔加入PBS稀释的HRP-SA(0.5μg/mL)100 μL, 37℃反应25 min, PBST洗涤后, 将等体积的化学发光底物液混合, 每孔加入100 μL, 立即在化学发光免疫分析仪中测定相对光单位值(RLU)。
3 结果与讨论
3.1 胶体金最佳多抗标记量的确定

图2 不同浓度多抗标记胶体金的吸收光谱图a, 50 μg/mL; b, 40 μg/mL; c, 30 μg/mL; d, 20 μg/mL; e, 10 μg/mL; f, 0 μg/mL; 插图为524 nm处的吸光度值与浓度关系曲线Fig.2 Absorption spectra of labeling of GNPs with different concentrations of polyclonal antibody (pAb)a, 50μg/mL; b, 40 μg/mL; c, 30 μg/mL; d, 20 μg/mL; e, 10 μg/mL; f, 0 μg/mL. Inset shows absorbance at 524 nm versus concentration of pAb
制备的胶体金因带有负电荷, 在碱性环境下大于蛋白等电点时会通过静电吸附作用将多抗吸附到胶体金表面, 在NaCl存在下吸附在胶体金上的多抗阻止了胶体金颗粒的相互聚集。如图2所示, 当多抗添加量小于40 μg/mL, 加入NaCl静置后标记抗体的胶体金表面电荷受到破坏而相互聚集, 表现为520nm处附近吸收峰的降低; 当添加多抗的浓度大于40 μg/mL时, 吸光值变化趋于稳定, 这是因为多抗充分吸附在胶体金表面, 电荷不会受到破坏, 达到稳定状态, 因而在最低稳定量基础增加10%~20%为最佳添加量, 故选择添加多抗的浓度为45 μg/mL。
3.2 金纳米探针表征
TEM图如图3A所示, 采用柠檬酸钠还原法合成的胶体金经粒径约为15 nm, 且粒径均一; 图3B所示胶体金的紫外最大吸收峰在520 nm处, 峰宽较窄, 说明粒径均一化程度好, 吸附多抗和连接完条形码DNA后的金纳米探针最大吸收峰红移至526 nm处, 间接证明金纳米探针制备成功[29]。

图3 (A)胶体金的透射电镜图(标尺为50 nm); (B)胶体金(曲线a)与金纳米探针(曲线b)的吸收光谱Fig.3 (A) Transmission electron microscopic (TEM) image of bare GNPs; (B) Absorption spectra of unmodified GNPs (a) and pAb-GNPs-DNA complex (b)
3.3 琼脂糖凝胶电泳表征
如图4所示, 孔道3显示当不存在条形码DNA即引发链H0时, H1与H2能够稳定存在, 没有发生扩增条带, 在电泳图上仅显示一个条带。当存在条形码DNA作为引发链时, HCR发生扩增, 在不同浓度的引发链存在的条件下, 孔道4~8上均出现不同的弥散条带, 而且随着条形码DNA浓度增高, DNA扩增的平均分子量降低, 这说明在发卡H1和H2浓度固定的条件下, 引发链浓度越高, 其打开发卡H1和H2的速率越快, 底物消耗过快, 使得形成长链DNA的平均分子量降低。

图4 不同HCR扩增体系电泳图(泳道1:H1 4 μmol/L; 泳道2:H2 4 μmol/L; 泳道3~8:6种不同浓度的H0 (0 μmol/L, 0.125 μmol/L, 0.25 μmol/L, 0.5 μmol/L, 1 μmol/L, 2 μmol/L) 在H1与H2均加入2 μmol/L的条件下, M分别为50 bp Marker与D2000 Marker)Fig.4 Electrophoretograms of different HCR amplification systems (lane 1: 4 μmol/L H1; lane 2: 4 μmol/L H2; lane 3-8: six different concentrations of H0 (0 μmol/L, 0.125 μmol/L, 0.25 μmol/L, 0.5 μ mol/L, 1 μmol/L, 2 μmol/L) in 2 μmol/L mixture of H1 and H2. M are two kinds of marker: 50 bp Marker and D2000 Marker)
3.4 可行性考察
采用本方法检测两种浓度的蓖麻毒素标样, 如图5所示, 加入蓖麻毒素后, 体系的RLU值显著增大; 浓度越高, 对应的RLU值越大, 且阴性值(0 ng/mL)较低, 说明蓖麻毒素可同时被单抗与金探针识别, 并引发HCR扩增, 放大信号, 证明本方法可用于不同浓度蓖麻毒素的测定。

图5 利用本方法检测不同浓度的蓖麻毒素的RLU值: a, 2 μg/mL; b, 200 ng/mL; c, 0 ng/mLFig.5 RLU of different concentrations of RT detected by this method. a, 2 μg/mL; b, 200 ng/mL; c, 0 ng/mL
3.5 实验条件的优化
分别考察了HCR杂交时间、HRP-SA结合时间及HRP-SA使用浓度对响应信号的影响。由图6A可知, 在HCR反应前30 min内, RLU增加很快, 在30~45 min曲线逐渐趋于稳定, 45 min后RLU趋于稳定。表明在初始阶段扩增, 发卡探针浓度很高, 因而反应速率快; 随着发卡探针不断消耗, 45 min后RLU达到饱和,在体系中发生链置换的速度逐渐降低; 另外, 经过大量杂交后的长链的整体熵自由能升高, 发卡探针的自由能不足以使其解链杂交, 从而使反应逐渐停止。后续实验选取45 min为HCR杂交扩增的最优时间。图6B为HCR反应结束后加入HRP-SA孵育时间曲线, 在20 min后RLU趋于稳定, 因而选取20 min为添加HRP-SA最佳结合时间。图7的结果表明, 随着HRP-SA浓度逐渐降低, 其阳性值与阴性值的比值呈先升高后降低的趋势, 说明添加浓度过高会导致阴性微孔内仍残留HRP-SA, 使得阴性值升高; 浓度过低又会使长链上的生物素结合HRP-SA不完全, 使阳性值相对偏低。综上, 选择HRP-SA最佳浓度为0.5 μg/mL。

图6 (A)HCR杂交时间及(B)HRP-SA孵育结合时间的优化Fig.6 (A) Optimization of HCR hybridization time and (B) HRP-SA incubation binding time Concentration of RT is 50 μg/mL
3.6 方法分析性能
利用本方法检测不同浓度的蓖麻毒素标准品。如图8所示, 本方法线性范围为0.61 ng/mL~5000 ng/mL, 对应的两段工作曲线为y1=0.90x+ 0.73(0.61~78.13 ng/mL,R2=0.998);y2=0.61x-0.88 (78.13~5000 ng/mL,R2=0.994), 检出限为0.52 ng/mL(S/N=3)。另外, 使用双抗夹心化学发光免疫检测方法工作曲线如图9所示, 其中酶标二抗按1∶10000倍稀释加入, 其检出限为即本方法的灵敏度是其78倍。说明HCR扩增能有效提高检测灵敏度, 明显高于常规化学发光免疫方法。本方法与其它检测方法相比(表2), 具有检测范围宽、操作较简单、灵敏度较高等优势。
选择蓖麻毒素的结构类似物相思子毒素(Arbin)、BSA、金黄色葡萄球菌肠毒素A(SEA)及IgG作为对照物, 考察本方法的特异性, 结果如图10所示。4种类似物均未对结果产生明显影响, 这是由于本方法采用特异性单抗和多抗, 因而特异性和选择性良好。
表2 蓖麻毒素检测方法对比
Table 2 Comparison of methods for detection of RT

方法Method实验时间Experiment duration检出限LOD线性范围Linear range文献Reference酶联免疫吸附法 ELISA method10 h2 ng/mL1.2~10 ng/mL[8]表面增强拉曼检测方法 SERS detection method2 h8.9 ng/mL10~500 ng/mL[12]适配体检测方法 Aptamers detection method<3 h0.6 ng/mL0.75~100 ng/mL[13]等离子体表面纳米孔比色传感器法Plasmonic metasurfaces nanopin colorimetric sensor method10 min10 ng/mL10~120 ng/mL[14]表面等离子共振传感器法 SPR sensor method<1 h3 ng/mL-[15]生物条形码结合杂交链式反应的化学发光法Chemiluminescent bio-barcode assay combined with HCR<7 h0.5 ng/mL0.61 ng/mL~5 μg/mL本方法This method
3.7 实际样品分析及加标回收率测定

图7 不同浓度的HRP-SA对检测阳性(左)与阴性(右)样品响应信号值的影响, 插图为对应浓度的样品的响应与阴性样品响应的比值变化曲线Fig.7 Effect of different concentrations of HRP-SA on the positive (left) and negative (right) values, inset shows the ratio of the positive and negative values of the corresponding concentration a, 2 μg/mL; b, 1 μg/mL; c, 0.5 μg/mL; d, 0.25 μg/mL; e, 0.125 μg/mL; f, 0.0625 μg/mL
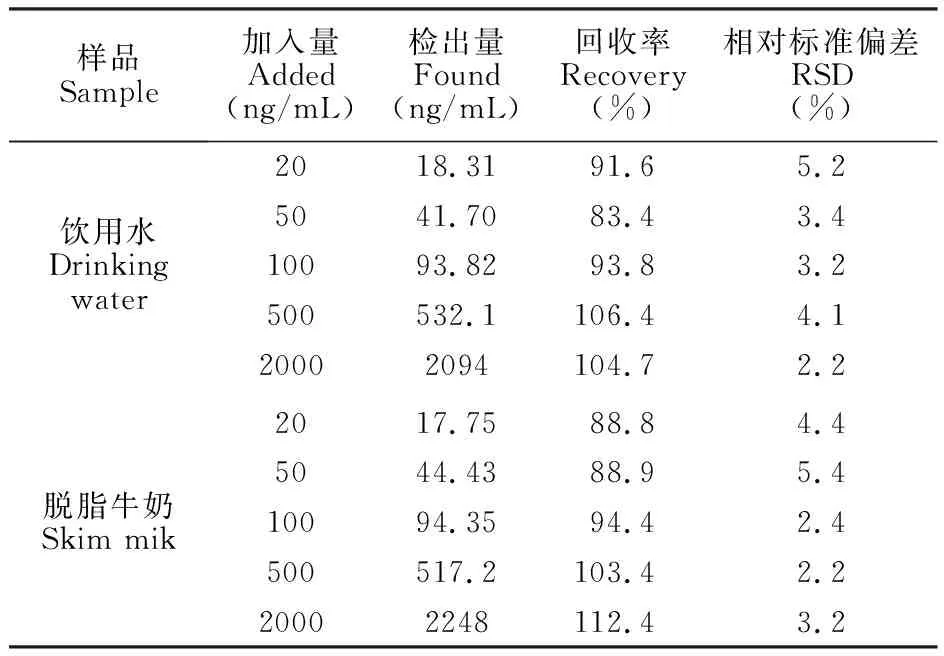
采用本方法检测市售脱脂牛奶及饮用水样品中的蓖麻毒素。脱脂牛奶首先在10000 r/min下离心20 min, 进一步除去上层脂肪,然后加入一定浓度的蓖麻毒素进行检测,结果见表3。加标回收率在83.4%~112.4%之间, 相对标准偏差在2.2%~5.4%之间, 表明本方法灵敏度较高, 准确性较好, 可用于牛奶和饮用水实际中蓖麻毒素的检测。
表3 牛奶和水样中蓖麻毒素加标回收测定结果
Table 3 Recoveries of RT in milk and water samples (n=3)
样品Sample加入量Added(ng/mL)检出量Found(ng/mL)回收率Recovery(%)相对标准偏差RSD(%)饮用水Drinkingwater脱脂牛奶Skim mik2018.3191.65.25041.7083.43.410093.8293.83.2500532.1106.44.120002094104.72.22017.7588.84.45044.4388.95.410094.3594.42.4500517.2103.42.220002248112.43.2
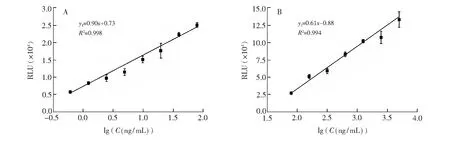
图8 检测不同浓度范围蓖麻毒素的工作曲线Fig.8 Linear calibration curves for detection of RT in different concentration ranges(A) 0.61-78.13 ng/mL, (B) 78.13-5000 ng/mL
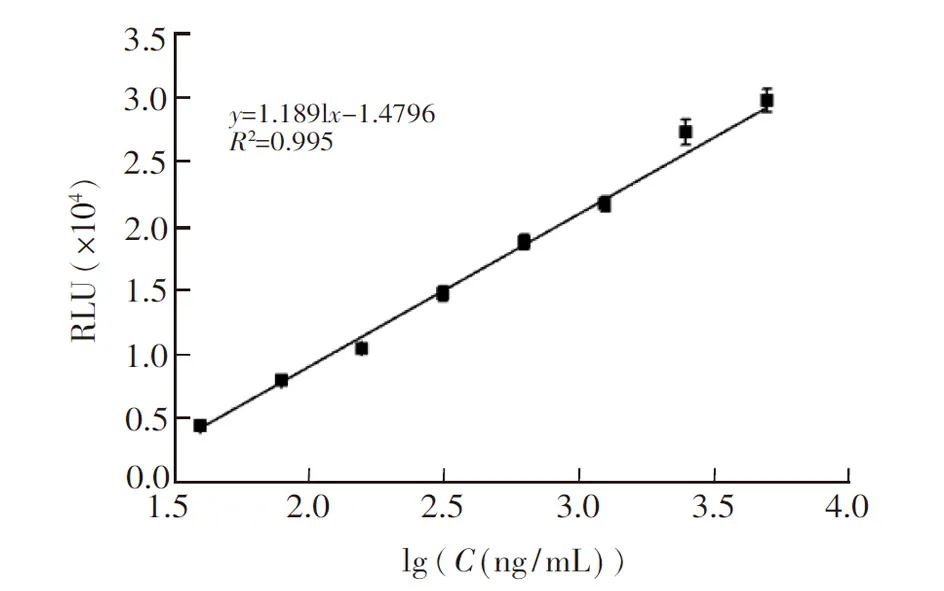
图9 双抗夹心化学发光免疫法检测蓖麻毒素的工作曲线Fig.9 Calibration curve of conventional chemiluminescence immunoassay for detection of RT
4 结 论
构建了一种基于免疫生物条形码及杂交链式反应的化学发光传感检测方法, 其中胶体金表面修饰大量的条形码DNA作为第一重信号放大, 进一步通过引入HCR恒温扩增策略进行信号的二次放大。蓖麻毒素的检出限为0.52 ng/mL, 用于脱脂牛奶及饮用水中蓖麻毒素的检测, 效果良好。本方法操作简单, 无酶扩增模式更有利于现场检测; 同时, 本方法有效克服了传统生物条形码技术线性范围较窄等不足。 本方法是DNA纳米材料作为信号放大元件的条形码检测技术的进一步提升, 对于其它目标物的检测具有一定的借鉴和参考价值。
