猪繁殖与呼吸综合征活疫苗与LT蛋白配伍经黏膜途径接种小鼠免疫效果分析
2019-01-14李本强程靖华马玉飞刘惠莉
李本强,陶 洁,程靖华,马玉飞,刘 雷,刘惠莉*
(1上海市农业科学院畜牧兽医研究所,上海种猪工程技术研究中心,上海201106;2上海市农业遗传育种重点实验室,上海201106)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种急性、热性传染病[1],在世界各地几乎都有发生,是近年来引起世界养猪业严重经济损失的重要疾病之一[2-3]。我国于1996年首次从猪群中检测到PRRSV,确认该病毒在我国猪群也存在。有研究报道,猪繁殖与呼吸综合征在我国危害最为严重,发病率可达99%,死亡率在50%—100%,给猪场和养猪户造成了极大的经济损失[4],严重影响我国养猪业的发展。目前对该病尚无有效的治疗方法,控制该病的主要方法仍是传统的免疫接种预防。国内采用的PRRS疫苗主要有灭活疫苗和活疫苗。灭活疫苗虽安全性好,但存在着免疫剂量大、次数多,且产生抗体水平的时间长,有时免疫后产生的抗体水平难达到预期的效果。活疫苗具有免疫效果好、免疫期长等优点,但有时会因为抗原性减弱而导致免疫原性受到限制,而且带毒时间长,很容易造成毒力返强、毒株重组等问题。
黏膜免疫系统是免疫网络的重要组成部分,是机体抵抗感染的第一道防线。它通过中和病毒和介导抗体依赖的细胞介导的细胞毒性作用(ADCC)等机制来行使其多种生物功能。滴鼻免疫可以使上呼吸道黏膜产生强的免疫反应,同时下呼吸道和胃肠道也能特异性分泌抗原特异性IgA和IgG。大肠杆菌不耐热肠毒素(Escherichiacoliheat-labile enterotoxin,LT)是一种很强的黏膜免疫原,起到佐剂的功能,经黏膜途径免疫后,能刺激机体产生高水平的针对抗原的黏膜IgA,被认为是目前最具潜力的黏膜佐剂之一[5-6]。黏膜免疫可在病原尚未侵入机体的定殖阶段即终止感染,减少病原对动物体的损伤,同时减少与注射导致的相关疫病的传播[7]。
PRRSV主要通过呼吸道感染途径传播[8],通过局部黏膜接种的方式,利用抗原与黏膜受体结合的占位作用,可有效阻断野毒经黏膜途径感染,达到很好的预防效果。本试验以现有PRRS疫苗(勃林格TJM-F92株)为基础,通过与黏膜佐剂LT配合免疫小鼠,探讨PRRS疫苗经黏膜途径免疫接种的可行性。
1 材料与方法
1.1 疫苗及LT蛋白佐剂
高致病性PRRSV活疫苗(TJM-F92株)购自上海勃林格殷格翰药业有限公司;PRRSV细胞毒(SH-1)由上海市农业科学院彭丽英老师馈赠。LT蛋白参考唐思静等[9]方法由本实验室制备、保存。
1.2 主要试剂
Trizol Reagent、M-MLV Reverse Transcriptase、Recominant Rnase Inhibitor、PrimeScriptRT reagent Kit RT with gDNAEraser购自Takara公司;TransStart Top Green qPCRSuperMix、PFU购自全式金公司;ELISA酶标板购自Thermo公司。
1.3 主要仪器
酶标仪购自Biotek公司;PCR仪和凝胶成像分析系统购自BIO-RAD;7500 Real Time PCR System购自ABI公司。
1.4 实验动物
1.5 试验分组及免疫
将小鼠随机分成4组,每组5只。第一组为对照组,注射生理盐水,0.2mL只;第二组滴鼻免疫高致病性PRRS活疫苗(TJM-F92株),0.2mL只;第三组滴鼻免疫添加LT(4 μg只)的高致病性PRRSV活疫苗,0.2mL只;第四组注射免疫高致病性PRRS活疫苗(TJM-F92株),0.2mL只。间隔14 d进行二次免疫。
分别在一次免疫的第7天和第14天、二次免疫的第7天、第14天、第21天、第28天、第35天和第42天收集小鼠鼻洗和粪便样品。同时采集血液并分离上清,-70℃冻存备用[10]。
1.6 ELISA检测IgG和IgA
以实验室保存的PRRSV细胞毒(SH-1)被酶标孔,每孔100 μL,4℃过夜,PBST洗涤5次;每孔加入250μL含5%脱脂乳的PBST封闭液,37℃封闭2 h,洗涤3次;加入稀释后的待检样品(血清1∶100稀释,粪便上清1∶3稀释),每孔加100 μL样品,37℃孵育1.5h,洗涤3次;加入二抗100μL(HRP标记的羊抗鼠IgG(1∶5 000);HRP标记的羊抗鼠IgA(1∶10 000),37℃孵育1h,洗涤3次;加底物液显色,37℃避光显色10min;每孔加50 μl 的2 molL硫酸终止反应,10 min内测定结果;利用酶标仪OD450读数。
1.7 荧光定量PCR检测细胞因子表达量
将采集的小鼠脾脏组织研磨,取250μL研磨后的组织悬液,利用Trizol试剂进行总RNA的提取,利用TAKARA公司的RT reagent kit with gDNA eraser试剂盒进行反转录,利用全式金的TransStart Top Green qPCRSuperMix进行Real-time PCR。
2 结果与分析
2.1 小鼠血清IgG抗体检测
PRRSV免疫小鼠试验,ELISA检测IgG结果显示,二免7 d后,3个免疫组小鼠体内IgG抗体水平均有显著性升高。从一免14 d开始,PRRSV注射组与PRRSV+LT滴鼻组小鼠的IgG水平均高于 PRRSV滴鼻组;PRRSV+LT滴鼻组IgG水平与PRRSV注射组相比,差异不显著(图1)。
2.2 小鼠鼻洗液IgA抗体检测
ELISA检测小鼠鼻洗液IgA,结果显示,除了对照组,各组小鼠IgA水平从一免7d开始即呈现上升趋势。二免21 d开始,PRRSV滴鼻组、PRRSV+LT滴鼻组和PRRSV注射组IgA水平明显升高,且维持在较高水平,其中PRRSV+LT滴鼻组升高最快,且高于PRRSV滴鼻组和PRRSV注射组(图2)。
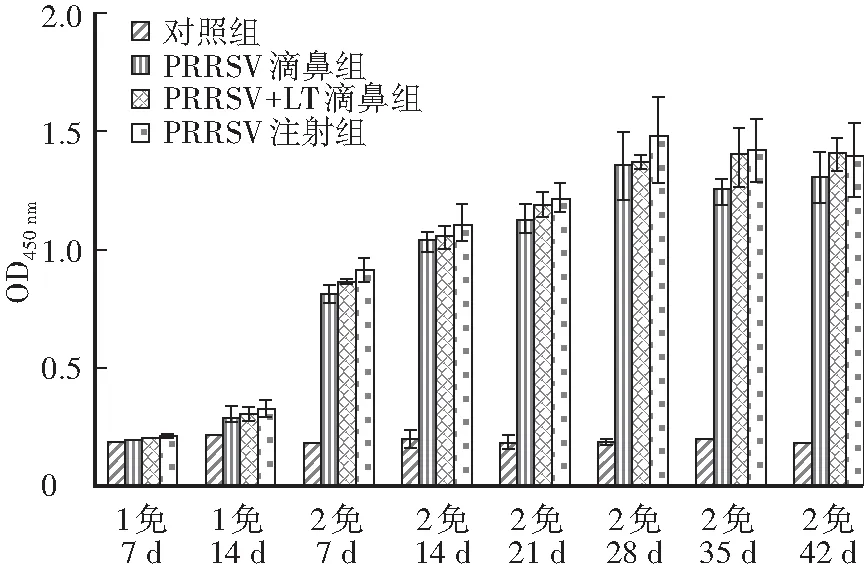
图1 免疫小鼠血清IgG抗体检测Fig.1 IgG antibody levels of mice after first and second immunization

图 2 免疫小鼠黏膜IgA抗体检测Fig.2 IgA antibody levels of mice after first and second immunization

图3 免疫小鼠后黏膜IgA抗体检测Fig.3 IgA antibody levels of mice after first and second immunization
2.3 小鼠粪便IgA抗体检测
ELISA检测粪便IgA结果显示,免疫早期,各组小鼠粪便IgA抗体均较低;二次免疫后21d开始,PRRSV滴鼻组、PRRSV+LT滴鼻组和PRRSV注射组IgA水平出现较明显的升高趋势,其中PRRSV+LT滴鼻组升高最快,且高于PRRSV滴鼻组和PRRSV注射组(图3)。
2.4 脾脏IFN-γ表达水平
如图4所示,PRRSV+LT滴鼻组小鼠在一免后24h和48h,IFN-γ表达量最高,显著高于PRRSV注射组,且极显著高于对照组;而与PRRSV滴鼻组差异不显著(P>0.05)。
2.5 脾脏IL-10表达检测
如图5所示,一免后24h,PRRSV滴鼻组、PRRSV+LT滴鼻组和PRRSV注射组IL-10表达升高,随后即出现下降趋势。其中, PRRSV注射组IL-10表达量最高,其次是PRRSV+LT滴鼻组,PRRSV滴鼻组最低。方差分析显示,PRRSV注射组和PRRSV+LT滴鼻组之间无显著性差异。

图4 小鼠脾脏IFN-γ表达量Fig.4 IFN-γ expression levels of mice’s spleens
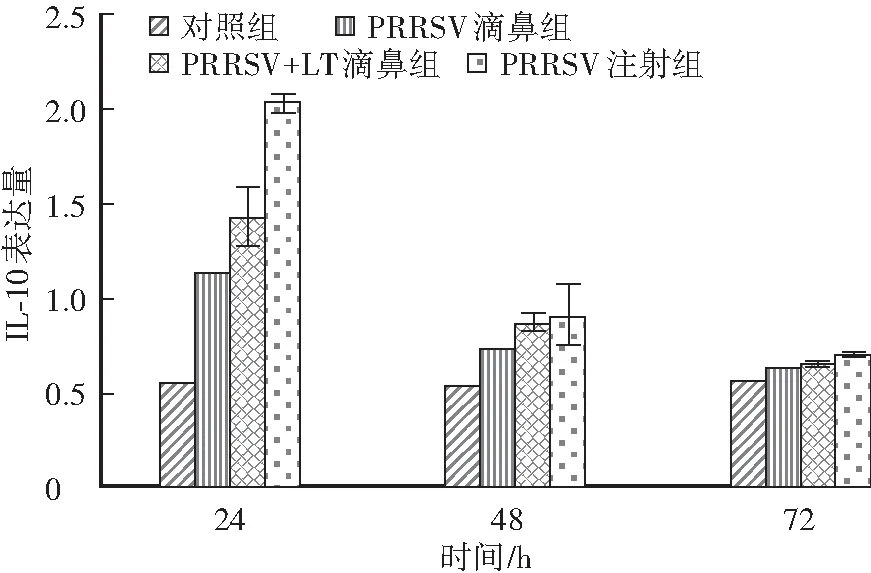
图5 小鼠脾脏IL-10表达量Fig.5 IL-10 expression levels of mice’s spleens
3 结论与讨论
本研究采用实验室构建的黏膜佐剂LT,与PRRSV疫苗一起经黏膜免疫小鼠,并与经肌肉注射免疫途径所产生的免疫应答进行比较,结果发现PRRSV滴鼻免疫也能获得理想的IgG抗体水平,与注射免疫无明显差异(P>0.05)。PRRSV疫苗与LT蛋白经滴鼻途径共免疫小鼠,不仅能够诱导高水平IgG,而且还能产生理想的局部黏膜IgA抗体。
PRRSV的感染途径为呼吸系统,依次经过鼻黏膜、扁桃体和PAM细胞,最后扩散到血液和全身[1,8]。PRRSV疫苗免疫目前还是传统的注射方式,依赖机体产生的抗体抵抗和中和病毒感染,但无法在PRRSV入侵的呼吸道黏膜产生抵抗作用[11-12]。Murtaugh等[13]提出PRRSV疫苗滴鼻免疫能提前产生中和抗体,为PRRSV的免疫接种提供了新的途径。党龙[14]采用滴鼻免疫途径PRRS TJM-F92株活疫苗,发现TJM-F92毒株疫苗的早期定殖为机体启动防御系统抵抗野毒感染赢得了时间,减轻和杜绝了产房后期和断奶猪的发病。本研究也证实PRRSV滴鼻组通过滴鼻途径产生IgG的水平与注射组差异不显著,且产生IgA的水平高于注射组。
鉴于LT蛋白具有良好的黏膜佐剂功能,研究将LT蛋白与PRRSV疫苗联合进行滴鼻免疫,且获得了理想的黏膜免疫效果。Nascimento等[15]用突变体LTAK63和结核分枝杆菌卡介苗免疫后,结果发现免疫后的小鼠产生更强的免疫应答,提供更高的免疫保护。Sing等[16]用突变体LTK63和LTR72和流感疫苗经鼻内给药共同免疫小鼠,结果显示添加LT突变体组能够诱导小鼠血清抗体IgG水平增加。同时Greer等[17]也证明以突变体LTR72作为佐剂,与人HPV-6b混合经滴鼻途径免疫小鼠,显著增加了血清中IgG的抗体水平。在本试验中,PRRSV疫苗与LT混合经滴鼻途径免疫能够刺激动物机体产生较好的局部黏膜免疫反应,且强于肌注免疫。这与Accolla等[18]在HIV-1 Tat蛋白研究中应用LT作为黏膜佐剂与Tat蛋白经鼻腔免疫小鼠,可以诱导小鼠产生高水平的IgA结果类似。证明LT蛋白能够提升PRRSV疫苗经黏膜途径免疫局部特异性的IgA抗体水平。
IFN-γ是重要的Th1型因子,具有抗病毒作用,可促进细胞介导的免疫应答。研究发现将PRRSV VR-2332突变株接种易感猪,血清中IFN-γ的含量持续升高,受免动物的细胞免疫力持续提升[19]。本研究表明滴鼻和注射免疫均能在免疫后24h诱导IFN-γ产生,且PRRSV+LT滴鼻组诱导的IFN-γ水平高于PRRSV注射组(0.01 本研究表明PRRSV疫苗经滴鼻免疫小鼠,能诱导理想的局部免疫和系统免疫应答,且LT蛋白共免疫能有效提升局部黏膜免疫抗体产生,为阻断病原黏膜感染提供保护屏障,同时活化Th1细胞,共同参与抗病毒免疫应答,为猪PRRSV疫苗经黏膜途径免疫提供了依据。
