干旱胁迫对水稻叶片生理生化特性的影响综述
2019-01-11汪本福王晴芳李阳张枝盛杨晓龙李汉东程建平
汪本福 王晴芳 李阳 张枝盛 杨晓龙 李汉东 程建平

摘要:干旱胁迫主要破坏作物叶片的光合功能,使叶片正常光合作用受阻,从而导致作物减产。综述了干旱胁迫对水稻叶片水势、叶片光合色素含量、光合作用参数、叶绿素荧光参数和抗氧化酶系统的影响,为水稻抗旱育种和抗旱栽培调控途径提供理论参考。
关键词:干旱胁迫;叶片水势;光合作用;叶绿素荧光;抗氧化酶
中图分类号:S511.5 文献标识码:A
文章编号:0439-8114(2019)23-0005-05
DOI:10.14088/j.cnki.issn0439-8114.2019.23.001 开放科学(资源服务)标识码(OSID):
Review on the effects of drought stress on physiological
and biochemical characteristics of rice leaves
WANG Ben-fu1,WANG Qing-Fang1,LI Yang1,ZHANG Zhi-sheng1,
YANG Xiao-long1,LI Han-dong2,CHENG Jian-ping1
(1.Key Lab of Huazhong Crop Production,Physiology and Ecology of Ministry of Agriculture and Rural Affairs/Hubei Key Laboratory of Food Crop Germplasm and Genetic Improvement,Wuhan 430064,China;2.Qianjiang Agricultural Technology Promotion Center,Qianjiang 433100,Hubei,China)
Abstract: Drought stress mainly destroys the photosynthetic function of crop leaves, the normal photosynthesis of leaves is blocked, thus reducing the yield of crops. The effects of drought stress on leaf water potential, leaf photosynthetic pigment content, photosynthesis parameters, chlorophyll fluorescence parameters and antioxidant enzyme system were reviewed, which provided a theoretical reference for rice drought-resistant breeding and drought-resistant cultivation regulation.
Key words: drought stress; leaf water potential; photosynthesis; chlorophyll fluorescence; antioxidant enzyme
中国大约有65%上的人口以水稻为主食,作为世界主要的水稻生产区,其水稻生产面积占全世界水稻生产面积的19%,产量占世界水稻产量的32%(FAO 2019)。近年来,随着全球气候的变化,降雨在时间和空间上的不均勻分布造成淡水资源的短缺,致使干旱已经成为制约中国农业生产发展的重要非生物因素[1,2]。在中国,水稻作为重要的粮食作物,种植方式仍然以传统的淹水灌溉为主,其灌溉用水量占每年农业用水量的65%[3]。随着人口的增加,如果人均水稻消费量保持在目前的水平,中国将需要在2030年前增加约20%的水稻产量才可以满足国内粮食需求[4]。
干旱会造成水稻严重减产甚至绝收,其出现次数、持续时间、影响范围和造成的损失居自然灾害之首。干旱导致水稻减产的主要原因之一是减弱了水稻光合作用,干旱胁迫首先引起叶片生长受抑制,光合有效面积降低,叶绿素降解加速,使得叶片光合活性和光合能力降低。约90%的水稻产量来自抽穗后的光合产物,因此,开展水稻叶片光合作用对干旱胁迫的响应研究,对季节性干旱区和持续性干旱地区的水稻生产和粮食安全具有重要意义。
1 叶片水势对干旱胁迫的响应
叶片是水稻光合作用最重要的器官,叶片的健康状况对于维持正常的光合作用具有重要的作用,而光合作用的过程需要消耗大量的水分,叶片高含水状态和高水势是保证光合作用的基础[5]。而叶片水势指示了叶片吸水和保水的能力,是调节体内细胞水分状况的重要机制。研究认为叶片水势参与了细胞气孔的调节,干旱胁迫下叶片水势降低,叶片失水导致气孔关闭,降低蒸腾作用,减少植株体内水分的散失。同时发现在干旱胁迫下叶片水势与光合作用呈相同的趋势,并且两者存在显著的相关性,说明叶片水势对植物的新陈代谢以及叶片的伸长生长有影响[6]。有研究认为叶片水势并非是惟一控制气孔开闭的主要机制,但是细胞内的同化物质、渗透调节物质对于气孔的调节具有重要的作用,这可能与物种差异有关[7]。叶片气孔运动蒸腾作用是驱动水分在植物体内导管运输的原动力,蒸腾作用导致木质部进入负压状态,然而叶片水势降低迫使植物水分运输系统处于压力状态下,其木质部发生栓塞、水分在土壤-植物-大气转运过程中受到的阻力会显著增加[8],叶片水势过低超过临界值,水分运转力衰竭、呼吸减少,伴随着后期碳同化的不足,最终导致植物碳饥饿而死亡[9]。
有研究指出,叶片水势与植物的抗旱性密切相关。在干旱缺水的条件下,通过研究叶片水势与渗透调节的表达发现,具有较高叶片水势的水稻品种渗透调节能力也较强;同时还发现在水稻开花期干旱胁迫下,叶片水势与颖花不育百分比存在显著的遗传相关性,说明维持较高的叶片水势对于增强水稻的抗旱能力具有重要的作用[10]。从叶片形态的角度来看,叶片水势过低、叶片失水、卷曲是指示植株水分状况和抗旱能力的重要指标,是植物对水分亏缺的典型反映[11]。土壤干旱胁迫的情况下,叶片水势降低、发生卷曲,抑制叶片的蒸腾作用以阻止水分散失是叶片内部水势状况和渗透调节物质共同作用的结果[12]。但也有研究指出叶片形态是干旱胁迫下水稻叶片卷曲的遗传变异基础而非植物的水分状态[13]。对没有受到结构性损伤的水稻补水,叶片水势可以恢复到正常水平,其生理功能也能够得到一定的恢复,但是从整个生育期角度来看,水稻叶片可能出现提前衰老的现象[14]。
2 叶片叶绿素含量变化对干旱胁迫的响应
叶绿体是植物进行光合作用的重要场所,叶绿素分子特异性的排列在叶绿体类囊体光系统的膜上,用来光能吸收传递和转换,叶绿素含量与光合作用存在显著的相关性。一般认为在最适条件下,叶绿素含量与光合速率、光合积累呈线性关系,在生殖生长阶段维持长时间的高水平叶绿素含量是增加作物产量的一种必要,但也有研究发现高叶绿素含量不是叶片高光合速率的必要条件,且电子传递链不受叶绿素含量降低的影响。水稻叶片叶绿素含量降低60%,水稻冠层群体的光合能力反而增加了3%。这是因为适当降低叶片叶绿素含量,一方面可以减少叶片吸收过量的光能,降低光抑制对光合的损伤,提高光系统Ⅱ的效率,另一方面可以减少叶片氮素在叶绿素合成过程中的消耗,增加Rubisco酶含量,最终提高叶片的光合速率[15]。叶绿素主要包括葉绿素a、叶绿素b和类胡萝卜素,其中叶绿素a和叶绿素b是参与光合作用的主要光合色素,在植物的不同生育阶段两者的比值不同。在适宜的环境下作物保持较高的叶绿素a与叶绿素b的比值,一方面将叶绿素捕获的光能转化为化学能,为碳同化提供能量基础;另一方面减少过多的光能捕获降低光抑制发生的可能性[16]。
3 叶片光合作用变化对干旱胁迫的响应
叶片的光合作用是利用光能将空气中的CO2和水转变成有机碳水化合物的过程,光合积累产物是植物生长发育和产量构成的基础,稳定水稻群体的光合生产效率是作物应对干旱逆境胁迫的目标[17]。在水稻栽培过程中干旱和高温经常会同时出现,干旱胁迫不仅显著降低水稻叶片的净光和速率、气孔导度和蒸腾速率,同时也改变了叶片的水分利用效率。此外,干旱胁迫增加了光补偿点和暗呼吸的速率,降低了光饱和点和最大光合速率,显著抑制了植物的生长发育进程[18]。也有研究认为在干旱和高温双重胁迫下,有限的光合碳同化能力和高强度的线粒体呼吸共同导致了产量的降低,在水分亏缺的情况下,叶片气孔导度降低,蒸腾水分散失减少同时降低叶肉电导率,最终导致CO2从大气转移到叶绿体基质中羧化位点的能力降低,干旱胁迫对水分利用的限制主要是水分子的扩散受到抑制而非代谢受阻引起的。CO2从大气进入细胞叶绿体需要克服多重阻力,叶片表面界层阻力、气孔阻力和叶肉阻力,各阻力的倒数分别被称为表层导度、气孔导度和叶肉导度。在干旱胁迫条件下,气孔导度对CO2进入细胞的限制占主导地位[19]。气孔的发育受环境因素的影响非常大,气孔是由表皮细胞逐渐转化而来的两个对等的保卫细胞组成,它的发育受到很多正调控基因和负调控基因的协同控制,以保证其控制间隔一个表皮细胞,从而维持气孔的功能[20]。有研究发现叶片水势与气孔的开闭、气孔导度关系密切,其中由保卫细胞膨压变化触发的调节是一种被动的气孔调节机制,干旱胁迫对气孔的影响显著。
作物的光合作用受到多重外部环境因子的影响,干旱胁迫是限制水稻生产的主要因素[21]。干旱对水稻叶片光合的抑制作用主要从气孔限制和非气孔限制两个方面予以解释,在干旱胁迫程度较低的阈值范围内,光合速率下降的主要原因是气孔关闭引起胞间CO2浓度降低;而当干旱胁迫程度严重时,叶片结构受损、 Rubisco羧化效率下降是光合速率下降的主要原因[22];且在严重的干旱胁迫下,由非气孔限制引起的光合机构受损是一个不可逆的过程。在干旱胁迫下光合作用下降是一个动态变化的过程,从气孔限制到非气孔限制的过程中伴随着土壤干旱胁迫程度的不断加深。此外,水分利用效率(WUE)也是土壤干旱研究的热点问题,如何提高作物的WUE并维持一定的产量是目前稳定干旱及半干旱地区粮食安全生产的重要目标。预计到2030年中国粮食年产量将达到580万t,产量增加幅度为2%左右,才可以维持不断增长的人口与粮食需求之间的平衡[23]。从植物生理学角度来说,WUE是指叶片的净光合速率(Pn)与蒸腾速率(Tr)的比值。在干旱的环境中提高作物的WUE是提高作物产量的关键因子,而气孔闭合程度是影响WUE的重要影响因素,有研究发现在一定程度的干旱胁迫下,气孔关闭对Tr的抑制显著高于对Pn的限制,进而导致WUE的提高。
4 叶片叶绿素荧光参数对干旱胁迫的响应
叶片将光能转化成化学能需要经过原初光化学反应、电子传递和光合磷酸化、碳同化三个过程,叶绿素荧光是在光合作用的原初反应中处于基态的叶绿素分子被光激发发生光化学反应的过程中产生。如图1所示,位于光合反应中心能量最低最稳定状态——基态(Groundstate)的叶绿素分子通过吸收不同波段的光子,低能状态的电子可以克服原子核正电荷的吸引进入高能量状态,其中吸收蓝光进入较高激发状态,吸收红光进入最低激发状态,这两个状态的能量均高于稳定的基态。处于激发状态的电子不稳定,在退激的过程中会以不同的形式进行能量的消化转变,其中一个是热耗散,另一个是叶绿素荧光和磷光,即植物吸收的一小部分光重新以光的形式发射出来,这一过程中分子能量传向光反应中心[24]。目前光能量转化、能量耗散理论方面的研究相对较少,通过叶绿素荧光动力学检测技术研究水稻应对干旱胁迫的响应机制是目前较为流行的能量分析方法[25]。按照测量方法的不同,叶绿素荧光的测定可分为调制式和非调制式两种方法,德国生产的脉冲调制(Pulse Amplitude Modulation,PAM)叶绿素荧光测定系统属于调制式。PAM将调制测量光源和非调制光化光源相结合来激发荧光,并检测记录相同频率的荧光,获得光化学猝灭曲线,该方法可活体测定,具有方便、快速、灵敏等优点。
通过叶绿素荧光动力学技术可以检测植物逆境下的生理变化,特别是与光合作用相关的荧光参数(图1)。F0是指绿色植物在充分的暗适应之后突然受到可见光的照射,光合反应中心的叶绿素分子a处于完全开放时可获取的荧光强度,被称为荧光诱导初级相位。Fm是指绿色植物在充分的暗适应之后又施加饱和脉冲使光合反应中心的叶绿素分子a处于完全关闭时所获取的最大荧光强度。Fm′是指绿色植物在光适应后又施加饱和脉冲使光合反应中心的叶绿素分子a处于完全关闭时所获取的荧光强度。植物叶绿素吸收的光能主要通过光化学反应、叶绿素荧光和热能三个途径进行消耗,其中光反应占据比例最大,热能耗散次之,荧光消耗最小。通过测定叶绿素荧光的变化可了解光合系统的运行状况。
荧光猝灭有两种表现形式:光化学猝灭和非光化学猝灭。光化学猝灭可反映PSⅡ光合反应中心的开放程度,用光化学猝灭系数qP来衡量计算;非光化学猝灭(Non-photochemical quenching coefficient,NPQ)主要是由热耗散引起的,用来估算通过热能耗散的光能,以降低光合反应中心的光能分配。起初很多研究认为这种热耗散是对光能的一种浪费,后来越来越多的研究认为,通过热耗散损失的光能是植物无法利用的光能,且对光合作用有抑制作用的一部分光能,因此在逆境下NPQ是一种光防御保护机制[26]。不同于C4植物,水稻作为C3植物在高温和强光照下生长对光能的利用效率较低。研究水稻光饱和曲线发现,水稻在光强达到1 000 μmol/(m2·s) PPFD的时候就会达到饱和[27],过多的光能也会导致高效的光呼吸和激发状态能量过多,造成植物体内活性氧增加,抑制光合效率的增加,因此增强水稻的NPQ对于降低光抑制具有重要的作用。但是单一使用NPQ作为评估光保护的评价指标并不恰当,因为NPQ与光合保护并不存在显著的线性关系。图1中,从时间尺度上将NPQ划分为qE和qI两种类型,分别被称为快速诱导NPQ和慢速诱导NPQ,慢速诱导在特定的环境下可长期存在,又被叫做光抑制猝灭[28]。采用叶绿素荧光动力学技术检测逆境胁迫下光合生理的变化是目前比较流行也是较为简单易操作的方法与手段,该技术获得参数可以用来比较不同品种以及不同非生物胁迫之间对光合生理变化的交互作用。通过叶绿素荧光动力学技术研究了高产杂交水稻在生殖生长阶段延迟干旱的情况下水稻剑叶PSⅠ和PSⅡ光合性能的变化,结果表明,干旱发生后21 d,PSⅡ中心的供体放氧复合物的偶联和受体电子传递受到抑制;同时NPQ显著增加热耗散,激活反应中心和电子运输的下调对于重新平衡两个光系统之间的能量分配至关重要。在严重干旱胁迫下,由于叶绿素分子的降解,光能捕获量也随之减少,非循环的电子传递速率提高,NPQ显著增加,增强激发能量的猝灭耗散是植物长期适应干旱胁迫的重要生理机制。
5 叶片抗氧化酶防御系统对干旱胁迫的响应
植物在适宜的生存条件下体内新陈代谢产生的活性氧系统(Reactive oxygen species,ROS)和ROS清除系统处于一个动态平衡之中,以保证植物免受活性氧的伤害。目前研究比较清楚的活性氧主要包括羟基自由基(OH-)、超氧阴离子自由基(O2-·)、过氧化氢(H2O2)等含氧自由基或非自由基的含氧分子。ROS可在植物体内任何部位产生,在逆境胁迫下扰乱ROS的产生和清除平衡体系,并加剧ROS的产生,对植物产生毒害作用,ROS浓度在植物体内大量积累会破坏植物的细胞结构,造成不可逆的损伤[29]。
在逆境干旱胁迫下,植物可以形成ROS的酶促清除系统和非酶促系统来抵御干旱胁迫。有研究评估了抗坏血酸-谷胱甘肽循环在不同胁迫条件下植物的防御机制和抗氧化能力中的作用,整合非酶(抗坏血酸和谷胱甘肽)和酶途径及其生物分子调节抗氧化酶活性和非酶抗氧化剂含量的变化是植物重要的代谢过程。超氧化物歧化酶(SOD)是抗氧化防御的第一道防线,它催化超氧阴离子自由基(O2-·)向H2O2和O2的转化。过氧化氢酶(CAT)普遍被认为是第二道清除细胞代谢产生的过氧化氢的重要防线。过氧化物酶(POD)的氧化还原反应在高浓度氧气下起主导作用,这一特性使得过氧化物酶能够保护细胞免受高浓度氧气的侵害[30]。此外,对抗氧化酶基因表达的研究有助于阐明植物在分子水平上对氧化胁迫的适应机制。近年来,旱稻和节水抗旱稻成为育种家为应对干旱的气候环境不断努力的方向,而旱稻和节水抗旱稻之所以能够在干旱和半干旱地区生存,除本身自有的基因功能外,完善的抗氧化防御系统对于水稻适应干旱胁迫环境具有重要的作用。
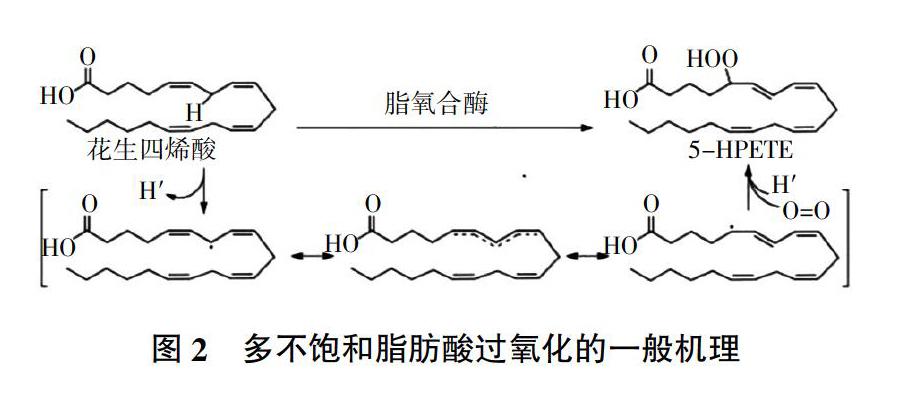
有研究指出,干旱胁迫诱导的膜脂过氧化是体内活性氧ROS积累量超过一定的阈值而引起的,膜磷脂分子的多聚不饱和酸(亚油酸、花生四烯酸、二十二碳六烯酸)的不饱和双键容易遭受羟基自由基的攻击,发生过氧化链式循环反应[31]。如图2所示,在氧化的第一步中,从桥连两个双键的亚甲基碳上除去氢原子,弱CH键和所得双烯丙基自由基的稳定性促使氢原子去除的选择性降低。这种共振稳定的系统允许膜脂异构化成热力学更稳定的异构体,形成共轭二烯,其与分子氧反应形成膜脂过氧化物。大量的膜脂过氧化的积累显著增加了细胞膜的流动性和通透性,抑制了细胞膜的正常生理功能,同时还会增加植物细胞内蛋白质和DNA遗传物质的水解[32]。在盆栽试验中,干旱胁迫严重阻碍了水稻品种的发芽率、幼苗生长和淀粉代谢;但与正常条件相比,提高了两个水稻品种的抗氧化酶活性和膜脂过氧化水平[33]。膜脂过氧化的程度可通过丙二醛(MDA)含量予以监测,MDA含量的多少间接反映植物组织抗氧化的能力,很多研究认为MDA是鉴定作物品种耐旱性的一项重要生理指标[16]。
6 結语
水稻在驯化与育种栽培过程中已形成一套避旱、抗旱等逆境适应机制,在干旱胁迫发生时,水稻会通过改变自身的形态、激发逆境调控基因表达、启动抗氧化防御体系、改变光合作用机制和自身细胞渗透调节等形式来适应和抵抗逆境环境。随着蛋白质组学和基因技术的发展,对干旱胁迫的研究逐渐走向分子水平,分子层面的机理还有待进一步拓展和研究。
參考文献:
[1] WANG Y J,HUANG J K,WANG J X,et al. Mitigating rice production risks from drought through improving irrigation infrastructure and management in China[J].Aust J Agric Resour Econ,2018,62:161-176.
[2] ZHUANG Y H,ZHANG L,LI S S,et al.Effects and potential of water-saving irrigation for rice production in China[J].Agr Water Manage,2019,217:374-382.
[3] LI Y Y,SHAO X H,SHENG Z P,et al.Water conservation and nitrogen loading reduction effects with controlled and mid-gathering irrigation in a paddy field[J].Pol J Environ Stud,2016,25:1085-1091.
[4] PENG S B,TANG Q Y,ZOU Y B.Current status and challenges of rice production in China[J].Plant Prod Sci,2009,12:3-8.
[5] PIVOVAROFF A L,PASQUINI S C,De Guzman M E,et al. Multiple strategies for drought survival among woody plant species[J].Funct Ecol,2016,30:517-526.
[6] ZHOU Q,JU C X,WANG Z Q,et al. Grain yield and water use efficiency of super rice under soil water deficit and alternate wetting and drying irrigation[J].J Integr Agr,2017,16:1028-1043.
[7] VILALTA J M,FORNER N G.Water potential regulation,stomatal behaviour and hydraulic transport under drought:Deconstructing the iso/anisohydric concept[J].Plant Cell Environ,2017,40:1618-1628.
[8] WANG X P,LIU H L,YU F L,et al. Differential activity of the antioxidant defence system and alterations in the accumulation of osmolyte and reactive oxygen species under drought stress and recovery in rice(Oryza sativa L.)tillering[J].Sci Rep,2019,9:8543.
[9] KONOT JONGDEE B,FUKAI S,COOPER M. Leaf water potential and osmotic adjustment as physiological traits to improve drought tolerance in rice[J].Field Crops Res,2002,76:153-163.
[10] KONO Y,ISHIDA A,SAIKI S T,et al.Initial hydraulic failure followed by late-stage carbon starvation leads to drought-induced death in the tree Trema orientalis[J].Commun Bio,2019,2:8.
[11] KALAJI H M,JAJOO A,OUKARROUM A,et al. Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions[J].Acta Physiol Plant,2016,38:102.
[12] 杨晓龙,汪本福,陈 亮,等.抽穗期干旱对水稻生理性状和产量的影响[J].中国稻米,2015,21(4):138-141.
[13] CASTRO P,PUERTOLAS J,DODD J C.Stem girdling uncouples soybean stomatal conductance from leaf water potential by enhancing leaf xylem ABA concentration[J].Environ Exp Bot,2019,159:149-156.
[14] GUYOT G,SCOFFONI C,SACK L. Combined impacts of irradiance and dehydration on leaf hydraulic conductance:Insights into vulnerability and stomatal control[J].Plant Cell Environ, 2012,35:857-871.
[15] GU J F,ZHOU Z X,LI Z K,et al. Rice (Oryza sativa L.) with reduced chlorophyll content exhibit higher photosynthetic rate and efficiency,improved canopy light distribution,and greater yields than normally pigmented plants[J].Field Crops Res,2017,200:58-70.
[16] WANG Y J,SPERRY J S,VENTURAS M D,et al..The stomatal response to rising CO2 concentration and drought is predicted by a hydraulic trait-based optimization model[J].Tree Physiol,2019,39:1416-1427.
[17] PERDOMO J,CARMO-SILVA E,HERMIDA-CARRERA C, et al. Acclimation of biochemical and diffusive components of photosynthesis in rice,wheat,and maize to heat and water deficit:implications for modeling photosynthesis[J].Front Plant Sci,2016,10:3389.
[18] ZHANG Y J,XIE Z K,WANG Y J,et al.Effect of water stress on leaf photosynthesis, chlorophyll content,and growth of oriental lily[J].Russian J Plant Physiol,2011,58:844.
[19] THOLEN D,ZHU X G.The Mechanistic basis of internal conductance:A theoretical analysis of mesophyll cell photosynthesis and CO2 diffusion[J].Plant Physiol,2011,10:1104.
[20] HEPWORTH C,CAINE R S,HARRISON E L,et al.Stomatal development:Focusing on the grasses[J].Curr Opin Plant Biol,2018,41:1-7.
[21] ZHOU Y H,LAM H M,ZHANG J H. Inhibition of photosynthesis and energy dissipation induced by water and high light stresses in rice[J].J Exp Bot,2007,58:1207-1217.
[22] SARABI B,FRESNEAU C,GHADERI N,et al. Stomatal and non-stomatal limitations are responsible in down-regulation of photosynthesis in melon plants grown under the saline condition: Application of carbon isotope discrimination as a reliable proxy[J].Plant Physiol Bioch,2019,141:1-19.
[23] FAN M S,SHEN J B,YUAN L X,et al. Improving crop productivity and resource use efficiency to ensure food security and environmental quality in China[J].J Exp Bot,2012,63:13-24.
[24] KURASHOV V,HO M Y,SHEN G Z,et al. Energy transfer from chlorophyll f to the trapping center in naturally occurring and engineered photosystem I complexes[J].Photosyn Res,2019,141:151-163.
[25] MEACHAM K,SIRAULT X,QUICK W P,et al..Diurnal solar energy conversion and photoprotection in rice canopies[J].Plant Physiol,2017,173:495-508.
[26] XING X G,BRIGGS N,BOSS E,et al. Improved correction for non-photochemical quenching of in situ chlorophyll fluorescence based on a synchronous irradiance profile[J].Opt Express,2018,26:24734-24751.
[27] KIRST H,GABILLY S T,NIYOGI K K,et al. Photosynthetic antenna engineering to improve crop yields[J].Planta,2017,245:1009-1020.
[28] RUBAN A V. Nonphotochemical chlorophyll fluorescence quenching:mechanism and effectiveness in protecting plants from photodamage[J].Plant Physiol,2016,170:1903-1916.
[29] ZOROV D B,JUHASZOVA M,SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J].Physiol Rev,2014,94:909-950.
[30] JU S M,YIN N N,WANG L P,et al. Effects of silicon on Oryza sativa L. seedling roots under simulated acid rain stress[J].PLoS One,2017,p:e0173378.
[31] LUCHI K,IMOTO A,KAMIMURA N,et al. Molecular hydrogen regulates gene expression by modifying the free radical chain reaction-dependent generation of oxidized phospholipid mediators[J].Sci Rep,2016,6:18971.
[32] ZAFAR S A,PATIL S B,UZAIR M,et al.Degenerated panicle and partial sterility 1(DPS1) encodes a CBS domain containing protein required for anther cuticle and panicle development in rice[J].New Phylot,2019,10:1111.
[33] 張国萍,倪日群,赵新亮,等.水引发时干旱胁迫下水稻种子发芽与幼苗生长的影响[J].种子,2002(2):20-22.
