Ligase Ⅳ基因突变对小鼠生长及成体神经系统发育的影响
2019-01-11汪光明
邱 月, 汪光明, 徐 俊
(同济大学医学院,上海 200092)
Ligase Ⅳ是参与DNA双链断裂修复的DNA连接酶家族之一[1],与XRCC4(X-ray repair cross comple-menting group 4)形成复合物连接到DNA双链断裂处行使其功能[2],其参与的非同源性末端接合(non-homologous end joining, NHEJ)修复方式还需要K70/K80蛋白和DNA-PKcs等酶共同完成[3-4]。而Ligase Ⅳ基因完全缺失会导致小鼠胚胎死亡[5],Ligase Ⅳ突变的小鼠在胚胎时期会增加神经干细胞(neural stem cells, NSCs)的内源性损伤,神经系统发育不健全[6]。本研究利用Ligase Ⅳ突变小鼠为实验动物,确定其生命周期,并通过体内和体外实验证明Ligase Ⅳ基因对成体神经系统发育的影响。
1 材料与方法
1.1 小鼠与试剂
Ligase ⅣY288C(C57/BL6)杂合子小鼠由四川大学刘聪教授实验室友情馈赠,该突变是由乙基亚硝脲(ENU)诱导Ligase Ⅳ基因的第1067位点的碱基A突变成G,从而原本编码酪氨酸(Y)的密码子变成了编码半胱氨酸(C)的密码子,即获得Ligase ⅣY288C小鼠。用Ligase Ⅳ杂合子交配得到的同窝野生型(WT)小鼠和突变型Ligase ⅣY288C纯合子(MU)小鼠作为研究对象,所有小鼠饲养于同济大学无特定病原体级实验动物中心,所有动物实验操作规范依据同济大学医学院实验动物委员会文件(TJmed-010-10)执行。
细胞培养液DMEM/F12、GlutaMAX、0.05% Trypsin-EDTA、B27购自美国Gibco公司;基底胶Metrigel购自美国BD公司;细胞因子EGF、bFGF购自美国R&D公司;一抗抗体Ki67(兔源)、Sox2(羊源)、Nestin(鼠源)购自美国Thermo公司;二抗Donkey-Rabbit/Goat/Mouse-cy3/488购自美国Jackson公司;DAPI染色液购自中国国药试剂公司。
1.2 小鼠体质量统计
对不同发育时间点的WT(n=7)和MU(n=7)雌雄小鼠体质量进行称量,统计从1周到4月龄的雄性WT小鼠(M-WT),雌性WT小鼠(F-WT),雄性MU小鼠(M-MU),雌性MU小鼠(F-MU)的体质量。
1.3 小鼠标本收集
称重4.5月龄WT和MU小鼠,记录小鼠的体质量和生命周期,配制0.5%戊巴比妥钠麻醉剂,按100mL/5g体质量的剂量注射小鼠进行麻醉,用4%多聚甲醛灌注小鼠以固定组织,取出WT和MU小鼠脑称重。小鼠脑组织经10%、20%、30%蔗糖溶液中脱水并保存在30%蔗糖溶液中以便后续使用。
1.4 小鼠脑组织冰冻切片免疫荧光染色
用OCT包埋小鼠大脑,并进行冠状冰冻切片,片厚20μm,收集侧脑室下区(SVZ)脑片,将切好的脑片按顺序贴在载玻片上,磷酸盐缓冲液(PBS)清洗3遍,3%BSA封闭40min。一抗孵育过夜,PBS清洗3遍。二抗室温孵育2h,DAPI室温孵育30min,PBS清洗3遍。在倒置荧光显微镜下检测荧光信号,用共聚焦显微镜拍照统计NSCs数量等。对4.5月龄的WT和MU小鼠鼠脑进行冰冻切片,并进行Sox2免疫荧光染,通过对WT(n=6)和MU(n=6)小鼠相同区域内Sox2活性细胞统计为了进一步了解Ligase Ⅳ基因对小鼠神经系统发育的影响。用NSCs增殖标志物Ki67对小鼠冰冻切片做免疫荧光染色,发现WT小鼠SVZ的NSCs增殖比MU小鼠多。通过对WT(n=3)和MU(n=3)小鼠相同区域内Ki67活性细胞统计。
1.5 体外NSCs增殖实验
小鼠体内实验显示: MU小鼠SVZ的NSCs增殖减少。为了进一步验证上述结果,分离WT(n=3)和MU(n=3)小鼠的原代NSCs进行培养。消化NSCs成单细胞悬液并计数,按照1×103/mL的密度接种到6孔板里,每孔接种2mL细胞悬液,细胞培养箱(37℃、5% CO2)中培养5d,分别对第1代(P1)细胞和第4代(P4)细胞进行统计分析,40倍显微镜下统计直径>30μm的神经球的数量。
1.6 统计学处理
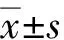
2 结 果
2.1 WT和MU小鼠生存曲线
对同窝的WT(n=23)和MU(n=23)小鼠的死亡时间进行记录,统计从小鼠出生到7月龄不同基因型小鼠的生命周期,用GraphPad Prism 6.0分析小鼠的生存曲线(图1),结果显示: WT小鼠在观察期内无死亡,MU小鼠的生存率逐步降低,1月龄时出现死亡,4.5月龄的生存率低于50%,7月龄生存率仅为9%(P<0.0001)。

图1 WT和MU小鼠生存曲线Fig.1 Survival curves of WT and MU mice
2.2 WT和MU小鼠体质量差异
对比4.5月龄不同基因型雄性小鼠的体态大小,成年WT小鼠体质量明显大于MU小鼠(图2)。WT小鼠的体质量比同等发育时长的MU小鼠体质量大且差异越来越明显,M-WT小鼠体质量比F-WT小鼠体质量大,MU雌雄小鼠体质量差异(表1)。

图2 WT和MU小鼠形态对比Fig.2 Morphological contrast of WT and MU mice左侧: WT小鼠,右侧: MU小鼠
2.3 WT和MU小鼠脑质量差异
WT小鼠脑组织明显大于MU小鼠脑质量(图3)。统计结果显示: WT小鼠的脑质量平均为(0.34±0.035) g,MU小鼠的脑质量平均为(0.24±0.021) g,两组小鼠脑质量差异有统计学意义(P<0.0001)。

表1 不同时间各组小鼠体质量

图3 WT和MU小鼠脑质量对比Fig.3 Comparison of brain weight in WT and MU Mice左侧: WT小鼠,右侧: MU小鼠
2.4 不同基因型小鼠SVZ的NSCs数量分析
小鼠大脑冰冻切片SVZ的Sox2和Nestin免疫荧光染色结果见图4,绿色荧光为Sox2阳性细胞,红色荧光为Nestin阳性细胞。统计结果显示: WT小鼠SVZ的NSCs平均值是(101±5.8)个,MU小鼠SVZ的NSCs平均值是(79±4.1)个,MU小鼠SVZ的NSCs数量是WT小鼠的78%,差异有统计学意义(P<0.01)。
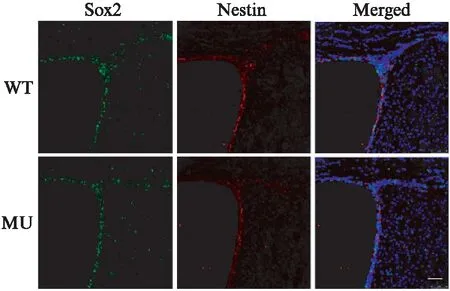
图4 4.5月龄的WT和MU小鼠SVZSox2免疫染色Fig.4 Immunostaining of Sox2 in SVZ of 4.5-month WT and MU mice标尺: 50μm
2.5 不同基因型小鼠SVZ的NSCs体内增殖分析
免疫荧光染色见图5,绿色荧光为Nestin阳性细胞,红色荧光为Ki67阳性细胞。统计结果显示: WT小鼠SVZ的NSCs增殖的平均值为(145±6.7)个,MU小鼠SVZ的NSCs增殖的平均值为(92±5.5)个,MU小鼠SVZ的NSCs的数量是WT小鼠的63%,差异有统计学意义(P<0.05)。
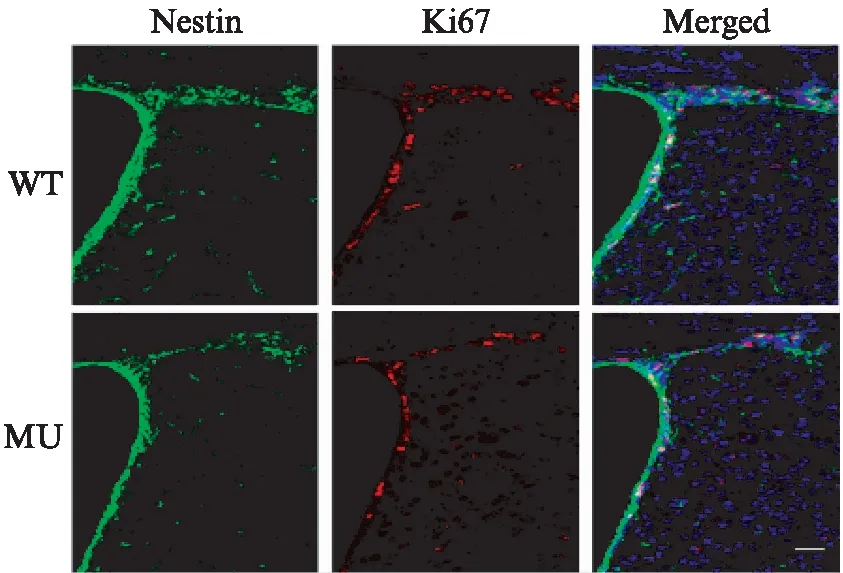
图5 4.5月龄的WT和MU小鼠SVZ Ki67免疫染色Fig.5 Immunostaining of Ki67 in SVZ of 4.5-month WT and MU Mice标尺: 50μm
2.6 不同基因型小鼠的NSCs体外增殖能力分析
第1代NSCs(P1)单细胞及培养5d后NSCs在100倍显微镜下观察结果见图6A,第4代NSCs(P1)分别在40和100倍显微镜下观察结果见图6B。WT小鼠细胞克隆大于MU小鼠细胞克隆,尤其以P1细胞最为明显。1000个单细胞统计结果显示: WT小鼠P1细胞最终形成克隆平均数是(38.5±3.6)个,MU小鼠是(22.5±2.3)个,MU小鼠细胞形成克隆数是WT小鼠的58%,差异有统计学意义(P<0.005);WT小鼠P4细胞最终形成克隆平均数是(18.5±1.9)个,MU小鼠是(3.5±0.51)个,MU小鼠细胞形成克隆数是WT小鼠的19%,差异有统计学意义(P<0.001)。
3 讨 论
NSCs不仅存在于胚胎发育期间,而且存在于包括人类在内的所有成体哺乳动物脑中。成体NSCs主要位于侧脑室的SVZ和海马齿状回的SGZ。NSCs的主要功能是维持组织稳态,通过产生大量的新生神经元整合神经回路中。成体神经发生对环境、生理刺激和神经元活性高度敏感。神经发生的减少可能是由NSCs的丢失或某些后续步骤的功能障碍引起的,因此区分这些可能性对于理解神经退行性疾病的原因很重要[7-9]。
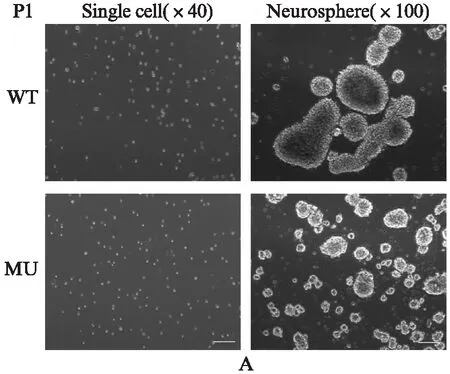
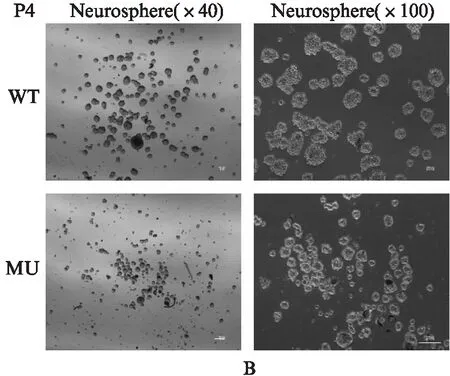
图6 不同基因型小鼠P1和P4 NSCs克隆Fig.6 P1 and P4 neural stem cell cloning in different genotype mouse标尺: 50μm
不同强度的电离辐射会对NSCs造成不同程度的衰老和损伤[10],干细胞对衰老和损伤有不同的反应机制,NSCs对损伤的适当反应是维持体内稳态所必需的[11-12]。DNA双链断裂(DSB)是一种重要的细胞损伤形式,NSCs可通过凋亡、细胞周期停滞或DNA修复应答DSB。DSB的修复对于维持NSCs基因组稳定性及其功能至关重要,主要的修复方式包括NHEJ和同源重组(homologous recombination, HR)[13-14]。胚胎时期的NSCs大部分处于激活状态,成体NSCs主要处于静息状态,因此HR和NHEJ分别对于胚胎和成体NSCS的DSB修复起到重要作用。
NHEJ是修复多细胞真核生物双链断裂的主要途径,其过程首先是Ku70//Ku80异二聚体黏附于断裂的DNA末端,DNA-PKcs和其他酶连接在Ku70//Ku80异二聚体上,然后Ligase Ⅳ和XRCC4形成的复合物被招募到DNA断裂处,催化最终的末端连接反应[15-16]。
既往研究发现,DNA损伤的积累会增加神经系统疾病以及癌症的发生概率,Ligase Ⅳ突变的小鼠更是会增加髓母细胞瘤的形成[17-20],并且其在胚胎时期的神经系统发育不健全[21],说明Ligase Ⅳ对小鼠神经系统的发育起着至关重要的作用。本研究在成体水平探讨Ligase Ⅳ突变对成体神经系统发育的影响。本研究首先发现MU小鼠生命周期短,在个体形态学上MU小鼠体质量在生长发育的各个时期都明显小于WT小鼠,同之前文献[22]报道一致,说明Ligase Ⅳ突变严重影响了小鼠个体发育。此外,本研究发现相对于WT小鼠,MU小鼠雌雄个体间体质量上没有明显差异,其可能的原因是MU小鼠发育缺陷,体质量普遍小,因此在生长过程中雌雄差异不明显。进一步研究Ligase Ⅳ突变对成体神经系统的影响,本研究发现MU小鼠的脑质量明显小于WT小鼠,表明Ligase Ⅳ缺陷同时影响个体和组织器官的发育。体内研究表明,MU小鼠大脑SVZ的NSCs数量及增殖细胞数量都少于WT小鼠;体外研究表明,MU小鼠NSCs的克隆形成能力低于WT小鼠,体内体外实验结果一致。所以MU小鼠脑质量小可能是由NSCs减少和增殖减少引起的。
NHEJ修复途径中Ligase Ⅳ的突变会影响细胞DNA损伤修复。造成的DNA损伤积累使NSCs细胞周期停滞、增殖能力下降、凋亡增加,从而导致成体神经再生能力降低,进而影响个体神经系统的稳态,这说明Ligase Ⅳ突变对小鼠生长及成体神经系统发育起重要作用。由此推测Ligase Ⅳ突变造成干细胞的缺陷在其他组织器官中也会产生重要影响。本研究为成体神经系统发育提供了新的理论基础,成体神经发生的研究对于进一步了解大脑功能、神经性疾病的发病机制以及中枢神经系统的损伤修复等都具有重要的意义。
