Bst DNA聚合酶的纯化及等温扩增检测体系的构建
2019-01-10谭拥军吴莎莎谭桂湘向勤
谭拥军 吴莎莎 谭桂湘 向勤

摘 要:Bst DNA 聚合酶是等温扩增反应中的一个关键酶,但由于专利限制,目前国内实验室所使用的Bst DNA 聚合酶大多需要从国外进口,价格昂贵且长途运输影响酶活性,因此亟需自主生产出Bst DNA 聚合酶应用于等温扩增检测技术. 通过构建Bst Fragement的原核表达质粒,采用原核蛋白表达系统和His-Tag亲和纯化手段,制备成本低,活性高,特异性强的Bst DNA 聚合酶. 同时,针对特定的模板,对自制Bst DNA聚合酶的扩增反应进行了进一步优化,用不同的产物鉴定方法对扩增效果进行检测,并最终筛选出该酶最优的扩增反应条件为60 mM K+、30 mM (NH4)2SO4、pH为 9.0. 最后,验证了Bst DNA聚合酶能用于快速准确检测肺炎支原体、肺炎衣原体,降低了相关病原体核酸检测的成本,为之后核酸检测在基层医疗的更广泛应用提供了条件.
关键词:Bst DNA 聚合酶;重组蛋白;扩增;核酸检测
中图分类号:Q784 文献标志码:A
Purification of Bst DNA Polymerase and
Construction of Isothermal Amplification Detection System
TAN Yongjun?,WU Shasha,TAN Guixiang,XIANG Qin
(College of Biology,Hunan University,Changsha 410082,China)
Abstract:Bst DNA polymerase is a key enzyme in isothermal amplification reaction. However, due to the patent restrictions, most of the Bst DNA polymerase used in domestic laboratories need to be imported abroad, which is expensive and needs long distance transportation. Therefore, it is urgent to produce Bst DNA polymerase for isothermal amplification detection technology independently. From constructing a plasmid containing Bst Fragment, Bst DNA polymerase was prepared on a large scale by prokaryotic expression system followed by His-tag affinity purification method. The purified Bst DNA polymerase possessed the advantages such as low cost, high activity, and strong specificity in the isothermal amplification reaction. The activity of Bst DNA polymerase was optimized for specific DNA templates by detecting the products of amplification. At the same time, the optimal amplification reaction conditions of the enzyme were finally selected,which were 60 mM K+,30 mM(NH4)2SO4,and pH 9.0. With reference to the relevant patents, the obtained Bst DNA polymerase was able to detect mycoplasma pneumonia and Chlamydia pneumonia quickly and accurately through isothermal amplification reactions. In
conclusion, a low cost enzyme was provided for isothermal amplification detection of related pathogen DNA, which can be potentially used in the primary medical care.
Key words:Bst DNA polymerase;recombinant proteins;amplification;nucleic acid detection
近年來,核酸扩增技术[1-2]已广泛应用于涉及民生的传染病的预防与控制、遗传疾病诊断等方面,并逐步渗透到食品与环境微生物的检验检疫、法医鉴定等领域[3-10]. 这种技术常用的PCR(Polymerase Chain Reaction)方法敏感、准确、快速,但由于需要昂贵的仪器设备、较高的检测费用以及对检测人员较高的技术要求而使其不适用于现场快速检测及临床普及应用. 与常规PCR相比,等温扩增技术可摆脱对大型仪器依赖且价格相对低廉,更适合被基层所采用[11].
等温技术自2000年发展至今,已有多种类型的等温扩增方法[12-13],其中以LAMP(Loop-mediated isothermal amplification)最為常见,LAMP技术较其他病原检测方法更敏感、快速、方便,且可通过多种方法使其反应结果可视化[14-16],而更适用于临床,将成为最具潜力的易于普及的病原检测方法. LAMP成功的关键因素之一是DNA聚合酶. 根据氨基酸序列与三维结构的不同,DNA聚合酶可分为6个不同的家族[17-19]. 其中,Bst(Bacillus stearothermophilus)DNA聚合酶是来源于嗜热脂肪芽孢杆菌DNA聚合酶的一部分,具有5′—3′DNA 聚合酶活性,但不具有5′—3′外切核酸酶活性[20]. 与其他DNA 聚合酶相比,Bst DNA 聚合酶有较强的热稳定性、链置换活性及聚合酶活性,因此更适用于等温扩增中. 但是,目前市场上Bst DNA 聚合酶受限于国际性大公司如NEB的专利限制,国内实验室所使用的Bst DNA 聚合酶大多需要从国外进口,其价格昂贵且运输时间长,造成实验成本提高,又极易影响酶活性,所以自主生产出批量的高效、特异性强的Bst DNA 聚合酶对于等温扩增检测技术在国内基层医疗中的应用十分必要. 目前,已有课题组尝试过提取Bst DNA 聚合酶[21],但其批量生产、扩增特异性及扩增体系的建立还需要进一步研究优化.
本实验通过构建Bst大片段的原核表达质粒,使其在大肠杆菌中表达,通过蛋白质提取及纯化手段[22]自主获得Bst DNA 聚合酶,针对特定引物初步优化其扩增反应条件,最终获得Bst DNA聚合酶. 并尝试利用实验室已提取并处理的肺炎支原体、肺炎衣原体DNA,参照已发表的专利方法[23-24],检测Bst DNA聚合酶是否可以用于快速准确检测肺炎支原体和肺炎衣原体.
1 材料和方法
1.1 菌种和材料
DH5ɑ感受态细胞,Rostta(DE3)感受态细胞,Bst Fragement,pET-15b载体质粒,FOXM1 cDNA,293T细胞.
肺炎衣原体DNA来源:通过PCR扩增得到肺炎衣原体基因组保守基因DNA片段,模板来源:湖南圣湘公司赠予的肺炎衣原体ATCC J-21菌株,NCBI Reference Sequence:NC_000922.1,1 501 bp,Chlamydophila pneumoniae CWL029 chromosome complete genome,引物F-CTCTGA GCATAAATCAGAGCCT,R-GGCCGTTTTTCAATGATAAGAGC.
肺炎支原体DNA来源:实验室培养肺炎支原体Mycoplasma pneumoniae M129,通过氯仿抽提法提取基因组DNA.
1.2 主要试剂和仪器
蛋白核酸分析仪,Nano Drop,摇床,细菌恒温培养箱,质粒小提试剂盒,胶回收试剂盒,Nde I,BamH I限制性内切酶,PBS,氨苄青霉素(Amp),氯霉素(Chl),IPTG诱导剂,溶菌酶,His-tag亲和镍珠,1 kb DNA Ladder marker,双色蛋白预染蛋白marker,过硫酸铵(APS),十二烷基磺酸钠(SDS),imidazole,TEMED,Na3PO4,NaCl,Tris,Tryptone,Yeast Extract,Agar,Acrylamide,Bis-acrylamide,Agarose,EB染料,浓盐酸,SYBR Green I染料,考马斯亮蓝G250,His-Tag抗体(小鼠单抗),anti-mouse(鼠二抗).
1%琼脂糖凝胶配制方法:Agarose 2 g、1XTE Buffer 200 mL、EB 9 μL;LB液体培养基配方: Tryptone10 g、 Yeast Extract 5 g、NaCl 10 g,加ddH2O定容至1 L;Binding Buffer配方:20 mM Na3PO4,500 mM NaCl,20 mM imidazole,pH 7.5;Elution Buffer配方:20 mM Na3PO4,500 mM NaCl,300 mM imidazole,pH 为7.5;12% SDS-PAGE分离胶配方:ddH2O 2.31mL、30% Acrylamide 2.8 mL、1.5 M Tris-HCl(pH8.8) 1.75 mL、10%SDS 70 μL、10%APS 70 μL、TEMED 3 μL;SDS-PAGE浓缩胶配方:ddH2O 1 mL、30% Acrylamide 0.5 mL、0.5 M Tris-HCl(pH6.8) 0.38 mL、10%SDS 30 μL、10%APS 30 μL、TEMED 3 μL;考马斯亮蓝染色液配方:考马斯亮蓝G250为0.25 g、甲醇 45 mL、冰醋酸 10 mL、加dd H2O定容至100 mL;考马斯亮蓝脱色液配方:甲醇 125 mL、冰醋酸 40 mL、加ddH2O定容至500 mL;1X Transfer Buffer 配方:甘氨酸 1.45 g、 Tris 2.9 g ,甲醇 100 L,加ddH2O定容至500 mL;TBST配制方法:5M NaCl 溶液 30 mL,1M Tris-HCl(pH8.0) 20 mL,Tween 20 0.5 mL,加ddH2O定容至1 L;封闭液配方:脱脂奶粉2.5 g,加TBST定容至50 mL.
1.3 实验方法
1.3.1 重组质粒 pET-15b-Bst Fragement plasmid的 构建
1)Bst Fragment的获取. 取一支15 mL 的离心管,加入5 mL LB液体培养基(氨苄青霉素浓度为0.1 mg/mL),吸取从公司订购的宿主菌top10菌液5 μL,置于摇床中37 ℃,以220 r/min的转速摇菌14 h,利用质粒小提试剂盒从菌液中提取Bst Fragment所在的原始质粒pUC-SP,利用Nano Drop测定浓度并通过双酶切获得Bst Fragment,酶切体系及反应条件为:pUC-SP(150 ng/mL)6μL,Nde I限制性内切酶1 μL,BamH I限制性内切酶1 μL,10XFast Digest Buffer 2 μL,加ddH2O至总体积20 μL,37 ℃水浴120 min后,1%琼脂糖凝胶电泳30 min,收集目的条带所在胶体并利用胶回收试剂盒获得Bst Fragment;
2)对载体质粒pET-15b进行双酶切. 酶切体系及反应条件为:pET-15b质粒(150 ng/mL)6 μL,Nde I限制性内切酶1 μL,BamH I限制性内切酶1 μL,10XFast Digest Buffer 2 μL,加ddH2O至總体积20 μL,37 ℃水浴120 min后,1%琼脂糖凝胶电泳30 min,收集目的条带所在胶体并利用胶回收试剂盒获得酶切后的pET-15b(Nde I/BamH I);
3)连接Bst Fragment和pET-15b(Nde I/BamH I). 连接体系及反应条件为:pET-15b(Nde I/BamH I)2 μL,Bst Fragement 6 μL,T4 DNA Ligase(5 U/mL)1μL,10 × T4 DNA Ligase buffer 1 μL,加ddH2O至总体积为10 μL,22 ℃连接过夜,备用.
4)连接产物的转化与鉴定. 取一管DH5ɑ感受态细胞(1 001 μL)置于冰上溶解,待感受态完全溶解后,加入3 μL的连接片段,用拇指轻弹混匀,冰上放置30 min,42 ℃水浴锅中热激90 s,冰上放置2 min,加入150 μL LB液体培养基,置于摇床中37 ℃,以220 r/min 的转速摇菌45 min;短暂离心后,涂布LB平板(氨苄青霉素浓度为0.1 mg/mL),倒置于37 ℃培养箱中过夜(12~16 h);次日挑取单菌落,接种到5 mL LB液体培养基中(氨苄青霉素浓度为0.1 mg/mL),置于摇床中37 ℃,以220 r/min的转速摇菌过夜(12~16 h);次日收集菌体提取质粒,用限制性内切酶Nde I,BamH I进行酶切鉴定,测序正确后即获得了重组质粒pET-15b-Bst Fragment plasmid,保存质粒与菌种于-80 ℃冰箱. pET-15b-Bst Fragment plasmid结构示意图(图1(a)).
1.3.2 重组蛋白Bst DNA聚合酶的表达
1)Bst DNA聚合酶的表达. 将表达载体pET-15b-Bst Fragment plasmid转化大肠杆菌Rostta(DE3)感受态细胞,涂布LB平板(氨苄青霉素浓度为0.1 mg/mL、氯霉素浓度为0.1 mg/mL),倒置于37 ℃培养箱中过夜(12~16 h),随机挑选一个单菌落,接种到5 mL的LB液体培养基中(氨苄青霉素浓度为0.1 mg/mL、氯霉素浓度为0.1 mg/mL),置于摇床中37 ℃,以220 r/min的转速摇菌4~6 h,将菌液加到200 mL的LB液体培养基中(氨苄青霉素浓度为0.1 mg/mL、氯霉素浓度为0.1 mg/mL),置于摇床中37 ℃,以220 r/min的转速摇菌过夜(12~16 h),取少量菌液检测OD600值,并调整OD600值至0.8~1,取100 mL菌液加入IPTG诱导剂(终浓度为0.8 mM),剩余100 mL菌液加相同体积的ddH2O,两者均置于摇床中37 ℃,以220 r/min的转速摇菌6 h,以4 000 r/min的转速离心20 min分别收集菌体,用15 mL Binding Buffer(20 mM Na3PO4,500 mM NaCl,20 mM imidazole,pH为 7.5)重悬菌体,超声40 min(超6 s,停9 s)破碎菌体,以8 000 r/min的转速离心10 min,收集上清于50 mL离心管中,两者均取少量用于对照(即分别为诱导前蛋白样品、诱导后蛋白样品),向诱导后蛋白上清中加入50 μLHis-Tag亲和镍珠,置于4 ℃冰箱中旋转孵育3 h,以800 r/min的转速离心5 min,收集镍珠,用PBS洗两次后,加入500 μL Elution Buffer置于4 ℃冰箱中旋转孵育2 h,以800 r/min的转速离心5 min,收集上清,并转移至干净的1.5 mL EP管内,即获得纯化后蛋白样品,样品测定浓度后保存于-80 ℃冰箱;
2)Western Bloting 检测蛋白表达. 将空白Rosseta(DE3)蛋白裂解液和导入了Pet-15b-Bst Fragement plasmid的Rosseta(DE3)蛋白裂解液分别取等量进行高温变性处理后进行SDS-PAGE凝胶电泳,电压为80 V,电泳30 min后调节电压至120 V,电泳90 min,100 V恒压下转膜1 h,然后在将PDVF膜放入适量封闭液中,确保封闭液可以充分覆盖PDVF膜,置于水平摇床上室温孵育2 h,由于重组蛋白带上了His-tag,所以SDS-PAGE电泳结束后,用TBST洗膜3次(每次5 min)后,用Anti-His抗体(1 ∶ 1 000)室温孵育2 h,用TBST洗膜3次(每次5 min)后,用Anti-mouse抗体(1 ∶ 2 000)室温孵育2 h,洗膜后进行曝光检测,观察条带位置.
3)考马斯亮蓝染色检测纯化效果. 将诱导前蛋
白样品、诱导后蛋白样品及纯化后蛋白样品分别测定浓度后,取等量蛋白量进行高温变性处理后进行SDS-PAGE凝胶电泳,先电泳80 V,30 min后调节电压至120 V,电泳90 min,切下胶体放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶,置于水平摇床上室温孵育2 h,至胶体完全染成蓝色,然后将胶体放入脱色液中,确保脱色液可以充分覆盖凝胶,置于水平摇床上室温孵育,期间更换脱色液2~4次,直至完全脱去蓝色背景颜色,结束后参照Marker观察蛋白条带位置及亮度,以判断诱导效果、纯化后蛋白的大小及浓度是否达到预期.
1.3.3 重组蛋白Bst DNA聚合酶的纯化
根据上述确认的菌液进行扩大培养,取菌液加入4瓶500 mL的LB液体培养基中,每瓶加入50 μL菌液,置于摇床中37 ℃,以220 r/min的转速摇菌过夜(12~16 h),取菌液检测OD600值,调整OD600值至0.8~1,加入IPTG诱导剂(终浓度0.8 mM),置于摇床中37 ℃,以220 r/min的转速摇菌6 h,以4 000 r/min的转速,离心20 min收集菌体(分4个50 mL离心管进行离心),每管加入30 mL Binding Buffer(20mM Na3PO4,500 mM NaCl,20 mM imidazole,pH 为7.5)重悬菌体,超声40 min(超6 s,停9 s)破碎菌体,以8 000 r/min的转速离心10 min,收集上清于50 mL离心管中,向上清中加入100 μLHis-Tag亲和镍珠,置于4 ℃冰箱中旋转孵育3 h,以800 r/min的转速,离心5 min收集镍珠,镍珠用PBS洗两次后,加入1mL Elution Buffer后置于4 ℃冰箱中旋转孵育2 h,以800 r/min的转速,离心5 min收集上清,转移至干净的1.5 mL EP管内,即获得纯化后蛋白样品,样品测定浓度后小管分装保存于-80 ℃冰箱;
1.3.4 重组蛋白Bst DNA聚合酶的活性鉴定
1)重组蛋白Bst DNA聚合酶等温扩增活性鉴定. 取4个PCR管,编号1~4,按照表2所示体系依次向每管中加入各成分,再按照表3中的实验设置向各组中加入余下的成分,其中内外引物对序列如表1所示. FOXM1 CDNA浓度为200 pg/μL,每管取1μL,用ddH2O补齐至反应体系总体积为20 μL,充分混匀各管,将1~4号管同时置于65 ℃水浴50 min后,80 ℃水浴2 min终止反应. 取每管反应产物10 μL进行1.5%琼脂糖凝胶电泳,将胶体置于紫外光下观察并拍照;剩余反应产物加入2 μL SYBR Green I染料,混匀并短暂离心,在紫外光照射下观察每管颜色,以此判定是否扩增成功.
2)重组蛋白Bst DNA聚合酶等温扩增条件初步优化. 根据对有关等温扩增反应体系的文献及研究,总结得出影响等温扩增效果的几个关键因素及范围,据此分别设置K+浓度梯度,(NH4)2SO4浓度梯度,不同pH值条件来检验自制Bst DNA聚合酶的扩增效果,以达到优化Bst DNA聚合酶反应体系的目的. 除设置的各个不同成分梯度外,其他体系成分及实验条件均与1.3.4节中1)的描述保持一致,利用1.5%琼脂糖凝胶电泳检测扩增产物.
1.3.5 重组蛋白Bst DNA聚合酶检测特定病原体
1)检测肺炎支原体. 参考肺炎支原体与肺炎衣
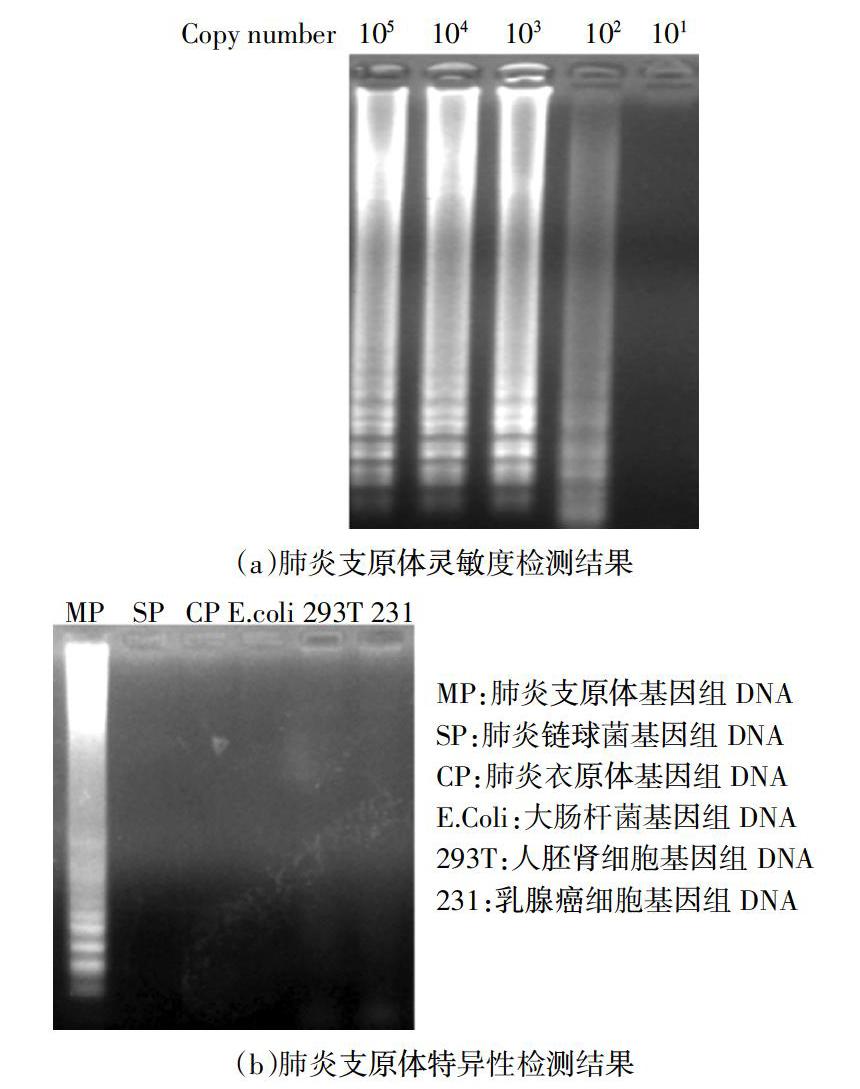
原体的相关检测专利[23-24],将实验室已有肺炎支原体基因组DNA按10倍递增稀释105、104、103、102、10 copies/μL 5个梯度. 取稀释后的基因组DNA各1 μL,及表4中对应的内外引物对,按表2设计的LAMP扩增反应体系进行混合,最后加入Bst DNA聚合酶,将反应混合物分别置于65 ℃水浴50 min后,80 ℃水浴2 min终止反应. 取5 μL LAMP产物在1%琼脂糖凝胶中进行电泳检测,将实验室保存的几种不同病原体的基因组DNA分别稀释到105 copies/μL,各取1 μL,加入扩增肺炎支原体DNA的内外引物对,按表2设计的LAMP扩增反应体系进行混合,最后加入Bst DNA聚合酶,将反应混合物分别置于65 ℃水浴50 min后,80 ℃水浴2 min终止反应. 取5 μL LAMP产物在1%琼脂糖凝胶中进行电泳检测.
2)检测肺炎衣原体. 按上述同样的方法检测肺炎衣原体,只需将模板和引物更换成表5中肺炎衣原体基因组DNA和对应的内外引物对.
2 结 果
2.1 重组质粒pET-15b-Bst Fragment plasmid的構建
按照1.3.1节所描述的实验步骤进行实验,1%琼脂糖凝胶电泳分析结果显示,上端条带位于2 500 bp与3 000 bp之间,与pUC-SP载体大小相符,下端条带位于1 500 bp与2 000 bp之间,与Bst Fragment大小吻合,如图1(b)所示,1、2号样品(为重复实验)均符合结果. 重组质粒pET-15b-Bst Fragment plasmid经Nde I,BamH I限制性内切酶处理,电泳结果显示,上端条带位于4 000 bp与6 000 bp之间,与pET-15b载体大小相符,下端条带位于1 500 bp与2 000 bp之间,与Bst Fragment大小吻合,如图1(c)所示,1~4号样品(为重复实验)均符合结果,测序结果显示送检序列与Bst Fragement序列比对结果完全重合,综上表明重组质粒pET-15b-Bst Fragment plasmid构建成功.
2.2 重組蛋白Bst DNA聚合酶的表达与纯化
按照1.3.2节中2)的实验设置与方法步骤,将重组质粒pET-15b-Bst Fragment plasmid转入感受态大肠杆菌Rostta(DE3)中进行蛋白表达后,用Western Bloting 方法检测重组蛋白是否正确表达. 如图2(a)所示(样品1:导入了pET-15b-Bst Fragement plasmid的Rosseta(DE3)蛋白裂解液;样品2:空白Rosseta(DE3)蛋白裂解液),样品1出现清晰条带,而样品2无条带,且条带大小与Bst DNA聚合酶大小相符,再结合之前的测序结果,可以确定重组蛋白表达正确.
按照1.3.2节中3)的实验步骤,将重组质粒pET-15b-Bst Fragment plasmid转入感受态大肠杆菌Rostta(DE3)中进行蛋白表达、诱导,提取并纯化Bst DNA聚合酶,优化纯化条件,最终确定纯化方案,考马斯亮蓝染色确定蛋白条带的位置及纯化效果. 如图2(b)所示(Lane1:Marker;Lane2:not-induced sample;Lane3: induced sample;Lane4:Purified sample 1;Lane5:Purified sample 2;蛋白上样量均为10 μg),考染后SDS-PAGE电泳结果显示,纯化后的目的蛋白位于50 kD与70 kD之间,与重组蛋白Bst DNA聚合酶的大小(约为67 kD)相符,综上表明所得的纯化后蛋白为Bst DNA聚合酶,之后按照1.3.3节中的实验步骤进行Bst DNA聚合酶的纯化.
2.3 重组蛋白Bst DNA聚合酶的活性鉴定
按照1.3.4节中1)的实验方法进行实验检验重组蛋白Bst DNA聚合酶等温扩增活性. 实验结果分别如图3所示,1、2为阴性扩增,3、4为阳性扩增,表明纯化后的Bst DNA聚合酶具备等温扩增活性.
按照1.3.4节中2)的实验步骤初步优化扩增条件,以提高自制Bst DNA聚合酶用于等温扩增反应的稳定性和特异性. 结果如图4所示,在60 mM K+、30 mM (NH4)2SO4、pH值为9.0的条件下,自制的Bst DNA 聚合酶的扩增活性最优.
2.4 重组蛋白Bst DNA聚合酶检测病原体
利用实验室已获得的肺炎支原体和肺炎衣原体DNA样本,并利用荧光定量PCR计算出拷贝数,参照相关专利[23-24],检测Bst DNA聚合酶是否能用于快速准确检测肺炎支原体、肺炎衣原体. 按照1.3.5节中的实验方法,图5(a)(c)显示,两种病原体均在102 copies时就可以用Bst DNA聚合酶扩增成功,表明Bst DNA聚合酶检测到能在低浓度的病原体,具有良好的灵敏度;图5(b)(d)显示,在引物一致且特异性好的条件下,只有加入与引物相匹配的的病原体DNA才会出现阳性扩增结果,当病原体与体系设置的引物不匹配时则不会出现阳性扩增结果,表明利用Bst DNA聚合酶能够在病原体拷贝数相对较低(105 copies)的情况下特异性地检测出病原体DNA,降低了假阳性的风险,表明Bst DNA聚合酶具有良好的特异性.
3 结 论
等温扩增技术经过近20年的发展,已经日趋成熟,由于其设备简单、操作方便、结果可视等优点正广泛应用于医学检测、病原微生物的检验检疫,食品检疫等各个领域. Bst DNA 聚合酶有着较强的热稳定性、链置换活性及聚合酶活性,是等温扩增技术中的一个关键工具酶,但由于专利限制,导致其价格偏高,不利于开展广泛科研与实际应用. 本实验成功构建了Bst Fragment的原核表达质粒,并利用原核蛋白表达系统和His-Tag亲和纯化手段,获得了成本低,活性高,特异性强的Bst DNA 聚合酶. 下一步实验将尝试其他纯化手段,以进一步提高Bst DNA 聚合酶的纯度.
肺炎衣原体肺炎、肺炎支原体肺炎的临床症状及X线表现均无特异性,难以和其他非典型肺炎相区别,故其确诊有赖于实验室诊断. 实验室检测方法有很多,包括直接涂片和培养法、免疫荧光直接抗原检测法、补体结合抗体检测、核酸扩增检测法和血清检测法等,本实验利用实验室已提取并处理的肺炎支原体、肺炎衣原体DNA,利用已发表的专利方法,验证了Bst DNA聚合酶可以用于快速准确检测肺炎支原体、肺炎衣原体,且灵敏度和特异性俱佳,为肺炎支原体、肺炎衣原体的基层临床检测降低了成本,同时也为等温核酸检测技术在基层医疗领域的进一步应用提供了可能性.
参考文献
[1] COMPTON J. Nucleic acid sequence-based amplification[J]. Nature,1991 (350):91—92.
[2] MWENDWA F,MBAE C K ,KINYUA J,et al. Stem loop-mediated isothermal amplification test:comparative analysis with classical LAMP and PCR in detection of Entamoeba histolytica in Kenya [J]. BMC Research Notes,2017,10(1):142.
[3] MASAKI IMAI A,AI NINOMIYA A,HAUMI MINEKAWA B. Development of H5-RT-LAMP (loop-mediated isothermal amplification) system for rapid diagnosis of H5 avian influenza virus infection [J]. Vaccine,2006 (24):6679—6682.
[4] CURTIS K A,RUDOLPH D L,OWEN S MDONNA L. Rapid detection of HIV-1 by reverse-transcription,loop-mediated isothermal amplification (RT-LAMP) [J]. Journal of Virological Methods,2008,151(2):264—270.
[5] ZENG D D,YE W W,XU M,et al. Rapid diagnosis of soybean root rot caused by fusarium culmorum using a loop-mediated isothermal amplification assay [J]. Journal of Phytopathology,2017,165(249):249—256.
[6] TECHATHUVANAN C,D'SOUZA D H. Reverse-transcriptase loop-mediated isothermal amplification as a rapid screening/monitoring tool for salmonella enterica detection in liquid whole eggs [J]. Journal of Food Science,2012,77(4):M200—M205.
[7] YU Y,MA X Y,ZHANG W. Detection of Staphylococcus aureus in milk using real-time fluorescence loop-mediated isothermal amplification [J]. Advance Journal of Food Science and Technology,2015,8(9):678—684.
[8] MASHOOQ M,KUMAR D,NIRANJAN A K,et al. Development and evaluation of probe based real time loop mediated isothermal amplification for Salmonella:a new tool for DNA quantification [J]. Journal of Microbiological Methods,2016,126:24—29.
[9] CHEN Z Q,ZHANG K,YIN H,et al. Detection of Salmonella and several common Salmonella serotypes in food by loop-mediated isothermal amplification method[J]. Food Science and Human Wellness,2015,4(2):75—79.
[10] RAVAN H,AMANDADI M,SANADGOL N. A highly specific and sensitive loop-mediated isothermal amplification method for the detection of Escherichia coli O157:H7[J]. Microbial Pathogenesis,2016,91:161—165.
[11] OLONINI I K O,KUROSAKI Y,MIYAMOTO H,et al. Rapid detection of all known ebolavirus species by reverse transcription-loop-mediated isothermal amplification (RT-LAMP) [J]. Journal of Virological Methods,2017,246:8—14.
[12] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al. Loop-mediated isothermal amplification of DNA [J]. Nucleic Acids Research, 2000,28 (12),e63.
[13] NAGAMINE K,WATANABE K,OHTSUKA K,et al. Loop-mediated isothermal amplification reaction using a nondenatured template [J]. Clinical Chemistry,2001,47 (9):1742—1743.
[14] YASHUYOSHI M,KENTARO N,NORIHIRI T. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation [J]. Biochemical and Biophysical Research Communications,2001,289 (1):150—154.
[15] LEE D,SHIN Y,CHUNG S,et al. Simple and highly sensitive molecμlar diagnosis of zika virus by lateral flow Assays [J]. Analytical Chemistry,2016,88(24):122—124.
[16] TEGEGNE B,GETIE S,LEMMA W,et al. Performance of loop-mediated isothermal amplification (LAMP) for the diagnosis of malaria among malaria suspected pregnant women in Northwest Ethiopia [J]. Malaria Journal,2017,16(1):34.
[17] OSCORBIN I P,BOYARSKIKH U A,FILIPENKO M L. Large fragment of DNA polymerase I from geobacillus sp. 777:cloning and comparison with DNA polymerases I in practical applications [J]. MolecμLar Biotechnology,2015,57(10):947—959.
[18] MCCLARY J,YE S Y,HONG G F,et al. Sequencing with the large fragment of DNA polymerase I from Bacillus stearothermophilus [J].DNA Sequence :the Journal of DNA Sequencing and Mapping,1991,1(3):173—180.
[19] 向义和. DNA聚合酶Ⅰ的功能与结构的发现[J].自然杂志,2011,33(6):346—354.
XIANG Y H. Discovery of function and structure of DNA Polymerase I [J]. History of Natural Science,2011,33(6):346—354. (In Chinese)
[20] MEAD D A,MCCLARY J A,LUCKEY J A,et al. Bst DNA polymerase permits rapid sequence analysis from nanogram amounts of template [J]. Biotechniques,1991,11(1):76—78.
[21] 黄维华,翟峰,洪国藩. Bst DNA聚合酶大片段的克隆、表达、性质及其应用[J].生物化学与生物物理学报,1999,31(4):379—384.
HUANG W H,ZAI F,HONG G F. Cloning,expression,properties and application of large fragments of Bst DNA polymerase [J].Journal of Biochemistry and Biophysics,1999,31(4):379—384. (In Chinese)
[22] 譚拥军,余景卫,陈燕,等. R9-FOXM1(1-234aa)重组蛋白批量纯化及其抑瘤效应研究[J].湖南大学学报 (自然科学版),2017,44(12):116—120.
TAN Y J,YU J W,CHEN Y,et al. Batch purification of R9-FOXM1(1-234aa) recombinant protein and its antitumor effect [J]. Journal of Hunan University (Natural Sciences),2017,44(12):116—120. (In Chinese)
[23] 袁静,柏长青,苑鑫,等. 用于检测肺炎支原体的LAMP试剂盒及其专用引物[P].中国:105238860,2016-01-13.
YUAN J,BO C Q,YUAN X,et al. LAMP kit for detecting mycoplasma pneumoniae and special primer [P].China:105238860,2016-01—13. (In Chinese)
[24] 孙宜峰,于丹,曾冰冰. 环介导恒温扩增检测肺炎衣原体的方法及检测试剂盒[P].中国:101886122,2010-11-17.
SUN Y F,YU D,ZENG B B. Method for detecting chlamydia pneumoniae by loop-mediated isothermal amplification and detection kit [P]. China:101886122,2010-11-17. (In Chinese)
