H2O2/FeCl3在缺电子类烯烃自由基聚合中的应用研究
2019-01-10邓剑如钟隆庞爱民唐根崔敏
邓剑如 钟隆 庞爱民 唐根 崔敏

摘 要:介绍了一种用于缺电子类烯烃自由基聚合的引发体系,此引发体系使用H2O2和FeCl3两种经济、环保的原料,实现了丙烯酸、甲基丙烯酸等水溶性单体在水中的自由基聚合,同时实现了丙烯腈在水中的连续水相沉淀聚合及在DMSO、DMF中的自由基聚合. 结果表明,该引发体系在较低的引发剂浓度和较低的反应温度(30 ~ 60℃)下,合成的聚丙烯酸钠分子量在1.0 × 106 ~ 2.0 × 106之间,聚甲基丙烯酸钠分子量在1.0 × 105 ~ 1.7 × 105之间,且均具有较低的分子量分布(Mw /Mn = 1.1 ~ 1.4)和较好的转化率(>90%);合成的聚丙烯腈分子量在2.0 × 104 ~ 8.0 × 104之间,转化率最高可达94.1%.
关键词:自由基聚合;缺电子类烯烃;环保;引发剂
中图分类号:TQ316.33 文献标志码:A
Research on Application of H2O2 /FeCl3 in the Free
Radical Polymerization of Electron-Deficient Olefin
DENG Jianru?,ZHONG Long,PANG Aimin,TANG Gen,CUI Min
(College of Chemistry and Chemical Engineering,Hunan University,Changsha 410082,China)
Abstract:This study introduces an initiator system applied in the free radical polymerization of electron-deficient olefin,which uses two kinds of economic and environmental benign raw materials,namely H2O2 and FeCl3,and successfully realizes the free radical polymerization of water-soluble monomer like acrylic acid and methacrylic acid in water. Meanwhile,it also realizes the continuous aqueous precipitation polymerization of acrylonitrile in water and free radical polymerization in DMSO and DMF. The results indicate that at a relatively low initiator concentration and low reaction temperature (30~60 ℃),the molecular weight of sodium polyacrylate synthesized by the initiator system ranges between 1.0×106 and 2.0×106,while the molecular weight of sodium polymethacrylate ranges between 1.0×105 and 1.7×105,featuring low molecular weight distribution(Mw /Mn =1.1~1.4) and high conversion(>90%);the molecular weight of polyacrylonitrile ranges between 2.0×104 and 8.0×104,and the conversion is as high as 94.1%.
Key words:free radical polymerization;electron-deficient olefin;environmental protection;initiator
自由基聚合操作简单,单体适用面广,聚合条件温和,几乎适用于所有的聚合实施方法[1-3],并在高分子功能材料、医药和生物工程等领域得到广泛应用[4-8]. 尽管自由基聚合具有良好的应用价值,但
其在分子量及其分布和聚合物结构控制上仍存在局限性[1]. 因此,开发一种工艺简单、绿色环保的自由基聚合新方法,成为高分子合成领域的一大热點.
Matyjaszewski等[9]相继报道了一种以有机卤化物(R-X)为引发剂,低价态过渡金属化合物(如CuCl、FeCl2等)和适当的配位剂为催化体系,通过氧化还原反应来进行活性/可控自由基聚合的方法称为原子转移自由基聚合(ATRP)[9-11],ATRP法可用于合成嵌段、接枝、超支化以及端基功能化等多种聚合物[12-15]. 但由于低价态过渡金属毒性较大,容易受到氧气和水的影响,产物分离较困难,因此在工业生产中仍受到一定的限制[16-18]. 针对这一问题,Wang等[19]采用传统自由基引发剂(如偶氮二异丁腈AIBN)和高价态过渡金属化合物(如CuCl2)在联吡啶作配体来引发单体进行原子转移自由基聚合,此方法称为反向原子转移自由基聚合. 反向原子转移自由基聚合以更价廉易得的传统自由基聚合引发剂代替有机卤代物,以更稳定安全的高价态过渡金属卤化物代替对环境敏感的低价态过渡金属,较之ATRP法具有更大的工业应用价值[20-22]. 近年来,这两种方法广泛应用于苯乙烯[23-24]、丙烯酸羟乙酯[25]、甲基丙烯酸羟乙酯[26]、丙烯酸缩水甘油酯[27]等单体的聚合中,但由于常规的ATRP与反向ATRP法通常需要引入价格昂贵的配体以及大量的易挥发有机溶剂,聚合温度较高,过渡金属也难以脱除,聚合反应条件苛刻,极大地限制了其在工业化生产中的应用.
据此,本文首次将H2O2 /FeCl3应用于缺电子类烯烃的自由基聚合中,该体系无需使用价格昂贵的配体和易挥发有机溶剂,且以水为反应介质,利用链增长过程中Fe3+-Fe2+的双向可逆循环再生,就可以实现H2O2 /FeCl3间的持续氧化还原,从而引发丙烯腈、丙烯酸等单体在水溶液中的自由基聚合. 该方法制备工艺简单、绿色环保,是一种适用于工业化生产的新型自由基聚合方法.
1 实验部分
1.1 原料
丙烯腈(AN),丙烯酸(AA),甲基丙烯酸(MAA),分析纯(阿拉丁试剂有限公司),双氧水(30%,Adamas公司),FeCl3·6H2O,FeBr3,CuCl2,NaOH,乙酸乙酯,甲苯,盐酸,DMF,DMSO,分析纯(国药集团试剂有限公司),去离子水.
1.2 丙烯腈在水中的连续沉淀聚合
在500 mL三口烧瓶中,加入26.50 g(0.500 mol)丙烯腈、0.54 g (0.002 mol)FeCl3·6H2O及75 mL H2O,搅拌至混合均匀;以2.0 mL/min的速度滴加25 g过氧化氢-水溶液(质量分数为3.4%,0.025 mol),直至滴加完毕,60 ℃下反应1 h;反应过程中,反应液逐渐浑浊最终出现固体悬浮物;反应液过滤得到粗产物,用去离子水洗涤3次,干燥得到24.94 g白色粉末,产率为94.1%.
1.3 丙烯腈在DMSO中的聚合
在500 mL三口烧瓶中,加入26.50 g(0.500 mol)丙烯腈、0.27 g (0.001 mol)FeCl3·6H2O及75 mL DMSO,搅拌至混合均匀;以2.0 mL/min的速度滴加25 g过氧化氢-DMSO溶液(质量分数为4.1%,0.030 mol),直至滴加完成,60 ℃下反应1 h;反应液加水沉淀,过滤得到粗产物,用去离子水洗涤3次,干燥得到21.25 g白色粉末,产率为80.2%.
1.4 丙烯腈在DMF中的聚合
在500 mL三口烧瓶中,加入26.50 g(0.500 mol)丙烯腈、0.54 g(0.002 mol) FeCl3·6H2O及75 mL DMF,搅拌至混合均匀;以2.0 mL/min的速度滴加25 g过氧化氢-DMF溶液(质量分数为3.4%,0.025 mol),直至滴加完成,60 ℃下反应1 h;反应液加水沉淀,过滤得到粗产物,用去离子水洗涤3次,干燥得到22.42 g白色粉末,产率为84.6%.
1.5 丙烯酸在水中的自由基聚合
在500 mL三口烧瓶中,加入28.80 g(0.400 mol)丙烯酸、0.27 g (0.001 mol)FeCl3· 6H2O及75 mL去离子水,搅拌至混合均匀;以2.0 mL/min的速度滴加25 g过氧化氢-水溶液(质量分数为4.1%,0.030 mol),直至滴加完成,45 ℃下反应24 h;反应液加甲苯萃取后取下层水相清液,加NaOH中和至pH为9~10,过滤除去Fe(OH)3和Fe(OH)2沉淀,将滤液烘干后得到23.12 g聚丙烯酸钠,产率为61.5%,聚丙烯酸钠计量酸化、烘干后可得聚丙烯酸.
1.6 甲基丙烯酸在水中的自由基聚合
在500 mL三口烧瓶中,加入30.10 g(0.350 mol)甲基丙烯酸、0.27 g(0.001 mol) FeCl3· 6H2O及75 mL去离子水,搅拌至混合均匀;以2.0 mL/min的速度滴加25 g过氧化氢-水溶液(质量分数为4.1%,0.030 mol),直至滴加完成,45 ℃下反应24 h;反应液取出后在乙酸乙酯中沉淀、静置、过滤,干燥后加NaOH溶液中和至pH为9~10,过滤除去Fe(OH)3和Fe(OH)2沉淀,将滤液烘干后得到29.64 g聚甲基丙烯酸钠,产率为78.4%,聚甲基丙烯酸钠计量酸化、烘干后可得聚甲基丙烯酸. 1H-NMR(400 MHz,D2O ):δ (ppm) = 0.76(s,2H,—CH2),1.51(s,2H,—CH2).
1.7 核磁共振测试(NMR)
在Bruker Avance-III 400仪器(1H-NMR为400 MHz)下记录1H-NMR谱图. 化学位移以ppm(δ)表示,以氘代二甲基亚砜( DMSO-d6) 为溶剂测试聚丙烯腈的1H-NMR谱,以氘代水(D2O)为溶剂测试聚甲基丙烯酸钠的1H-NMR谱,四甲基硅烷( TMS) 为内标.
1.8 凝胶渗透色谱(GPC)
使用Agilent-1260 Infinity仪器测定聚丙烯酸钠/聚甲基丙烯酸钠的分子量及分子量分布,流动相为Na2HPO4水溶液,柱温为25 ℃,流速为0.8 mL/min,色谱柱为SB-802.5HQ,SB-804HQ,标样为PEO. 使用Water 1515仪器测定聚丙烯腈分子量及分子量分布,流动相为DMF,柱温为35 ℃,流速为
1 mL/min,色谱柱为WAT054466、 WAT044226、WAT044223,标样为PS.
2 结果与讨论
2.1 H2O2/FeCl3引发丙烯腈在水中的聚合
H2O2可与Fe2+构成氧化还原引发体系直接引发丙烯腈的聚合,其氧化还原引发机理如图1所示,该引发体系在5 ℃下仍有较高的聚合速率.
为了得到结构清晰、分子量较低的聚合物,本课题组曾欲在H2O2 /亚铁盐引发体系中引入FeCl3作为链转移剂,利用FeCl3的高阻聚效率调控聚合物的结构和分子量. 在实验过程中发现,当体系中Fe2+含量为0(即引发体系中只有H2O2與FeCl3)时,聚合反应反而具有更高的活性,可得到结构更为清晰的聚合物,这说明H2O2与FeCl3间也可构成引发体系并产生活性自由基,我们将这种新的引发体系(H2O2 /FeCl3)应用于丙烯腈的自由基聚合,经过进一步的实验及表征,得到如图2所示的反应机理,其中式(1)(2)为基本的芬顿反应[28].
FeCl3可将H2O2氧化成HO2·,同时生成FeCl2,体系中生成的FeCl2又可与H2O2构成新的氧化还原体系产生HO·,HO·首先加成到丙烯腈中生成羟基丙烯腈自由基,链增长到一定程度后,FeCl3上的一个氯原子与聚丙烯腈自由基结合终止聚合,同时FeCl3被还原成FeCl2. FeCl2又会被H2O2重新氧化成FeCl3并生成OH-和一个新的HO·继续引发丙烯腈的聚合. 只需在反应体系中加入极少量的FeCl3,利用Fe3+-Fe2+的双向可逆循环再生,即可实现反应体系中的持续氧化还原引发,得到结构清晰可控且具有较高转化率的端羟基聚丙烯腈.
图3为H2O2 /FeCl3引发体系引发丙烯腈聚合所得到的端羟基聚丙烯腈的1H-NMR谱图,丙烯腈的转化率为94.1%. 图中信号a对应与羟基相连的亚甲基上的质子,信号b对应主链上靠近氰基的质子,信号c对应主链上远离氰基的质子,信号d对应靠近端基氯上的质子,其受到氯原子和氰基的吸电子作用影响向低场移动,从而偏离其它亚甲基质子的吸收峰. 从1H-NMR谱图的分析可知,合成的聚丙烯腈中有端羟基和端基氯的存在,进一步验证了图2的反应机理,说明聚合反应受到H2O2和FeCl3的共同作用.
2.1.1 时间、温度对丙烯腈聚合的影响
图4为60 ℃时丙烯腈转化率随时间的变化曲线. 从图中可以看出,当[AN]0 /[FeCl3·6H2O]0/[H2O2]0的比例从100/0.2/10变化到100/1/10时,丙烯腈转化率(转化率=聚合物质量/单体总质量×100%)在经过快速增长后均在60 min内趋于平缓并达到最高值,单体转化率均在92%以上,说明此聚合体系具有较高的工业利用价值. 图5为不同温度下丙烯腈反应60 min后的转化率变化曲线. 从图中可以看出,当反应温度为60 ℃时,丙烯腈转化率最高,这主要是因为温度较低时,H2O2 /FeCl3的反应活性较低无法快速生成足够的Fe2+用于与H2O2反应生成羟基自由基;温度较高时,生成的过量Fe2+又将进一步与羟基自由基反应,使自由基活性消失,从而影响聚合反应速率.
2.1.2 FeCl3·6H2O、H2O2用量对丙烯腈聚合的影响
图6、图7为60 ℃时聚丙烯腈分子量、单体转化率随FeCl3·6H2O、H2O2用量变化曲线. 图6聚合条件为:T = 60 ℃,反应时间t = 60 min,[AN]0 /[FeCl3·6H2O]0 /[H2O2]0 = 100/[FeCl3·6H2O]/10;图7聚合条件为:T = 60 ℃,反应时间t = 60 min,[AN]0 /[FeCl3·6H2O]0 /[H2O2]0 = 100/0.4/[H2O2]. 从图中可以看出,随着FeCl3·6H2O和H2O2用量增加,聚丙烯腈分子量均逐渐降低,转化率在[AN]0/[FeCl3·6H2O]0 /[H2O2]0比例为100/0.4/10时达到最大值. 这主要是因为FeCl3·6H2O在体系中除了通过Fe3+ - Fe2+的双向可逆循环再生为反应体系提供初始自由基外,在丙烯腈的聚合过程中还起到链终止的作用,利用FeCl3的高阻聚效率可1 ∶ 1的消灭自由基从而达到控制分子量的作用. 在其它条件一定时,H2O2用量的增加提高了初始自由基的生成速率,进而降低了聚丙烯腈的分子量.
表1为不同条件下丙烯腈聚合结果. 从表中可以看出,以H2O2 /FeCl3为引发体系,反应温度、[AN]0/[FeCl3·6H2O]0 /[H2O2]0的比例对单体转化率、聚丙烯腈的分子量及分子量分布都有一定的影响,FeCl3·6H2O和H2O2用量的增加都会显著降低聚合物的分子量,FeCl3·6H2O用量的变化对聚丙烯腈分子量分布影响较大,FeCl3·6H2O含量过低或过高都会导致聚丙烯腈分子量分布变宽. 这主要是由于FeCl3·6H2O含量过低时,当链增长到一定程度时过少的FeCl3不足以完全终止聚合,增加了其它链转移、链终止副反应发生的可能;FeCl3·6H2O含量过高时,一方面FeCl3会与H2O2反应生成更多的羟基自由基,增加了聚丙烯腈活性中心偶合终止、歧化终止的可能,导致聚丙烯腈分子量分布变宽;另一方面,过多的FeCl3生成的过量Fe2+又将进一步与羟基自由基反应使自由基失活,从而影响聚合反应速率.
单独使用H2O2或FeCl3时,如实验1、6,均没有产物产生,说明聚合需要H2O2和FeCl3的共同参与. 实验9、10为使用FeBr3、 CuCl2代替FeCl3引发丙烯腈在水中的自由基聚合的结果. 使用类似的高价态过渡金属Cu2+代替Fe3+、卤素原子Br代替Cl进行聚合,发现两者都可与H2O2作用引发丙烯腈的聚合,且均具有较高的转化率;但CuCl2对环境污染较大,FeBr3性质不稳定,因此本文选用更为绿色环保的FeCl3作为丙烯腈连续水相沉淀聚合的链转移引发剂. 实验11、12为H2O2 /FeCl3引发体系引发丙烯腈分别在DMSO、DMF中聚合的结果. 改变溶剂体系后,丙烯腈的聚合由连续沉淀聚合变为均相溶液聚合,反应条件更为温和,转化率虽有所降低但分子量分布变窄,仍然具有较大的工业价值.
2.2 H2O2/FeCl3引发丙烯酸类单体在水中的自由基 聚合
H2O2 /FeCl3引发体系在丙烯腈的聚合中得到应用后,本文尝试采用其他单体进行聚合以探索更多的可能性. FeCl3常用于原子转移自由基聚合中,其通过与有机化合物(如联吡啶、有机酸、离子液体等)形成配合物使体系具有更高反应活性,但配体以及易挥发有机溶剂的引入增加了聚合难度,限制了其在工业化生产中的应用. 本文将H2O2 /FeCl3引发体系应用于丙烯酸類单体在水中的自由基聚合中,丙烯酸、甲基丙烯酸在体系中既可作为单体进行链增长,还与FeCl3具有较好的络合作用,可形成用于原子转移自由基聚合的催化体系,通过建立活性种与休眠种之间的动态平衡,降低自由基浓度,进而实现对聚合过程的控制. 图8为H2O2 /FeCl3引发丙烯酸类单体在水中的自由基聚合机理.
2.2.1 不同单体用量对聚丙烯酸(钠)分子量及转化
率的影响
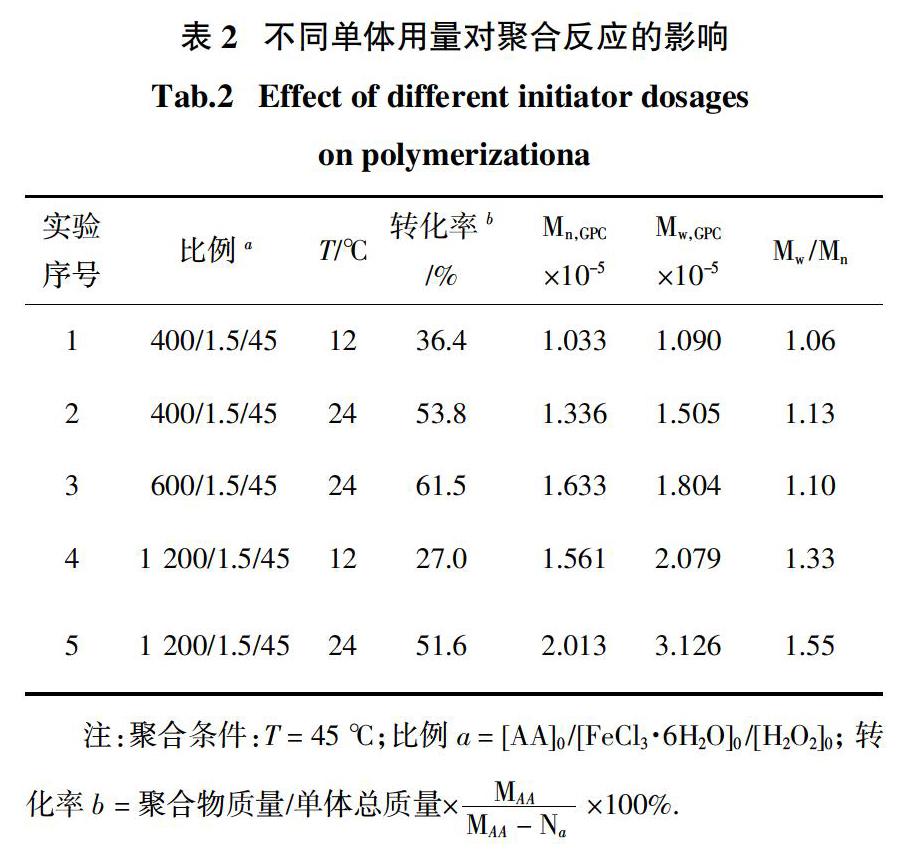
通过采用不同比例的丙烯酸单体,考察聚合物分子量、转化率及分子量分布的变化,结果如表2所示.
从表2可以看出,在丙烯酸的聚合过程中,实验1、2号对比,聚合时间增加,产物分子量增大;2、3、5号对比,随着[AA]0 /[FeCl3·6H2O]0的比例由400/1.5增加至1 200/1.5,所得聚合物的分子量逐渐增大,但分子量分布变宽,这主要是因为随着单体浓度的增加,体系产生自由基的相对含量变少,体系可控性变差,从而影响了聚合物的分子量分布.
2.2.2 不同链转移引发剂用量对聚甲基丙烯酸(钠)
分子量及转化率的影响
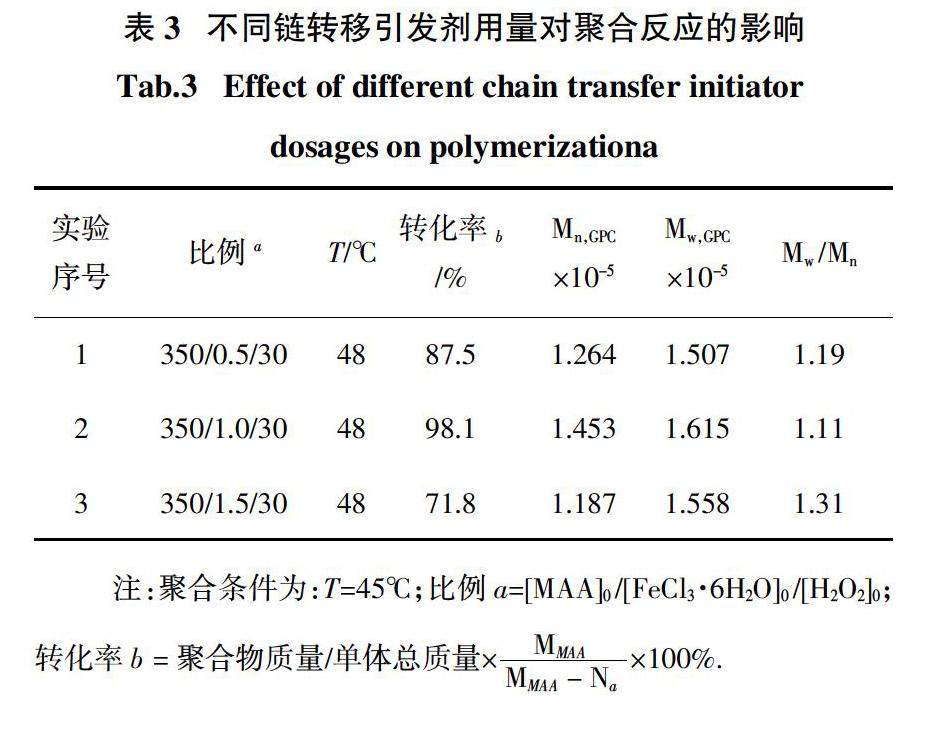
通过采用不同比例的链转移引发剂,考察聚合物分子量、转化率及分子量分布的变化,结果如表3所示.
从表3可以看出,在甲基丙烯酸的聚合过程中,随着链转移引发剂用量的增加,单体转化率先增大后减小,当[MAA]0 /[FeCl3·6H2O]0 /[H2O2]0的比例为350/1.0/30时,单体转化率较高,分子量分布较窄,这是由于链转移引发剂较少时,单体自由基无法完全与FeCl3形成络合,生成的活性自由基较少;链转移引发剂较多时,链转移引发剂中的过渡金属离子又会对链的增长产生阻聚作用,影响聚合反应速率.
2.2.3 反应时间对聚甲基丙烯酸(钠)分子量及转化
率的影响
通过控制不同的反应时间,考察聚合物分子量、转化率及分子量分布的变化,结果如表4所示,其聚合反应前后转化率及分子量变化如图9、图10所示. 表4、图9、图10中,聚合条件均为:T = 45 ℃,[MAA]0 /[FeCl3·6H2O]0 /[H2O2]0 = 350/1/30.
从表4可以看出,在甲基丙烯酸的聚合过程中,随着反应的进行,单体转化率逐渐增加,聚合物分子量也逐渐增加,均具有较好的分子量分布,且反应在较低温度(45 ℃)时就可得到较优结果,说明H2O2 /FeCl3引发体系在水中具有很好的可控活性聚合能力,完全适用于丙烯酸、甲基丙烯酸等水溶性烯烃在水中的自由基聚合.
3 结 论
以H2O2和FeCl3为引发体系,对丙烯腈、甲基丙烯酸等缺电子类烯烃的自由基聚合进行了研究. 该引发体系中只有引发剂H2O2、链转移引发剂FeCl3、溶剂H2O及单体共4种组分,无需使用价格昂贵的配体和易挥发有机溶剂,实验条件温和,工艺简单,具有很好的应用价值,为缺电子类烯烃的聚合提供了一种新的方法.
参考文献
[1] WANG Y P,PEI X W,HE X Y,et al. Synthesis of well-defined,polymer-grafted silica nanoparticles via reverse ATRP [J]. European Polymer Journal,2005,41(6):1326—1332.
[2] UEDA J,SATO S,TSUNOKAWA A,et al. Scale-up synthesis of vinyl polymer-grafted nano-sized silica by radical polymerization of vinyl monomers initiated by surface initiating groups in the solvent-free dry-system [J]. European Polymer Journal,2005,41(2):193—200.
[3] CHEN R,WEI F,ZHU S,et al. Surface‐initiated atom transfer radical polymerization grafting of poly (2,2,2‐trifluoroethyl methacrylate) from flat silicon wafer surfaces [J]. Journal of Polymer Science Part A:Polymer Chemistry,2010,44(3):1252—1262.
[4] DE GRAAF A J,MASTROBATTISTA E,VERMONDEN T,et al. Thermosensitive peptide-hybrid ABC block copolymers obtained by ATRP:synthesis,self-assembly,and enzymatic degradation [J]. Macromolecules,2012,45(2):842—851.
[5] RAO J,KHAN A. Enzyme sensitive synthetic polymer micelles based on the azobenzene motif [J]. Journal of the American Chemical Society,2013,135(38):14056—14059.
[6] 徐偉箭,李海军,彭桦,等. RAFT聚合制备两亲性嵌段共聚物及其应用研究[J]. 湖南大学学报(自然科学版),2010,37(2):56—59.
XU W J,LI H J,PENG H,et al. RAFT polymerization preparation amphiphilic block copolymers and its application [J]. Journal of Hunan University (Natural Sciences),2010,37(2): 56—59. (In Chinese).
[7] VILLARROYA S,THURECHT K J,HOWDLE S M. HRP-mediated inverse emulsion polymerisation of acrylamide in supercritical carbon dioxide [J]. Green Chemistry,2008,10(8):863—867.
[8] MEEK K M, EATON T R, RORRER N A, et al. Emulsion polymerization of acrylonitrile in aqueous methanol [J]. Green Chemistry,2018,20(23):5299—5310.
[9] MATYJASZEWSKI K,GAYNOR S,WANG J S. Controlled radical polymerizations:the use of alkyl iodides in degenerative transfer [J]. Macromolecules,1995,28(6):2093—2095.
[10] WANG J S,MATYJASZEWSKI K. Controlled/“living” radical polymerization. halogen atom transfer radical polymerization promoted by a Cu(I)/Cu(II) redox process [J]. European Polymer Journal,1995,30(28):7901—7910.
[11] GAYNOR S G,WANG J S,MATYJASZEWSKI K. Controlled radical polymerization by degenerative transfer:effect of the structure of the transfer agent [J]. Macromolecules,1995,28(28):8051—8056.
[12] LIU T Q,JIA S J,KOWALEWSKI T, et al. Water-dispersible carbon black nanocomposites prepared by surface-initiated atom transfer radical polymerization in protic media [J]. Macromolecules,2017,39(2):548—556.
[13] JIE H,ZHAO S, XIANG G, et al. Ab initio raft emulsion copolymerization of styrene and acrylonitrile [J]. Industrial & Engineering Chemistry Research,2014,53(18):7688—7695.
[14] MATYJASZEWSKI K, TSAREVSKY N V. Nanostructured functional materials prepared by atom transfer radical polymerization [J]. Nature Chemistry,2009,1(4):276—288.
[15] AND N V T,MATYJASZEWSKI K.“Green” atom transfer radical polymerization:from process design to preparation of well-defined environmentally friendly polymeric materials [J]. Chemical Reviews,2010,38(36):2270—2299.
[16] FLEISCHMANNS,ROSEN B N,PERCEC V,et al. SET-LRP of acrylates in air [J]. Journal of Polymer Science Part A:Polymer Chemistry,2010,48(5):1190—1196.
[17] LORANDI F, FANTIN M, ISSE A A, et al. Electrochemically mediated atom transfer radical polymerization of N-Butyl acrylate on non-platinum cathodes [J]. Polymer Chemistry,2016,7(34):5357—5365.
[18] MUNIRASU S,AGGARWAL R,BASKARAN D. Highly efficient recyclable hydrated-clay supported catalytic system for atom transfer radical polymerization [J]. Chemical Communications,2009,30(30):4518—4520.
[19] WANG J S, MATYJASZEWSKI K. Controlled/living radical polymerization:atom transfer radical polymerization in the presence of transition-metal complexes [J]. Journal of the American Chemical Society,1995,117(20):5614—5615.
