我国热带作物多主棒孢种群多样性及致病力分化分析
2019-01-09李博勋冯艳丽刘先宝蔡吉苗陆翠梅郑肖兰黄贵修
李博勋 冯艳丽 刘先宝 蔡吉苗 陆翠梅 郑肖兰 黄贵修


摘 要 多主棒孢(Corynespora cassiicola)是一种全球分布的重要植物病原真菌,寄主范围十分广泛。近年来,该病原菌侵染危害多种热带作物,并在局部地区大面积暴发流行,造成巨大的经济损失。本研究利用核糖体转录间隔区(Internal transcribed spacer, ITS)、翻譯延伸因子(translation elongation factor 1 alpha, EF-1α)、β微管蛋白(β-Tubulin, TUB),对来自橡胶树、木薯、番木瓜和瓜菜等多种热带作物的70株多主棒孢进行种群多样性分析。结果发现,利用最大似然法,在相似系数为0.97时可将供试菌株划分为两大遗传类群:类群Ⅰ为国内和一些国外橡胶树的多主棒孢;类群Ⅱ为其他寄主多主棒孢,遗传类群与寄主来源具有显著的相关性。致病力测定表明,多主棒孢种内致病力分化明显,类群Ⅰ的橡胶树多主棒孢仅能侵染橡胶树,不能侵染其他寄主,具有明显的寄主专化性,且不同地理来源的菌株致病力差异不显著。类群Ⅱ的多主棒孢在不同寄主间可以相互侵染,但菌株在致病力和发病症状上存在一定差异,表现出对其原寄主的高度致病力。多基因序列聚类分析与致病力分化分析结果具有较好的一致性,这为研究我国热带作物多主棒孢的种群结构、主要致病型以及为多主棒孢病害的发生、流行和防治提供了理论依据。
关键词 热带作物;多主棒孢病菌;种群多样性;致病力分化
中图分类号 S432.4+4 文献标识码 A
Genetic Diversity and Pathogenic Variability Among Isolates of Corynespora cassiicola from Tropical Crops in China
LI Boxun, FENG Yanli, LIU Xianbao, CAI Jimiao, LU Cuimei, ZHENG Xiaolan, HUANG Guixiu*
Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Integrated Pest Management on Tropical Crops, Ministry of Agriculture and Rural Affairs / Hainan Key Laboratory for Monitoring and Control of Tropical Agricultural Pests, Haikou, Hainan 571101, China
Abstract Corynespora cassiicola is an important plant pathogenic fungus distributed globally and has a wide host range. In recent years, C. cassiicola had infected a variety of tropical crops. The diseases caused by C. cassiicola has outbroken in some areas, causing huge economic losses. In this study, we used ITS, EF-1α and β-tubulin genes to analyze the population diversity of isolates of C. cassiicola collected from rubber trees, cassava, papaya, tropical fruits and vegetables. When the similarity coefficient was 0.97, the tested isolate could be divided into two divergent clusters by the maximum likelihood method. Cluster I was the isolates of rubber trees, which came from China and some foreign countries, and cluster II was the isolates of other hosts. There was significant correlation between genetic clusters and host source. Pathogenicity test showed that the pathogenic differentiation of C. cassiicola was obvious. The isolates of cluster I could only infect rubber trees, but could not infect other hosts. They had obvious host specificity, and there was no significant difference in pathogenicity among isolates from different geographical sources. C. cassiicola in cluster II could infect each other among different hosts, but the pathogenicity and symptoms of the isolates were different, showing a high pathogenicity to the original hosts. The results of genetic diversity and pathogenic variability showed a good consistency, which would provide a theoretical basis for understanding the population structure and main pathogenic types among the isolates of C. cassiicola from tropical crops in China, as well as the occurrence, epidemic and control method of the diseases caused by C. cassiicola.
Keywords tropical crops; Corynespora cassiicola; population diversity; pathogenic variability
DOI 10.3969/j.issn.1000-2561.2019.12.020
多主棒孢病菌(Corynespora cassiicola)是为害我国热带作物的主要病原真菌,其寄主范围广、症状类型多样、生理小种复杂。由该病原菌侵染引起的橡胶树棒孢霉落叶病是橡胶树最为严重的病害之一,在全球主要产胶国普遍发生,造成的经济损失巨大[1]。同时该菌也能为害木薯、番木瓜、香蕉等热带果蔬,并在局部地区暴发流行。李宝聚等[2]对我国蔬菜多主棒孢病害进行了调查,发现海南、云南、广东、广西、山东、河北、北京、辽宁、吉林、河南等地的黄瓜、茄子、番茄、菜豆、辣椒受多主棒孢的危害十分严重,每年发生面积超过66.7万hm2,损失超过50亿元。再加上该病原菌的侵染破坏力极强,给防治带来了巨大困难,近年来已成为我国主要热带作物的主要病害之一。
多主棒孢在分子水平上存在明显的差异,具有丰富的遗传多样性。Silva利用RFLP和RAPD标记将采自斯里兰卡和澳大利亚地区的多个寄主植物上的多主棒孢划分为7个遗传类群,发现遗传类群和样本采集地、致病力、菌株的生长速率之间具有显著相关性[3]。但也有学者指出,多主棒孢的遗传类群与致病型、地理或寄主来源不具有相关性[4]。Smith等[5]利用高变异核位点GA4,分析了4个国家58个寄主上多主棒孢进行系统发育分析,发现其种内遗传多样性丰富,而且不同类群与致病力和寄主来源密切相关。Dixon等[6]利用Cassiicolin毒素基因、ITS、ga4、caa5以及act1基因序列分析了不同寄主植物上的143株多主棒孢,进一步证实了遗传类群与寄主来源、致病性和生长速率有关,但是与地理来源无关。Shimomoto等[7]利用多基因(β-微管蛋白、EF-1α、钙调蛋白和肌动蛋白)分析了64株多主棒孢,发现遗传类群与致病型一致。随着分子生物学技术的发展和对多主棒孢病害研究的深入,学者们开始利用不同毒素类群的Cassiicolin毒素基因对多主棒孢的致病型进行了详细的划分,这也是现阶段研究多主棒孢分类的主要依据[8]。Déon等[8]分析了橡胶树上6个Cassiicolin毒素类群(Cas1~ Cas6型)基因的11个菌株对两个橡胶树品种(RRIM600、PB260)的致病力,发现不同毒素类型的菌株在致病力强弱上存在显著差异,Cas1型的致病力最强。而对于不同寄主来源多主棒孢的遗传多样性与致病力分化之间的研究进展很少。为此,本研究利用多基因序列和致病力分化测定等方法,分析我国主要热带作物和果蔬多主棒孢病菌的遗传种群结构,进一步明确我国多主棒病菌的优势种群及其致病力分化情况,这为该病原菌的发生和流行規律、生理小种的确定以及防控策略的制定提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株和材料 70株多主棒孢(表1)由中国热带农业科学院环境与植物保护研究所热带工业原料作物病害研究组分离和保存。致病力测定选用的橡胶树和木薯种苗均由中国热带农业科学院环境与植物保护研究所演丰基地保存,瓜菜种苗为市场购买种子培育。
1.1.2 培养基和试剂 PDA培养基参照《植病研究方法》配制[9],用于多主棒孢菌株的培养。引物(见表1)均由华大基因股份有限公司合成;克隆载体pMD18-T、PCR扩增反应试剂购于TAKARA公司;pMD-18T载体、Taq DNA聚合酶、dNTP等购自宝生物工程(大连)有限公司。DNA Marker、Trans5α大肠杆菌E. coli感受态购自北京全式金生物技术有限公司。其他化学试剂均为国产分析纯。
1.1.3 仪器与设备 Bio-Rad T100型梯度PCR仪,美国伯乐公司; UVI FireReader凝胶成像系统,英国UVItec公司。
1.2 方法
1.2.1 DNA提取、PCR扩增和测序 采用CTAB方法[10]提取病原菌DNA,用超微量分光光度计进行DNA质量测定,用ITS、EF-1α、TUB、Cassiicolin
等多基因的引物序列(表2)对病原菌目的基因进行PCR扩增,反应条件参照Déon等[8]的方法,扩增产物用1%的琼脂糖凝胶电泳进行检测,经Omega Bio-Tek试剂盒进行目的条带回收,之后克隆到pMD18-T载体,转化Trans5α大肠杆菌感受态细胞,筛选阳性克隆转化子,送其中的3个克隆至华大基因技术有限公司进行序列测定。
1.2.2 多基因序列分析、遗传距离计算和系统发育树构建 将序列在NCBI中进行BLAST分析,利用CodonCode Aligner V7.0.1去除测序峰图的低质量区域、完成峰图校对拼接和引物序列切除,应用PAUP 4.0软件计算种内遗传距离;利用MEGA 7.0软件最大似然法中的Tamura-Nei model构建系统发育树。
1.2.3 致病力分化分析 根据多基因序列分析结果,从每个类群里挑选代表性的27个菌株,用无菌水配制孢子悬浮液浓度为105个/mL,于盆栽黄瓜长出3片真叶,番茄、辣椒、豇豆长出4片真叶时进行喷雾接种,每株接种15 mL孢子悬浮液,每个菌株设3次重复,以清水接种为对照,每个重复15株苗,接种后置于25 ℃光照培养箱中保湿培养。在接种后7~14 d,按瓜菜棒孢叶斑病情分级标准[11]进行统计。橡胶树叶片接种法参照农业行业标准《热带作物种质资源抗病虫鉴定技术规程橡胶树棒孢霉落叶病》(NY/T 3195-2018)[12]。致病性分析所获数据均采用SAS 9.0软件进行统计分析,多重比较采用Duncans新复极差检验(LSR test)。
2 结果与分析
2.1 ITS、EF-1α、TUB单基因序列分析
用ITS1/ITS4、EF1-728F/EF1-986R和TUB-F/ R的3种引物对供试的70株多主棒孢菌株进行ITS区、EF-1α和TUB序列的扩增,分别得到大小约为531、304、954 bp的条带。所有菌株序列在NCBI经BLAST比对分析,均为多主棒孢(C. cassiicola),并将各单基因的序列提交至GenBank(表1)。通过序列间的比对发现,在ITS1区的第87位点存在单核苷酸多态性(C/T),其他序列完全一致。
系统发育树的分析结果显示,ITS、EF-1α、TUB 3个单基因序列均能将供试的71个多主棒孢菌株划分为2大遗传类群(图1,图2,图3),第Ⅰ类群均为橡胶树多主棒孢,来源于国内各橡胶主产区以及境外植胶国,不同地理来源的菌株之间没有显著的差异;第Ⅱ类群为其他寄主多主棒孢,包括木薯、番木瓜、黄瓜、番茄、豇豆、茄子、西甜瓜等,但也有8株橡膠多主棒孢菌株(占供试橡胶多主棒孢的17%),其中3株(HCcYD1、CYDB3、CYDB2)来自印度,3株(HCcYNHZ M01-1、HCcYNHZM01-2、HCcYNHZM01-3)来自越南,2株(HCcGDMM1402、HCcGDMM1406)来自广东茂名,这8个菌株与第Ⅰ类群的橡胶多主棒孢遗传距离较远,存在显著的差异。从聚类图的分支上看,印度橡胶多主棒孢(HCcYD1、CYDB3、CYDB2)与番木瓜多主棒孢同在一个小分支,亲缘关系最近;越南橡胶多主棒孢(HCcYNHZM01-2)与莴笋、木薯多主棒孢亲缘关系最近,而HCcYNHZM01-1、HCcYNHZM01-3与辣椒多主棒孢同在一个小分支;来自广东茂名的2株橡胶多主棒孢(HCcGDMM1402、HCcGDM M1406)与黄瓜多株棒孢同在一个小分支,亲缘关系最近。
从上述结果可以看出,3个单基因的序列的聚类图基本上能将橡胶多主棒孢和其他寄主来源的多主棒孢进行有效区分,而且不同寄主之间的遗传差异显著高于地理来源之间的差异。说明寄主因素与多主棒孢的遗传变异间的相关性更为显著,但也有少部分橡胶多主棒孢与其他寄主来源多主棒孢的遗传距离较为接近。从遗传进化的角度分析,这少部分橡胶多主棒孢可能来源于其他寄主,存在交互侵染的现象,也有可能为橡胶多主棒孢的一个新的类群。
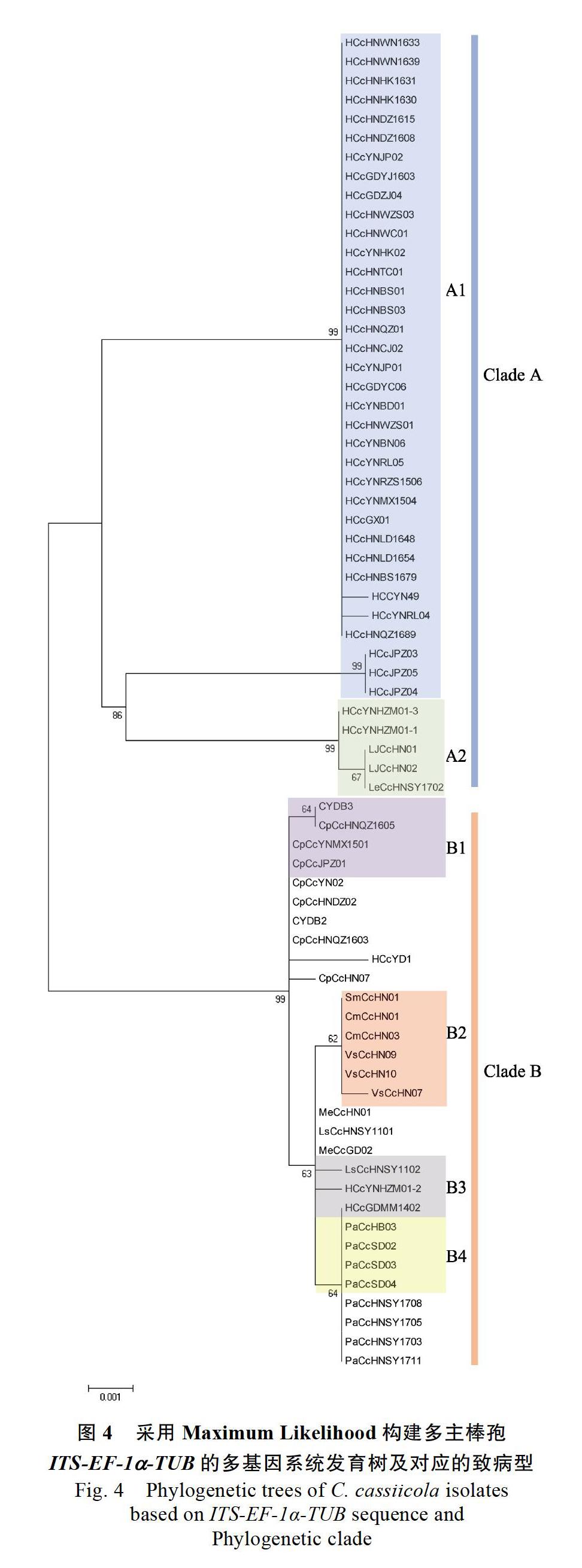
2.2 ITS- EF-1α-TUB多基因序列分析
采用3种多基因的部分序列进行拼接,共同构建系统发育树,对来自柬埔寨、越南、印度以及我国的6个省份,10个寄主(橡胶树、木薯、番木瓜、黄瓜、茄子、辣椒、豇豆、莴笋、西甜瓜、番茄)上的70株多主棒孢进行遗传进化树的构建(图4),发现不同来源的多主棒孢菌株间存在丰富的遗传多样性。根据多基因序列聚类分析,利用最大似然法,在相似系数为0.97时可将供试菌株被划分为两大遗传类群。第Ⅰ类群,为橡胶多主棒孢,来源于我国云南、海南、广东和广西等橡胶主产区以及柬埔寨、越南等国外的橡胶多主棒孢,这一类群的菌株与年份、地理来源之间不具有相关性。但越南(HCcYNHZM01-1)和柬埔寨(HCcJPZ03、HCcJPZ04、HCcJPZ05)的橡胶多主棒孢菌株虽然与国内的橡胶多主棒孢同属于一个类群,但处于不同的小分支上,推测国内和国外的橡胶多主棒孢菌株间存在略微的差异,而国内各植胶区的橡胶多主棒孢间无明显差异,所有菌株都聚类在一个分支上,支持率为98%(图4)。第Ⅱ类群,为不同寄主来源的多主棒孢菌株,与单基因序列聚类分析结果一致。其中供试的所有番木瓜多主棒孢CpCcHNQZ1603、CpCcYNM
X1501、CpCcHNDZ02、CpCcHNQZ1605、CpCcY N02、CpCcJPZ01(柬埔寨番木瓜)和所有黄瓜多主棒孢PaCcHB03、PaCcSD02、PaCcSD04、PaCcHNS Y1703、PaCcHNSY1705、PaCcHNSY 1708、PaCcH NSY1711各自成为一个小分支,单独聚为一类,支持率为99%和63%。西甜瓜多主棒孢(CmCcHN01、CmCcHN03)、豇豆多主棒孢(VsCcHN07、VsCcHN09、VsCcHN10)和茄子多主棒孢(SmCcHN01)分属于同一个小分支,支持率为65%。木薯多主棒孢(MeCcHN01、MeCcGD02)和莴笋多主棒孢(LsCcHNSY1101、LsCcHN SY1102)的亲缘关系最近。
从多基因序列分析的结果可以看出,不同寄主来源的多主棒孢菌株之间存在显著的差异,能将国内、外的橡胶多主棒孢菌株与其他寄主来源的多主棒孢菌株严格区分开,不同地理来源的菌株之间没有显著的差异,而且种内相似度较高,推测这类菌株可能存在寄主专化性,需要通过致病力测定进一步验证。除橡胶之外的其他寄主多主棒孢的种群分化关系不明显,尽管有些寄主的多主棒孢聚类在不同的小分支上,但遗传距离还是比较近,推测第 Ⅱ 类群的多主棒孢之间存在交互侵染的可能。
2.3 不同寄主来源多主棒孢的致病力分化分析
根据多基因序列分析结果,从每个类群中选取出27株不同寄主来源的多主棒孢进行致病力测定。在此之前,参照法国学者报道的多主棒孢Cassiicolin毒素类型的划分[8],明确了这27株多主棒孢的毒素类型(表3)。采用SAS软件的Ward最小方差进行聚类分析,将27株多主棒孢分为Clade A和Clade B 2种主要的致病型(图4,图5,表3),其中Clade A以Cas5毒素类型为主,Clade B型均为Cas2毒素类型,目前供试的多主棒孢菌株仅存在2种毒素类型,与刘先宝等[13]2016年报道的结果一致。
A1致病型的菌株为多基因序列聚类分析第Ⅰ类群的12株橡胶树多主棒孢,来自国内橡胶主产区(云南、海南、广东、广西)以及柬埔寨,这一致病型的菌株只能侵染橡胶树,不能侵染其他寄主,表现出明显的寄主专化性(表3),进一步验证了多基因聚类分析的结果。A2致病型的橡胶多主棒孢HCcYNHZM01-3(越南)、辣椒多主棒孢LJCcHN01和番茄多主棒孢LeCcHNSY02既能侵染橡胶树,也能侵染其他瓜菜,但对豇豆表现出弱致病力。分属于第 Ⅱ 遗传类群的其他寄主多主棒孢在橡胶、辣椒、黄瓜、豇豆、番茄上能进行相互侵染,其中B1致病型的番木瓜多主棒孢对黄瓜致病力最强,但不侵染豇豆和番茄;B3致病型的木薯多主棒孢不能侵染黄瓜和番茄,对辣椒和豇豆表现出弱致病力;另外,B4致病型的黄瓜多主棒孢(PaCcSD04、PaCcHB03)和橡胶多主棒孢(HCcGDMM1402)除了对番茄表现出弱致病力外,对其他寄主的致病力都很强。
根据致病力测定结果发现,多主棒孢的遗传类群与致病力分化具有明显的相关性,致病力的结果能较好地和多基因序列的聚类结果对应。第 Ⅰ 类群的多主棒孢,在致病型上属于Clade A,毒素类型以Cas5型为主,致病力测定发现,A1致病型只能侵染橡胶树,不能侵染其他寄主,表现出明显的寄主专化性,A2致病型的橡胶多主棒孢既能侵染橡胶树也能侵染其他寄主。第 Ⅱ 类群,主要以其他寄主多主棒孢为主,也有部分橡胶多主棒孢,致病型上属于Clade B,毒素类型均为Cas2型,致病力测定不同寄主来源的多主棒孢之间能进行相互侵染,但致病力和发病症状上存在一定差异。
3 讨论
本研究采用分子系统学的分析方法,利用ITS、EF-1α、TUB等多基因序列分析了我国主要热带作物和果蔬上的70株多主棒孢的遺传种群结构和优势种群,发现不论是单基因还是多基因构建的系统发育树,均能较好的将供试菌株划分为2大遗传类群,第Ⅰ类群有40株菌,均为国内和国外橡胶多主棒孢,国内(云南、海南、广东、广西)的菌株与柬埔寨和越南的菌株高度同源,从地理来源上没有显著的差异。第Ⅱ类群有30株菌,为其他寄主多株棒孢和少数几株橡胶多主棒孢,而且相同寄主的多主棒孢能聚到一起,遗传进化上具有高度的相似性。说明供试的多主棒孢与寄主来源关系密切,但与地理来源不具有显著的相关性,这与Qi等[4]利用RFLP和RAPD以及Dixon 等[6]利用肌动蛋白、ITS区以及2个多态性位点的分析结果一致。
致病力分化分析结果显示,致病型A1的橡胶多主棒孢只能侵染橡胶树不能侵染其他寄主,具有明显的寄主专化性,但不同地理来源的橡胶多主棒孢在致病力上没有显著的差异。致病型A2和B1的菌株既能侵染橡胶也能侵染其他瓜菜寄主,不如A1型的致病力强。致病型B3和B4的多主棒孢菌株之间均能进行交互侵染,但菌株间的致病力存在一定的差异,表现为部分多主棒孢菌株对其分离寄主的致病力往往高于其他寄主,而有些菌株对非自身寄主之外的其他寄主表现出弱致病力或不致病。说明多主棒孢菌尽管寄主范围十分广泛,但对其原寄主的致病力是最强的,这与多主棒孢与其原寄主植物可能存在协同进化的关系,在寄主长期作用的影响下,也导致多主棒孢具有寄主专化性[14-15]。另外,发现采集自相同地点、相同寄主的瓜菜(如西甜瓜和豇豆)多主棒孢在致病力上也存在较大的差异,推测在同一个生态系统中这些菌株在个体之间可能存在生理生化和遗传分化上的差异,这导致病原菌对寄主的侵染力、定殖、症状以及危害程度上的差异。因此,对多主棒孢主要优势种群和主要致病型的确定,能为多主棒孢的流行特点分析、抗病品种的选育以及防控策略的制定奠定重要的理论依据。
总体来看,结合多基因序列聚类分析和致病力测定的结果,能较好地反应多主棒孢的遗传结构、优势种群以及主要致病型等,而且多基因序列聚类分析与致病力分化分析结果能相互印证,具有较好的一致性。就橡胶树多主棒孢而言,第Ⅰ类群是我国橡胶树多主棒孢的优势种群具有明显的寄主专化性,致病型A1是其主要的致病型,结合橡胶树棒孢霉落叶病在我国的发生历史[16],不排除橡胶多主棒孢是从我国边境的植胶国通过种苗调运、贸易往来等途径传入国内的可能性,但仍需要更多地理来源的菌株和大量的证据进行证实。就其他热带果蔬多主棒孢而言,虽然不像橡胶多主棒孢具有明显的寄主专化性,但不同寄主间多主棒孢的致病力存在一定的差异,表现出对其原寄主的高度致病力,加上寄主范围十分广
泛,在不同寄主上表现的症状也具有显著的差异,本研究基本查明了这些热带果蔬多主棒孢的种群结构和主要致病型,为多主棒孢病害的发生、流行和防治提供了理论依据。
参考文献
Rahman A Y A, Usharraj A O, Misra B B, et al. Draft genome sequence of the rubber tree Hevea brasiliensis[J]. BMC Genomics, 2013, 14(1): 75.
李宝聚, 赵彦杰, 于淑晶, 等. 2008 年秋季河北青县黄瓜棒孢叶斑病大发生[J]. 中国蔬菜, 2008(11): 51-52, 66.
[3]Silva W P K, Deverall B J, Lyon B R. Molecular, physiological and pathological characterization of Corynespora leaf spot fungi from rubber plantations in Sri Lanka[J]. Plant Pathology, 1998, 47(3): 267-277.
Qi Y X, Zhang X, Pu J J, et al. Morphological and molecular analysis of genetic variability within isolates of Corynespora cassiicola from different hosts[J]. European Journal of Plant Pathology, 2011, 130(1): 83-95.
Smith L J, Datnoff L E, Pernezny K, et al. Phylogenetic and pathogenic characterization of Corynespora cassiicola isolates[J]. Acta Horticulturae, 2009(808): 51-56.
Dixon L J, Schlub R L, Pernezny K, et al. Host specialization and phylogenetic diversity of Corynespora cassiicola[J]. Phytopathology, 2009, 99(9): 1015-1027.
Shimomoto Y, Sato T, Hojo H, et al. Pathogenic and genetic variation among isolates of Corynespora cassiicola in Japan[J]. Plant Pathology, 2010, 60(2): 253-260.
Déon M, Fumanal B, Gimenez S, et al. Diversity of the cassiicolin gene in Corynespora cassiicola and relation with the pathogenicity in Hevea brasiliensis[J]. Fungal Biology, 2014, 118(1): 32-47.
Fang Z D. Research method for plant pathology [M]. 2nd ed. Beijing: China Agriculture Press, 1998: 63.
[10]劉先宝, 蔡吉苗, 潘羡心, 等. 橡胶树多主棒孢菌rDNA-ITS区的分子鉴定及检测[J]. 热带作物学报, 2008, 29(4): 489-493.
阚琳娜, 李宝聚, 纪明山, 等. 黄瓜褐斑病防治药剂的活体筛选[J]. 中国蔬菜, 2007, 1(4): 22-24.
李博勋, 刘先宝, 林春花, 等. 国内橡胶树主要种质对棒孢霉落叶病的抗性评价[J]. 植物保护, 2014, 40(5): 86-92.
刘先宝, 李博勋, 陈 珊, 等. 国内橡胶树多主棒孢Cassiicolin毒素多样性及致病性分析[J]. 热带作物学报, 2016, 37(10): 1969-1973.
高 苇. 我国黄瓜棒孢叶斑病的病原学及诊断技术的研究[D]. 北京: 中国农业科学院, 2011.
[15]Cutrim F A, Silva G S. Pathogenicity of Corynespora cassiicola to different plant species[J]. Fitopatologia Brasileira, 2003, 28(2): 193-194.
Pu J J, Zhang X, Qi Y X, et al. First record of Corynespora leaf fall disease of Hevea rubber tree in China[J]. Australasian Plant Disease Notes, 2007, 2(1): 35-36.
