农杆菌注射法瞬时转化荔枝果实组织的研究
2019-01-09王树军王果李焕苓孙进华李芳王家保
王树军 王果 李焕苓 孙进华 李芳 王家保

摘 要 为了寻找一种高效的荔枝果实瞬时基因表达方法,本研究以荔枝品种‘新球蜜荔(Litchi chinensis Sonn. var. ‘Xinqiumili)为试材,利用农杆菌注射法对荔枝果实组织进行转化,研究了果实发育时期、菌株种类、注射部位、取样时间、菌液浓度等对转化效率的影响。结果表明:选择果肉已完全包裹种子的Ⅱb期果实进行连体注射,在果柄、果皮、种子、果肉分别注入OD600值为2.4的农杆菌菌株GV3101,4 d后取样进行检测,4个组织的GUS染色率较高。本研究成功建立了适用于荔枝果实的基因瞬时表达系统,为今后快速鉴定荔枝果实相关基因功能提供了基础。
关键词 农杆菌注射;‘新球蜜荔果实;瞬时表达;GUS检测
中图分类号 S667.1 文献标识码 A
Transformation of Tissues of Litchi Fruit with Injection of Agrobacterium
WANG Shujun, WANG Guo, LI Huanling, SUN Jinhua, LI Fang, WANG Jiabao*
Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract To find an efficient transient gene expression method for litchi, the fruits of ‘Xinqiumili were used as the material to transform fruit tissues by Agrobacterium in this study. The effects of fruit developing stage, bacterium strains, injection sites, sampling time, bacteria solution concentration on the transformation efficiency were studied. The results showed that the GUS staining rates were better in four tissues under the condition that Agrobacterium strain GV3101 with OD600 of 2.4 was injected into the stalk, peel, seed and pulp of the stage Ⅱ b fruit with the pulp completely wrapped in the seed in vivo, and the fruits were sampled for detection after four days of injection. The transient gene expression system of litchi fruits was successfully established, which laid a foundation for the rapid identification of related genes of litchi fruits in the future.
Keywords injection of Agrobacterium; ‘Xinqiumili fruit; transient expression; GUS detection
DOI 10.3969/j.issn.1000-2561.2019.12.013
荔枝(Litchi chinensis Sonn.)是華南重要的特色水果,荔枝产业在区域农业经济中占有重要地位。培育荔枝优良新品种是进行品种结构调整、解决产业重大问题的基础。基因工程育种具有可定向改良荔枝性状、缩短育种周期、提高育种效率的优势。获得重要功能基因及其调控元件如启动子等是基因工程育种的基础,近年来逐渐成为荔枝生物学研究的热点[1-2]。前期人们通常以拟南芥和烟草等模式植物来研究荔枝基因及其启动子功能[3-4],但是利用这些转化系统所获得的研究结果都无法完全真实反映出与果实性状有关的基因功能[5]。荔枝离体再生困难[6],限制了利用传统的转基因技术体系开展荔枝基因功能研究的效率。因此需要寻求一种新的快速高效技术体系用于荔枝果实基因及其启动子的功能研究。果实注射法是一种以肉质果实为转化材料的基因瞬时表达验证新方法,操作简单、周期短。前人利用该方法已在苹果、梨、番茄、桃、草莓、橙等肉质果实中成功开展了基因功能研究[7],但是在荔枝果实中的应用还未见报道。本研究对影响荔枝果实注射法的多种因素进行探索,建立了瞬时表达系统,以期为快速鉴定荔枝果实相关基因功能提供基础。
1 材料与方法
1.1 材料
本研究在中国热带农业科学院试验基地果园进行,选取‘新球蜜荔(Litchi chinensis Sonn. var. ‘Xinqiumili)品种为材料。注射方式为连体注射和离体注射。连体注射是在果实发育期,选择无病虫害的果实,不摘离果树直接在树上进行,果面不做消毒及其他处理。离体注射是将果实采摘回实验室进行,所需果实采后3 h内运回实验室,挑选无病虫害和无机械损伤的果实,先用0.1% HgCl2溶液消毒1 min,再用灭菌蒸馏水冲洗3次,将冲洗好的果实用吸水纸吸干水分后用于注射实验。
农杆菌菌株选用GV3101和EHA105,植物表达载体选用包含GUS基因的pCAMBIA1301质粒。
1.2 方法
1.2.1 农杆菌注射液的准备 用热激转化法将质粒pCAMBIA1301分别转入农杆菌EHA105和GV3101感受态细胞,恢复培养后涂板在添加了卡那霉素(Kan)100 mg/L和利福平(Rif)100 mg/L的LB固體培养基上,利用菌落PCR方法鉴定出阳性单菌落后摇菌培养,液体培养基为LB+Kan 100 mg/L+Rif 100 mg/L,在200 r/min,28 ℃条件下,振荡培养至OD600值为0.8。再取1 mL菌液于含有Kan 100 mg/L+Rif 100 mg/L+乙酰丁香酮(AS)100 ?mol/L的100 mL LB液体培养基中在相同条件下扩大培养至OD600为0.8,收集菌液转入50 mL离心管中,5000 r/min离心收集菌体,去上清后以添加了AS(100 ?mol/L)的MS液体培养基为重悬液重悬菌体备用。
1.2.2 转化效率影响因素研究 依据李建国等对荔枝果实发育时期的新划分标准[8],分别取果实发育Ⅰ期(雌花授粉后35 d左右)、Ⅱa期(雌花授粉后55 d左右)和Ⅱb期(雌花授粉后70 d左右)的果实,研究不同发育时期注射对转化效率的影响。选取农杆菌菌株GV3101和EHA105进行对比实验,研究不同菌株种类对转化效率的影响。为了最大限度减少注射伤口损伤,选择使用针头较细的1 mL无菌注射器将菌液分别注入果柄、果皮、种子、果肉,其中果柄注射是横向刺穿后注入,果皮注射时刺穿外果皮但不刺透内果皮,果肉和种子注射时分别从果蒂和果顶部位注入,研究注射部位对转化效率的影响。分别在注射后2、4、6、8 d摘果取样进行GUS染色,研究注射后取样时间对转化效率的影响。将菌液分别重悬至OD600值为 0.8、1.6、2.4、3.2进行注射,研究菌液浓度对转化效率的影响。
选取相同发育时期的连体和离体果实,分别在果柄、果皮、种子、果肉部位,采用1 mL的无菌注射器将菌液注入,至有菌液溢出为止,每次注射完后要去除果实表面多余的菌液,研究离体注射和连体注射2种方式对转化效率的影响。
每个处理选取8个果实为1组重复,重复3次。
1.2.3 GUS组织化学染色 取注射后2、4、6、8 d的连体注射果实和离体注射果实,分别取注射的果皮、果柄、果肉、种子,切成小块,用无菌水清洗之后置于GUS染液[50 mmol/L pH 7.0磷酸钠缓冲液,0.1 mmol/L K3[Fe(CN)6],0.1 mmol/L K4[Fe(CN)6],1 mmol/L Na2EDTA,0.1% Triton-100,20%甲醛,0.5mg/mL X-Gluc]中,37 ℃染色过夜,酒精脱色后观察染色结果并统计GUS染色率。GUS染色率=(显色的果实数量/总注射果实数量)×100%。
1.3 数据处理
采用Excel 2010软件进行数据统计,采用Duncan法进行数据差异显著性分析。
2 结果与分析
2.1 荔枝果实发育时期的选取
依据李建国等[8]的划分标准,发育Ⅰ期荔枝果实以果皮与种皮生长为主,还未长果肉;发育Ⅱa期的荔枝果实以胚快速生长为主,其他部分也有发育,至果肉逐渐包满种子;发育Ⅱb期的荔枝果实指果肉已完全包裹种子至果实成熟。不同发育时期的果实注射农杆菌悬液后,雌花授粉后35 d左右的Ⅰ期和授粉后55 d左右的Ⅱa期果实均会停滞生长并落果;雌花授粉后70 d左右的部分Ⅱb期果实注射后会继续生长发育一段时间,对农杆菌的耐受性明显好于Ⅰ期和Ⅱa期,可进行取样检测,适用于本研究的瞬时表达研究。因此本实验选取雌花授粉后70 d左右的Ⅱb期果实开展后续研究。另外,选取的果实成熟度不宜太高,因为实验使用针头较细的1 mL无菌注射器,果实成熟度越高则种子硬度越大,针头难以刺入。
2.2 农杆菌菌株的选择
农杆菌悬液被注入荔枝果实后,会对果实造成伤害导致落果。注射菌株EHA105和GV3101后,统计坐果率分别为37.50%和54.17%,二者间无显著差异(图1)。对取样的果实进行果肉部分GUS染色,EHA105和GV3101的染色率分别为20.83%和37.50%,二者间无显著差异(图2)。结果表明,虽然EHA105对果实的伤害可能高于GV3101,转化率可能低于GV3101,但2种菌株不会对实验效率产生显著差异。最终,我们选择农杆菌菌株GV3101开展以下荔枝果实注射瞬时转化实验。
2.3 荔枝果实注射部位的选择
本研究以果实的果柄、果皮、种子、果肉4个组织为目标进行注射,荔枝果实的结构特征(图3)决定了种子和果肉部分的注射可同时进行,而果柄和果皮的注射要分别进行。注射农杆菌后观察发现,果柄和果皮的注射口部位会结痂,但不影响果实正常发育。此外,果皮注射部位颜色在第5天左右会变红(图4),这可能是注射部位伤乙烯迅速增加促进果皮转色的结果[9]。针对种子和果肉的研究,选择分别从果蒂和果顶2个部位注入农杆菌悬液,进行对比实验。结果发现,从果顶部位注射后,菌液会迅速聚集在注射口位置,有大量菌液溢出,果实内的菌液实际注入量少,且分布不均匀,菌液在果顶部位的局部富集导致果实易腐烂开裂。从果蒂部位注射后,少有菌液溢出,且果实完好。因此后续实验均选择从果蒂处注入果肉和种子。
2.4 果实取样时间的选择
分别在注射后2、4、6、8 d取样进行GUS染色检测,分析发现:果柄、果皮、种子、果肉的GUS染色率均因取样时间的不同而产生显著差异。注射后2 d的果柄、果皮、种子、果肉4个组织经GUS染色后均可检测到蓝斑,但是GUS染色率分别只有37.50%、33.33%、8.33%、29.17%;注射后4 d的GUS染色率最高,分别是83.33%、45.83%、33.33%、37.50%;注射6 d后的部分果实表现出腐烂症状,各组织的GUS染色率也呈下降趋势;注射8 d后虽可在极少数果实的果柄和种子部分检测到蓝斑,但是大多数果实的腐烂程度比较严重,不宜进行取果(图5)。因此,注射后4 d是最佳的取样时间。
不同字母表示同一组织在不同时间取样的GUS染色率差异显著(P<0.05)。
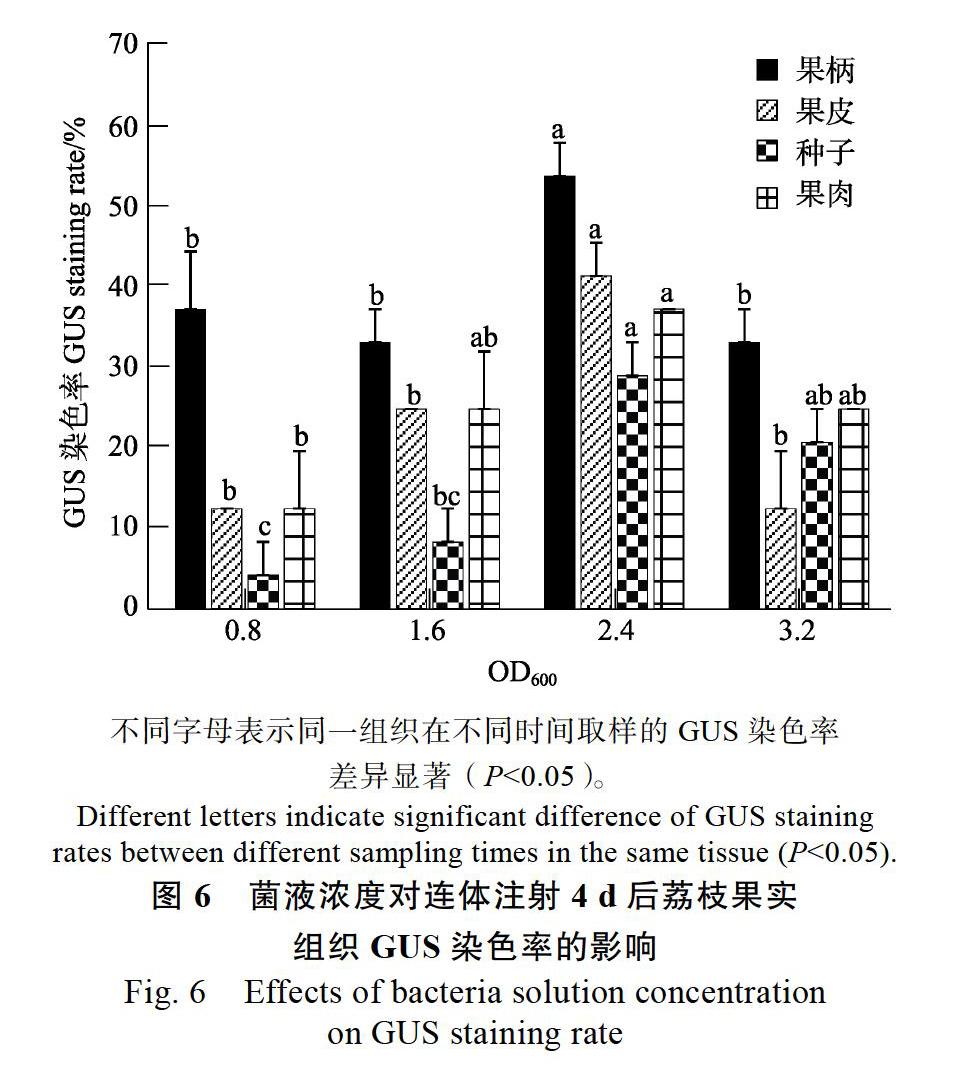
2.5 菌液浓度的选择
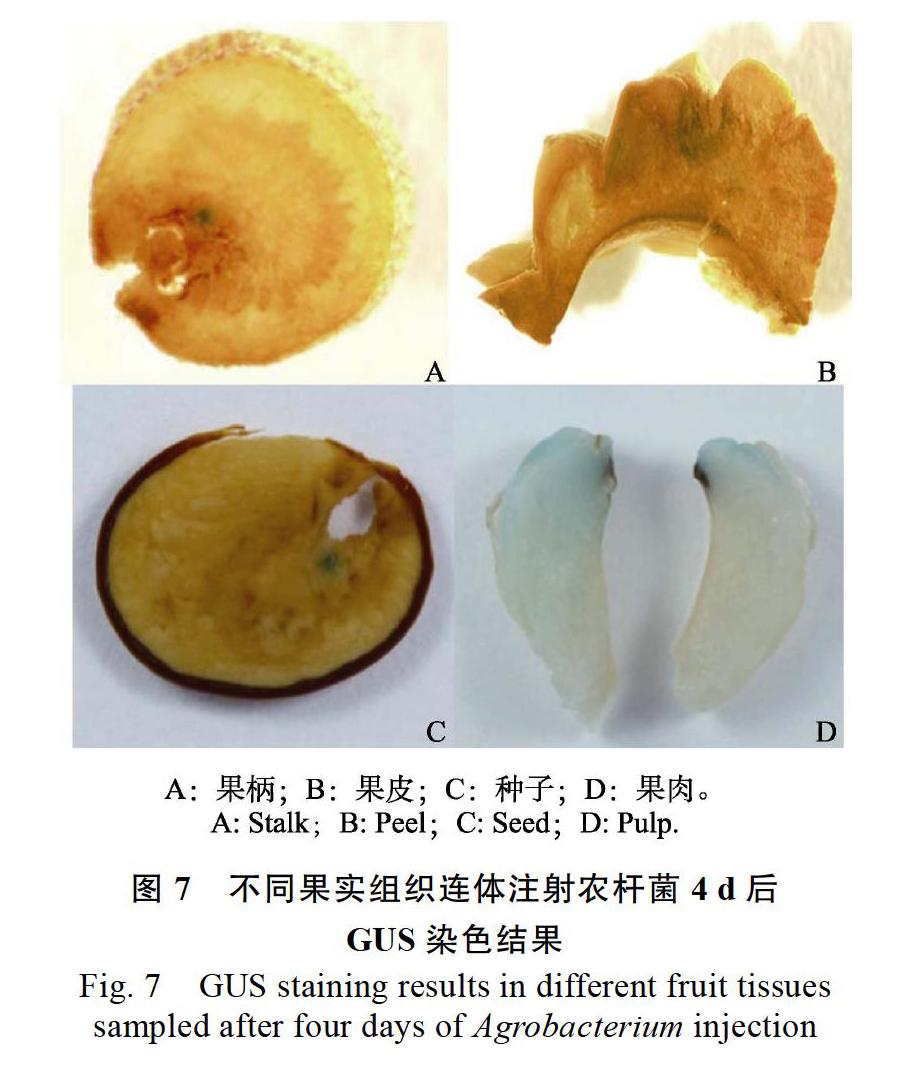
室外连体注射实验中不同浓度的农杆菌悬液注射荔枝果实组织4 d后取样进行GUS染色检测,分析发现:果柄、果皮、种子、果肉的GUS染色率均因菌液浓度的不同而产生显著差异。但果柄、果皮、种子、果肉的GUS染色率都以OD600值为2.4时最高,分别为54.17%、41.67%、29.17%、37.50%;其中果皮、种子、果肉的GUS染色率均随着菌液浓度增大呈先上升后下降的趋势。OD600值达到3.2的农杆菌注射果实后表现出腐烂加快且GUS染色率降低,农杆菌悬液OD600值为0.8时,果皮、种子、果肉3个结构转化效率不理想(图6)。综上,OD600值为2.4的菌液浓度最佳。4种组织在注射OD600值为2.4的农杆菌GV3101重悬液4 d后进行GUS染色,均能显色(图7)。
不同字母表示同一组织在不同时间取样的GUS染色率差异显著(P<0.05)。
2.6 连体注射和离体注射的对比
除了在田间开展连体注射,本研究还在室内进行了离体注射,结果表明,摘取的荔枝离体果实容易失水和褐变,而采取人工补水保湿方法,果实会发霉腐烂,影响取样和检测,可见离体实验对果实的消毒等处理条件要求高。而且室内离体实验中果柄、果皮、种子、果肉的GUS染色率较连体注射均不理想,其中注射的果柄部位在离体注射实验中未能观察到染色蓝斑,染色率为0。由此可知,荔枝果实注射法宜采取连体注射。
3 讨论
在植物中开展基因的功能研究,可以借助传统的转基因技术,但前提是要有稳定、高效的离体再生技术体系。荔枝作为木本果树,离体再生困难限制了传统转基因技术的应用。而且,前人以胚性愈伤组织为外植体,通过农杆菌介导或基因枪法建立起来的传统转基因技术体系均表现出周期长、转化率低、穩定性差的缺点[10-12],这严重制约了其应用于基因功能验证的效率。因此,基因瞬时表达系统逐渐被开发,并被广泛地应用于植物分子生物学研究[13]。其中,基因枪轰击是常用的方法,常被用于在荔枝叶片、花、果皮等部位进行组织特异表达基因启动子调控规律研究[14-16]。但是基因枪法对于荔枝果肉却效果不理想,因为轰击果肉,必须先破坏外层致密的果皮结构,从而导致果肉短期内就腐烂变质,无法开展后续研究。因此,需要寻找一种保持荔枝果实完整性的基因瞬时表达系统。Spolaore等[7]开发出一种针对成熟肉质果实的快速高效的农杆菌注射法,成功在苹果、梨、番茄、桃、草莓、橙等果实细胞中开展了研究。借鉴Spolaore等人的研究经验,本研究成功建立了适用于荔枝的果实注射法,为后期研究荔枝果肉特异表达基因及其启动子功能奠定了基础。
果实注射法是利用注射器将农杆菌悬浮液注入果实中,然后进行定性或定量分析的方法[7]。应用此方法首先要排除农杆菌自身造成的检测干扰。例如,本研究选择载体pCAMBIA1301中含有内含子的GUS基因作为报告基因,因为农杆菌等原核生物细胞在基因转录过程中没有剪接内含子的能力,所以含有内含子的基因只能在真核生物细胞中表达而不能在原核生物细胞中表达[17],从而避免农杆菌自身的GUS染色干扰。其次,由于农杆菌的注入会对果实产生有毒害的副作用,可能导致其生长停滞、腐烂等[18],因此要尽量保持果实在好的生理状态和适宜的条件下开展实验,选择对菌液耐受力较强的发育阶段果实为材料,在合适的部位注入适宜浓度的农杆菌,在恰当的时机取果进行检测,方可提高实验成功率。本研究通过对比发现选择雌花授粉后70 d左右的、果肉已完全包裹种子的Ⅱb期果实进行连体注射,在果柄、果皮、果蒂部位注入 OD600值为2.4的农杆菌GV3101,4 d后取果实进行检测,GUS染色率较高,在果柄、果皮、种子、果肉均可见蓝斑(图7),且蓝斑多出现在注射口附近,这可能与荔枝果实各组织结构致密,农杆菌悬液不易渗透扩散有关。
连体注射法最大限度保持了荔枝果实的完整性,直至检测环节才会进行果实结构分离,而且该方法未改变果实生长发育所需的外部自然环境,因此可以真实、快速地反映果实的基因表达情况或启动子调控规律,具有广阔的荔枝分子生物学应用前景。
参考文献
魏永赞, 胡福初, 郑雪文, 等. 光照对荔枝果实着色和花色素苷生物合成影响的分子机制研究[J]. 园艺学报, 2017, 44(7): 1363-1370.
吴建阳, 李彩琴, 李建国. 荔枝ACS1基因的分离及其与幼果脱落的关系[J]. 果树学报, 2017, 34(7): 817-827.
张 静, 董凤英, 王家保, 等. 荔枝Asr基因的分离及功能分析[J]. 热带作物学报, 2013, 34(9): 1682-1687.
练从龙, 卢秉国, 赖钟雄, 等. 荔枝古树胚性愈伤组织LcCu/Zn-SOD3基因启动子的克隆及功能验证[J]. 西北植物学报, 2015, 35(1): 16-22.
刘 敏, 滕文静, 董清华, 等. 草莓果实外源基因瞬时表达系统的建立[J]. 果树学报, 2009, 26(1): 60-65, 130.
彭 兵, 何业华, 胡桂兵, 等. 荔枝茎段愈伤组织类型及其切片观察[J]. 中国南方果树, 2012, 41(4): 25-27, 32.
Spolaore S, Trainotti L, Casadoro G. A simple protocol for transient gene expression in ripe fleshy fruit mediated by Agrobacterium[J]. Journal of Experimental Botany, 2001, 52(357): 845-850.
李建国, 黄辉白, 黄旭明. 荔枝果实发育时期的新划分[J]. 园艺学报, 2003, 30(3): 307-310.
解 静. 1-MCP对番茄冷害及机械损伤的影响[D]. 杭州: 浙江大学, 2010.
曾黎辉. 农杆菌介导荔枝(Litchi chinensis Sonn.)遗传转化体系的建立及导入LEAFY基因研究[D]. 福州: 福建农林大学, 2002.
桑庆亮, 赖钟雄, 林玉玲, 等. 荔枝基因枪转化及其GUS瞬时表达研究[J]. 热带作物学报, 2014, 35(11): 2223-2229.
Padilla G, Perez J A, Perea-Arango I, et al. Agrobacterium tumefaciens-mediated transformation of ‘Brewster (‘Chen Tze) litchi (Litchi chinensis Sonn.) with the PISTILLATA cDNA in antisense[J]. In Vitro Cellular & Developmental Biology Plant, 2013, 49(5): 510-519.
Agius F, Amaya I, Botella M A, et al. Functional analysis of homologous and heterologous promoters in strawberry fruits using transient expression[J]. Journal of Experimental Botany, 2004, 56(409): 37-46.
王树军, 刘保华, 孙进华, 等. 荔枝多酚氧化酶基因启动子克隆与功能分析[J]. 果树学报, 2015, 32(3): 427-433, 524.
孙 琴, 孙进华, 王树军, 等. 荔枝FKBP16-2基因启动子的克隆与瞬时表达分析[J]. 热带作物学报, 2016, 37(4): 736-741.
王树军, 孙 琴, 孙进华, 等. 荔枝GRX基因启动子的克隆与瞬时表达分析[J]. 分子植物育种, 2018, 16(8): 2436-2444.
张岚岚, 刘小花, 陈昆松, 等. 一种植物表达载体的構建及其在金柑上的瞬时表达[J]. 果树学报, 2008, 25(2): 431-434, 449.
Hoffmann T, Kalinowski G, Schwab W. RNAi-induced silencing of gene expression in strawberry fruit (Fragaria×ananassa) by agroinfiltration: a rapid assay for gene function analysis[J]. The Plant Journal, 2006, 48: 818-826.
