剑麻PGIP基因克隆和表达研究
2019-01-09张燕梅王瑞芳杨子平李俊峰鹿志伟赵艳龙陆军迎周文钊
张燕梅 王瑞芳 杨子平 李俊峰 鹿志伟 赵艳龙 陆军迎 周文钊

摘 要 多聚半乳糖醛酸酶抑制蛋白(polygalacturonase inhibitor proteins, PGIPs)是一類与植物自身免疫相关的多功能蛋白, 在植物防卫反应中扮演着重要角色。为了探讨剑麻PGIP基因的功能,本研究利用PCR的方法从剑麻H.11648中克隆2个剑麻PGIP基因——AhPGIP1和AhPGIP2。利用荧光定量PCR(qRT-PCR)分析AhPGIP1和AhPGIP2基因在烟草疫霉侵染、伤害、低温、盐胁迫、水杨酸(SA)和茉莉酸甲酯(MeJA)处理后的表达模式。结果表明:AhPGIP1基因 cDNA全长为1008 bp,编码335个氨基酸,蛋白分子量约为36.7 kDa,等电点为8.65。AhPGIP2基因全长为981 bp,编码326个氨基酸,蛋白分子量约为35.8 kDa,等电点为8.98。AhPGIP1基因在烟草疫霉侵染过程中表达水平先下降后明显上升,侵染48 h达到最大值,在盐、伤、SA和MeJA处理后表达水平明显上升,分别在3、12、3、12 h达到最大值,低温处理6 h表达水平不变,3、12、24 h表达水平明显下降。AhPGIP2基因在烟草疫霉侵染24 、36、48 h表达水平明显下降,侵染72 h明显上升并达到最大值,在盐胁迫、低温、SA和MeJA处理后表达水平明显上升,分别在3、24、3、12 h达到最大值,在伤处理12 h后显著上升并达到最高水平,在3、6、24 h明显下降。本研究为深入探讨剑麻PGIP基因在不同逆境胁迫反应中的功能奠定了基础。
关键词 剑麻;qRT-PCR;基因表达;PGIP
中图分类号 S563.8 文献标识码 A
Cloning and Expression Analysis of Polygalacturonase-inhibiting Protein in Sisal
ZHANG Yanmei, WANG Ruifang, YANG Ziping, LI Junfeng, LU Zhiwei, ZHAO Yanlong, LU Junying, ZHOU Wenzhao*
South Subtropical Crops Research Institute, Chinese Academy of Tropical Agricultural Sciences / Zhanjiang City Key Laboratory for Tropical Crops Genetic Improvement, Zhanjiang, Guangdong 524091, China
Abstract Polygalacturonase-inhibiting proteins (PGIPs), a group of plant defense proteins, play a crucial role in plant defense reaction. In order to excavate the important function of AhPGIPs, the study cloned AhPGIP1 and AhPGIP2 from H.11648 by PCR. The expression levels of AhPGIP1 and AhPGIP2 were analyzed in sisal H.11648 under several treatments, including Phytophthora nicotianae Breda, methyl jasmonate (MeJA), salicylic acid (SA), salt, low temperature and wounding by fluorescence quantitative PCR (qRT-PCR) technique. The results showed that the full-length cDNA of AhPGIP1 contained 1008 bp and was predicted to encode a protein of 335 amino acids with a theoretical molecular mass of 36.7 kDa and pI of 8.65. The full-length cDNA of AhPGIP2 contained 981 bp, and was predicted to encode a protein of 326 amino acids with a theoretical molecular mass of 35.8 kDa and pI of 8.98. The expression level of AhPGIP1 was not changed at 24 h and then significantly up-regulated by Phytophthora nicotianae Breda, and reached the max value after inoculating 48 h, and was up-regulated by MeJA, SA, salt, and wounding, and reached the max value after stresses 3, 12, 3 and 12 h, respectively. The expression level of AhPGIP1 was not changed by low temperature at 6 h and significantly down-regulated at 3, 12 and 24 h. The expression level of AhPGIP2 was significantly down-regulated at 24, 36 and 48 h and up-regulated at 72 h by Phytophthora nicotianae Breda, was significantly up-regulated by salt, low temperature, SA and MeJA, and reached the max value after stresses 3, 24, 3 and 12 h respectively. The expression level of AhPGIP2 was significantly up-regulated and reached the max value after stress 12 h by wounding, and significantly down-regulated after stress 3, 6, and 24 h. The study laid a solid foundation for further exploration of the function of AhPGIPs.
Keywords sisal; qRT-PCR; gene expression; PGIP
DOI 10.3969/j.issn.1000-2561.2019.12.012
多聚半乳糖醛酸酶抑制蛋白(PGIPs)属于LRR蛋白,如大多数R蛋白和PAMP受體一样,含有典型的LRR结构域(通常为10个),每一个LRR 由20~30个氨基酸组成,且氨基酸序列通常为 LxxLxxLxxLxLxxNxLt/sgxIPxx [1-3]。研究表明PGIPs在植物防御反应中发挥着重要的作用。其作用机制是通过与病原分泌的多聚半乳糖醛酸酶(polygalacturonase, PG)特异性结合抑制PGs活性,减少PGs对植物细胞壁的伤害。同时通过PGs和PGIPs的相互作用促进寡聚半乳糖醛酸苷(OGs)的形成,激发一系列的防御反应,从而提高植物对病原真菌[4-5]、卵菌[6]、细菌[7]和昆虫[8]等的抗性。截至2018年,在NCBI数据库已经公布了329个植物PGIP基因的全部或部分序列,研究表明氨基酸的突变[9]、超表达本体或外源PGIP基因,可提高植物对病原物的抗性,并且在拟南芥[9]、烟草[6]、小麦[12]、油菜[4]、马铃薯[7]、棉花[10-11]、水稻[13]、菜豆[5]以及苹果[14]等多种植物中均有报道。同时超表达PGIP基因可使细胞壁结构和组成成分发生改变[4, 9],PRs、EDS1以及PAD4等抗病相关基因表达上调[4, 11],而沉默PGIP基因则增加植物对病原菌的敏感性[11, 15]。因此,该基因在植物抗病相关遗传改良中有十分重要的作用。此外,病原菌[9, 11, 16]、SA[9, 11, 16]、MeJA[11, 17]、ABA[16]、盐胁迫[16]、低温[16]、伤[9, 11]、H2O2[11]等逆境胁迫均可诱导PGIP基因表达上调。
剑麻是我国热区特有的经济作物之一。剑麻不仅是主要的热带纤维原料;剑麻茎心是酿造龙舌兰酒的主要原料[18];剑麻麻渣含有较高皂素[19],可用来制药[20];剑麻也是一种重要的生物质能源[21]。近年来,剑麻作为景天庚代谢的模式植物[22],有非常重要的理论和经济价值。斑马纹病是剑麻主要病害之一,主要由烟草疫霉引起。尽管生产上形成了一套完整的斑马纹病防治方法,但剑麻与烟草疫霉之间的互作关系如何、烟草疫霉是如何致病的、剑麻如何抵御烟草疫霉的浸染等方面仍是空白。
本研究室前期工作中,通过对主栽品种H.11648接种烟草疫霉,然后取不同接种时间的叶片进行转录组测序和表达谱分析,从主栽品种H.11648中筛选2个受烟草疫霉诱导表达显著上调的PGIP基因。 这暗示PGIP基因可能在剑麻抗斑马纹病中发挥重要作用。因此,本研究利用PCR的方法,克隆PGIP基因。通过qRT-PCR分析该基因受烟草疫霉、低温、盐、伤、SA以及MeJA等胁迫处理后的表达变化情况,为进一步揭示该基因的功能提供依据,同时也为剑麻遗传改良提供基因资源。
1 材料与方法
1.1 材料
用于烟草疫霉接种和伤处理的为2年生的剑麻H.11648盆栽苗,用于MeJA、SA、盐和低温处理的为8~10 cm的H.11648组培苗。菌株为本实验室前期分离保存的烟草疫霉(Phytophthora nicotianae Breda)。
1.2 方法
1.2.1 材料处理 (1)病原接种:将保存于PDA斜面的烟草疫霉转接到V8培养基上,28 ℃培养1周后接种。接种前先用酒精棉反复擦拭叶片,然后用灭菌大头针刺伤叶片表面。取直径0.5 cm大小的菌饼将带菌丝面贴于伤口处,用棉花保湿,每隔2 h加一次水。每3个生物学重复当作1个处理,每个处理重复3次。分别在接种0、24、36、48、72 h取H.11648叶片,经液氮速冻后80 ℃保存备用。
(2)激素处理:取8~10 cm的剑麻组培苗,分别在培养基中加入1 mL SA (10 mmol/L)和MeJA(1 mmol/L)溶液。每瓶苗当做1个处理,每个处理重复3次。分别在处理前(0 h)、处理3、6、12、24 h取组培苗叶片,液氮速冻后80 ℃保存备用。
(3)盐胁迫(NaCl)处理:取8~10 cm的剑麻组培苗,在培养基中加入1 mL NaCl(100 mmol/L)溶液。每瓶苗当做1个处理,每个处理重复3次。分别在处理前(0 h)、处理3、6、12、24 h取组培苗叶片,液氮速冻后80 ℃保存备用。
(4)伤处理:取2年生的剑麻盆栽苗,选取健康的叶片擦净消毒后,用消毒的大头针将叶片表面划伤但不能穿破背面。每株当做1个处理,每个处理重复3次。分别在处理前(0 h)、处理3、6、12、24 h取伤处理叶片,液氮速冻后80 ℃保存备用。
(5)低温处理:取8~10 cm的剑麻组培苗,置于4 ℃培养箱中。每瓶苗当做1个处理,每个处理重复3次。分别在处理前(0 h)、处理3、6、12、24 h取组培苗叶片,液氮速冻后80 ℃保存备用。
1.2.2 RNA提取和cDNA合成 采用超快型植物RNA提取试剂盒(北京华越洋生物科技有限公司)提取叶片总RNA。经检测后取0.5 ?g总RNA反转成第一链cDNA,反转录试剂盒为TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(Transgen)。所得cDNA稀释5倍后用于qRT-PCR分析。所有操作均按试剂盒说明书进行。
1.2.3 PGIP基因克隆与序列分析 根据转录组序列,采用Primer 3.0[23]在线引物设计软件设计PGIP基因特异性引物。引物由生工生物工程(上海)股份有限公司合成,引物序列如表1所示。20 ?L PCR反应体系中各组份的浓度及使用量:2×NOVA Taq-Plus PCR Forest Mix(江苏愚公生命科技有限公司):10 ?L;引物(10 μmol/L)F:0.2 ?L,R:0.2 ?L;cDNA:1 ?L;灭菌ddH2O:8.6 ?L。
PCR扩增程序:先95 ℃(5 min), 然后进入35个循环(95 ℃(30 s),58 ℃(1 min),72 ℃(30 s),最后72 ℃(10 min),扩增产物4 ℃保存备用。
PCR产物切胶回收后与pMD19-T载体连接,转化大肠杆菌DH5α,选取阳性克隆PCR检测合格后送华大基因测序。测序结果经NCBI比对分析,确定PGIP基因全长序列。
运用ExPASy(http://web.expasy.org)和SignalP 4.1 server(http://www.cbs.dtu.dk/services/ SignalP/)[24]软件对AhPGIP1和AhPGIP2基因编码蛋白的理化性质进行分析,主要包括蛋白氨基酸组成、蛋白分子量和等电点、信号肽等。分别利用SMART(http://smart.embl-heidelberg.de)、DNAMAN和MEGA 5软件进行蛋白结构域预测、蛋白序列同源性分析并构建进化树。
1.2.4 PGIP基因表达分析 根据基因序列设计荧光定量PCR引物,引物序列如表1所示。qRT-PCR在LightCycler 480Ⅱ(Roche)荧光定量PCR仪上进行。20 ?L反应体系:2×TransStart Tip Green qPCRSuperMix(Transgen),10 ?L;正反向引物(10 ?mol/L),各0.4 ?L;cDNA模板,1 ?L;无RNase水,8.2 ?L。反应程序为:95 ℃(1 min),然后进入45个循环(95 ℃(10 s),62 ℃(30 s),72 ℃(10 s)),重复3次。
1.3 数据处理
荧光定量PCR后,仪器会自动得出Ct值。以GAPDH为内参基因,相对表达量参照Livak等[25]的2CT方法进行分析。
2 结果与分析
2.1 PGIP基因克隆与序列分析
RT-PCR产物经克隆得到(图1)。测序表明,AhPGIP1基因全长为1008 bp,编码335个氨基酸,前25个氨基酸残基是信号肽序列。含10个高度保守的半胱氨酸残基,6个在N端,4个在C末端,有2个糖基化位点。AhPGIP2基因全长为981 bp,编码326个氨基酸。其中前24个氨基酸残基是信号肽序列,含11个高度保守的半胱氨酸残基,6个在N端,5个在C末端,有3个糖基化位点。AhPGIP1 和AhPGIP2基因编码蛋白均含有典型的LRR胞外序列LxxLxxLxxLx Lxx Nx Lx GxIPxx(图2和图4)。运用ExPASy软件对AhPGIP1和AhPGIP2基因编码蛋白氨基酸序列进行分析,推测AhPGIP1蛋白的理论分子量约为36.7 kDa,等电点为8.65。AhPGIP2蛋白的理论分子量约为35.8 kDa,等电点为8.98。
2.2 剑麻AhPGIP基因编码蛋白信号肽分析
利用SignalP 4.1 server对AhPGIP1和AhPG IP2基因编码蛋白进行信号肽分析。结果表明AhPGIP1和AhPGIP2基因编码蛋白含有信号肽的可能性均大于0.9,且Signal-HMM分析结果与Signal-NN预测结果一致。其中,AhPGIP1基因编码蛋白的剪切位点在第25和26号氨基酸残基之间,信号肽长度为25个氨基酸残基。AhPGIP2基因编码蛋白的剪切位点在第24号和第25号氨基酸残基之间,该蛋白的N端有24个氨基酸残基,可形成一个疏水性的信号肽(图3)。
2.3 PGIP同源序列比对与系统进化树分析
利用DNAMAN软件将AhPGIP蛋白与NCBI去冗余蛋白组数据库(http://blast.ncbi.nlm. nih.gov/))BLAST比对结果中与AhPGIP相似的蛋白序列(如芦笋、海枣、甜橙、玉米等)一起进行同源性分析。结果显示AhPGIP1和AhPGIP2基因编码蛋白与其他物种的PGIP蛋白同源性达到59.98%,且都含有典型的LRR结构域(图4)。
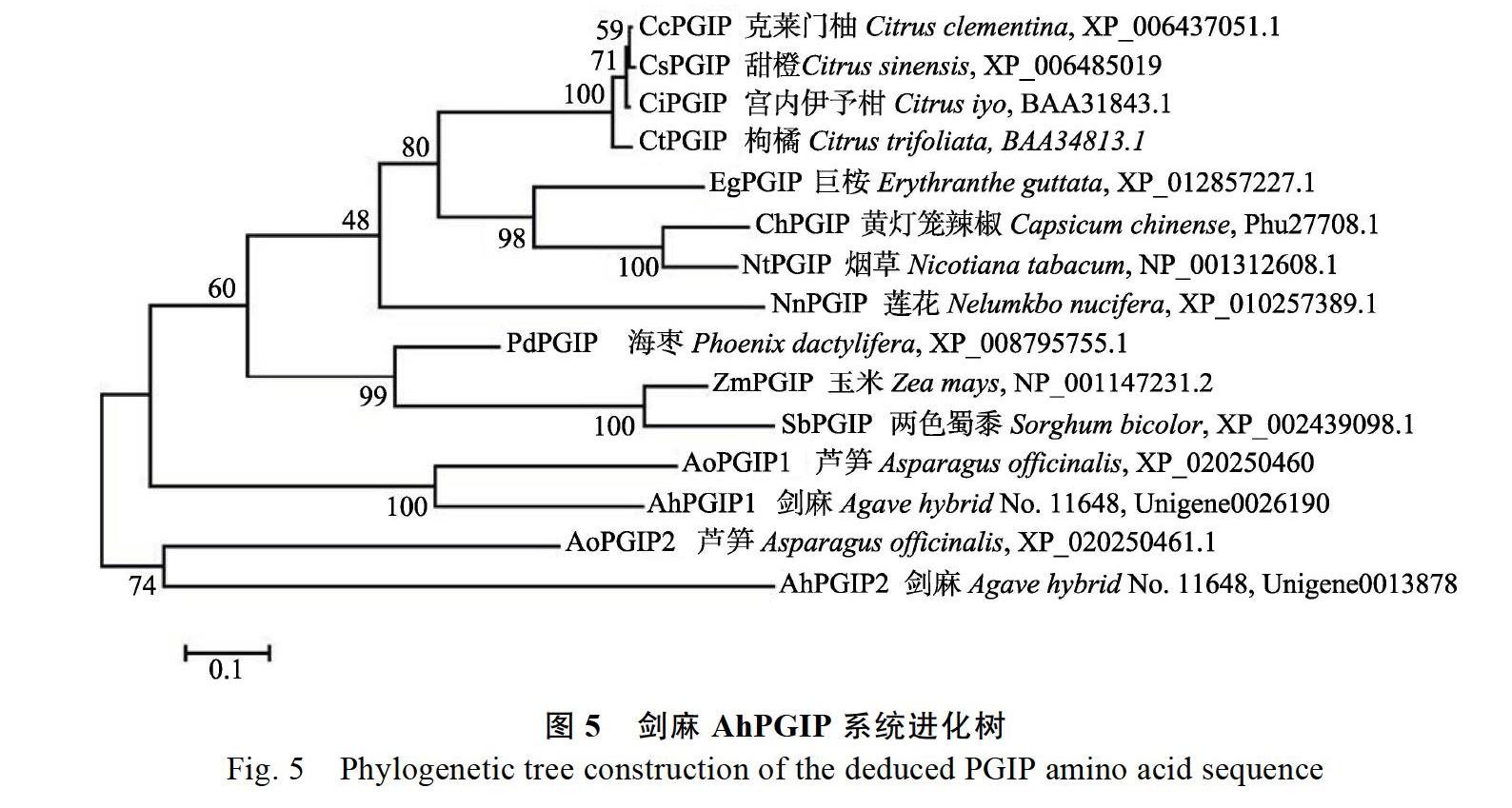
利用MEGA5软件将NCBI去冗余蛋白组数据库(http://blast.ncbi.nlm.nih.gov/)BLAST比对结果中与AhPGIP相似的蛋白序列(如芦笋、海枣、甜橙、玉米等),连同AhPGIP蛋白序列一起,构建PGIP蛋白进化树。结果表明,AhPGIP1基因编码蛋白与AoPGIP1的同源性较高,AhPGIP2基因编码蛋白与AoPGIP2的同源性较高。由此推断,剑麻AhPGIP蛋白与芦笋的PGIP蛋白亲缘关系较近,与玉米、海枣、甜橙等其他物种关系较远,暗示AhPGIP和AoPGIP可能有相似的特征和功能(图5)。
标下划线的为信号肽,加粗的为保守的半胱氨酸残基,斜体加粗的为糖基化位点,方框加粗的为LRR基序。
方框标注的为10个保守的LRR序列,AoPGIP1:芦笋,XP_020250460;PdPGIP:海枣,XP_008795755.1;CsPGIP:甜橙,XP_006485019;NnPGIP:莲花,XP_010257389.1;CcPGIP:克莱门柚,XP_006437051.1;ZmPGIP:玉米,NP_001147231.2;CiPGIP:宫内伊予柑,BAA31843.1;ChPGIP:黄灯笼椒,Phu27708.1;SbPGIP:两色蜀黍,XP_002439098.1;CtPGIP:枸橘,BAA34813.1;AoPGIP2:芦笋,XP_020250461.1;NtPGIP:烟草,NP_001312608.1;EgPGIP:巨桉,XP_012857227.1;AhPGIP1:劍麻,Unigene0026190;AhPGIP2:剑麻,Unigene0013878。
Ten conserved LRR sequences are highlighted in boxes. AoPGIP1: Asparagus officinalis, XP_020250460; PdPGIP: Phoenix dactylifera, XP_008795755.1; CsPGIP: Citrus sinensis, XP_006485019; NnPGIP: Nelumbo nucifera, XP_010257389.1; CcPGIP: Citrus clementina, XP_006437051.1; ZmPGIP: Zea mays, NP_001147231.2; CiPGIP: Citrus iyo, BAA31843.1; ChPGIP: Capsicum chinense, Phu27708.1;SbPGIP: Sorghum bicolor, XP_002439098.1; CtPGIP: Citrus trifoliata, BAA34813.1; AoPGIP2: Asparagus officinalis, XP_020250461.1; NtPGIP: Nicotiana tabacum, NP_001312608.1; EgPGIP: Erythranthe guttata, XP_012857227.1; AhPGIP1: Agave hybrid No.11648,Unigene0026190;AhPGIP2: Agave hybrid No.11648, Unigene0013878.
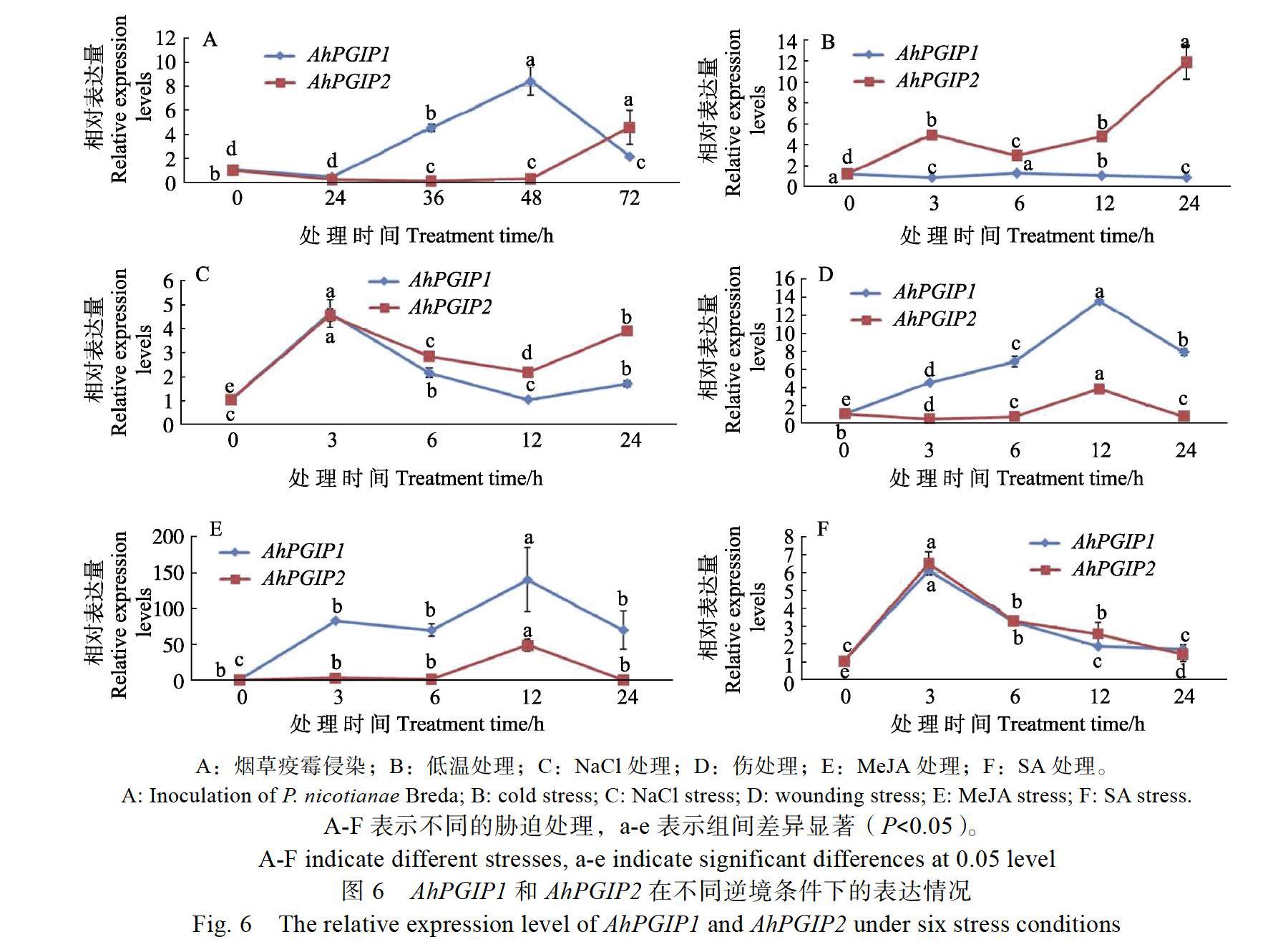
2.4 剑麻AhPGIP基因不同逆境胁迫下表达模式分析
剑麻AhPGIP基因在不同逆境胁迫下表达模式如图6所示。与对照相比(0 h),AhPGIP1在烟草疫霉侵染24 h时,表达水平略有下降但不显著,在侵染36、48、72 h表达水平明显上升,且48 h达到最高。在低温处理3、12、24 h,AhPGIP1表达水平显著下降,在6 h表达水平明显上升。NaCl处理3 h, 表达水平急剧上升且达到最高水平,6、12 h明显下降并恢复到对照水平,在处理24 h表达水平又显著上升。在伤处理过程中,AhPGIP1表达水平明显上升,在12 h 表达水平达到最高。在MeJA 处理过程中,AhPGIP1表达水平明显上升,在12 h达到最高。在SA处理过程中,AhPGIP1表达水平先明显上升,在3 h达到最高,在6、12 h略有下降,在24 h恢复到正常表达水平(0 h)。与对照相比(0 h),AhPGIP2在烟草疫霉侵染24、36、48 h时表达水平明显下降,在36 h达到最低,在72 h表达水平明显上升,达到最高水平。在低温处理过程中,AhPGIP2表达水平明显上升,24 h达到最高。在NaCl处理过程中,AhPGIP2表达水平先明显上升,在3 h达到最高,在12 h达到正常表达水平,在24 h又明显上升。在伤处理过程中,AhPGIP2表达水平在3、6 h明显下降,在12 h表达水平明显上升并达到最高水平,在24 h又显著下降。在MeJA处理过程中,AhPGIP2表达水平在12 h明显上升且达到最高水平,在3、6、24 h表达水平相对于对照没明显变化。在SA处理过程中,AhPGIP2表达水平先明显上升,在3 h达到最高,在6、12、24 h略有下降,但均高于对照(0 h)。
3 讨论
植物细胞壁富含多糖,是植物抵御病原入侵的第一道天然屏障。病原微生物为了成功的侵入植物,常常需分泌一些降解细胞壁的酶,如多聚半乳糖醛酸酶(PGs),果胶甲酯酶(PME)和果胶裂解酶等,其中PGs是侵染早期的一种重要的酶。其主要是通过水解半乳糖酸残基之间的α-(1-4)糖苷键来降解果胶,破坏细胞壁的完成性,从中获得自身需要的营养[26]。同时植物为了躲避病原菌的入侵,也形成了一系列的防御机制,PGIP便是其中之一。它可以特异性与PG结合,抑制PG活性,同时激发寄主自身的防御反应[27]。
本研究从剑麻H.11648中克隆了2个PGIP基因(AhPGIP1和AhPGIP2)。在烟草疫霉侵染过程中AhPGIP1和AhPGIP2的表达水平呈现不同的表达模式,且AhPGIP1在侵染早起表达水平不变然后显著上升,AhPGIP2在侵染早期明显下降(24、36、48 h)后显著上升的趋势,这与Liu等[10-11]报道的相反。Liu等研究表明,棉花在接种黄萎病菌的过程中,随着时间延长,GhPGIP1表达水平不断显著上升,而且沉默GhPGIP1,棉花对黄萎病菌的抗性显著下降,从而证实GhPGIP1参与了棉花抗黄萎病。张燕梅等[28]对表型的研究发现,在剑麻接种烟草疫霉36 h,H.11648叶片表面可见明显病斑,附着胞已经出现,从而表明烟草疫霉在36 h已经成功侵入到H.11648细胞中。而本研究表明AhPGIP1和AhPGIP2的表达水平分别在36 h和48 h才开始上升。按照PGIP与PGs互作原理,AhPGIP表达水平降低, AhPGIP与PG结合活性降低。即使在后期表达水平升高了,也不能抑制病原菌的侵染,同时也无法快速诱导植物自身的防御反应,这可能是导致H.11648发病的原因。
AhPGIP1和AhPGIP2在低温和伤胁迫过程中呈现不同的表达模式,这在拟南芥等作物中也有报道。Ferrari等[29]研究发现,拟南芥AtPGIP1和AtPGIP2表达受不同的信号通路调控。其中AtPGIP1受OGs诱导显著上调,但不受SA、MeJA和乙烯诱导。AtPGIP2则受MeJA诱导,因此推测,剑麻AhPGIP1和AhPGIP2基因也可能参与不同信号通路。另外AhPGIP1和AhPGIP2在盐胁迫、MeJA和SA胁迫过程中表达上调且表达模式一致,这与Liu等[11]、Wang等[30]研究结果一致。以上研究结果同时表明,不同AhPGIP家族成员间的表达调控是十分复杂的。此外,PGIP除了受傷、盐、低温、SA、MeJA和病原菌诱导表达上调外,也可被OG、萘乙酸(NAA)、吲哚乙酸(IAA),脱落酸(ABA)、铝、Low-pH等诱导表达上调[29, 31-32]。
AhPGIP1和AhPGIP2基因受煙草疫霉、信号分子SA、MeJA、伤以及低温、盐等多种逆境胁迫诱导表达,但是否可抑制PG活性、如何参与剑麻的防御应答反应及信号调控通路,还需要更深入的探讨。
参考文献
Kajava A V, Vassart G, Wodak S J. Modeling of the three-dimensional structure of proteins with typical leucine-rich repeats[J]. Structure, 1995, 3(9): 867-877.
Di Matteo A, Bonivento D, Tsernoglou D, et al. Polygalacturonase-inhibiting protein (PGIP) in plant defence: a structural view[J]. Phytochemistry, 2006, 67(6): 528-533.
Di Matteo A, Federici L, Mattei B, et al. The crystal structure of polygalacturonase-inhibiting protein (PGIP), a leucine- rich repeat protein involved in plant defense[J]. Proceedings of the National Academy of Sciences of the United States of America , 2003, 100(17): 10124-10128.
Zhangrong W, Lili W, Qiang X, et al. Overexpression of OsPGIP2 confers Sclerotinia sclerotiorum resistance in Brassica napus through increased activation of defense mechanisms[J]. Journal Experimental Botany, 2018, 69(12): 3141-3155.
Vasconcellos R C C, Lima T F C, Fernandes-Brum C N, et al. Expression and validation of PvPGIP genes for resistance to white mold (Sclerotinia sclerotiorum) in common beans (Phaseolus vulgaris L.) [J]. Genetics and Molecular Research, 2016, 15(3): 15038269.
Borras-Hidalgo O, Caprari C, Hernandez-Estevez I, et al. A gene for plant protection: expression of a bean polygalac- turonase inhibitor in tobacco confers a strong resistance against Rhizocto-niasolani and two oomycetes[J]. Frontiers in Plant Science, 2012, 3: 268.
Schacht T, Unger C, Pich A, et al. Endo- and exopolygalacturonases of Ralstonia solanacearum are inhibited by polygalacturonase-inhibiting protein (PGIP) activity in tomato stem extracts[J]. Plant Physiology and Biochemistry, 2011, 49(4): 377-387.
Kaewwongwal A, Chen J, Somta P, et al. Novel alleles of two tightly linked genes encoding polygalacturonase- inhibiting proteins (VrPGIP1 and VrPGIP2) associated with the Br locus that confer bruchid (Callosobruchus spp.) resistance to mungbean (Vigna radiata) accession V2709[J]. Frontiers in Plant Science, 2017, 8: 1692.
Liu N, Ma X, Zhou S, et al. Molecular and functional characterization of a polygalacturonase-inhibiting protein from Cynanchum komarovii that confers fungal resistance in Arabidopsis[J]. PLoS One, 2016, 11(1): e0146959.
Liu N, Sun Y, Wang P, et al. Mutation of key amino acids in the polygalacturonase-inhibiting proteins CkPGIP1 and GhPGIP1 improves resistance to Verticillium wilt in cotton[J]. The Plant Journal, 2018, 96(3): 546-561.
Liu N, Zhang X, Sun Y, et al. Molecular evidence for the involvement of a polygalacturonase-inhibiting protein, GhPGIP1, in enhanced resistance to Verticillium and Fusarium wilts in cotton[J]. Scientific Reports, 2017, 7: 39840.
Janni M, Sella L, Favaron F, et al. The expression of a Bean PGIP in transgenic wheat confers increased resistance to the fungal pathogen Bipolaris sorokiniana[J]. Molecular Plant- Microbe Interactions, 2008, 21(2): 171-177.
Wang R, Lu L, Pan X. et al. Functional analysis of OsPGIP1 in rice sheath blight resistance[J]. Plant Molecular Biology, 2015, 87(1-2): 181-191.
Matsaunyane L B T, Oelofse D, Dubery L A. In silico analysis of the polygalacturonase inhibiting protein 1 from apple, Malus domestica[J]. BMC Research Notes, 2015, 8(1): 76.
Sarrocco S, Matarese F, Baroncelli R, Vannacci G, et al. The constitutive endopolygalacturonase TvPG2 regulates the induction of plant systemic resistance by Trichoderma virens[J]. Phytopathology, 2017, 107(5): 537-544.
Zhang C, Feng C, Wang J. et al. Cloning, expression analysis and recombinant expression of a gene encoding a polygalacturonase-inhibiting protein from tobacco, Nicotiana tabacum[J]. Heliyon, 2016, 2(5): e00110.
Saavedra G M, Sanfuentes E, Figueroa P M, et al. Independent preharvest applications of methyl jasmonate and chitosan elicit differential upregulation of defense-related genes with reduced incidence of gray mold decay during postharvest storage of fragaria chiloensis fruit[J]. International Journal of Molecular Sciences, 2017, 18(7): 1420.
Corbin K R, Byrt C S, Bauer S, et al. Prospecting for energy-rich renewable raw materials: Agave leaf case study[J]. PLoS One, 2015, 10(8): e0135382.
Escalante A, López Soto D R, Velázquez Gutiérrez J E, et al. Pulque, a traditional Mexican alcoholic fermented beverage: historical, microbiological, and technical aspects[J]. Frontiers in microbiology, 2016, 7: 1026.
Pereira G M, Ribeiro M G, da Silva B P, et al. Structural characterization of a new steroidal saponin from Agave angustifolia var. Marginata and a preliminary investigation of its in vivo antiulcerogenic activity and in vitro membrane permeability property[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(18): 4345-4349.
Mielenz J R, Rodriguez M, Thompson O A, et al. Development of Agave as a dedicated biomass source: production of biofuels from whole plants[J]. Biotechnology for Biofuels, 2015, 8(1): 79.
Stewart J R. Agave as a model CAM crop system for a warming and drying world[J]. Frontier in Plant Science, 2015, 6: 684.
Untergasser A, Cutcutache I, Koressaar T, et al. Primer3- new capabilities and interfaces[J]. Nucleic Acids Research, 2012, 40(15): e115.
Petersen T N, Brunak S, von Heijne G, et al. SignalP 4.0: discriminating signal peptides from transmembrane regions[J]. Nature Methods, 2011, 8(10): 785-786.
Livak K J, and Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2CT method[J]. Method, 2001, 25(4): 402-408.
Lorenzo G D, Ferrari S. Polygalacturonase-inhibiting proteins in defense against phytopathogenic fungi[J]. Current Opinion in Plant Biology, 2002, 5: 295-299.
Benedetti M, Pontiggia D, Raggi S, et al. Plant immunity triggered by engineered in vivo release of oligogalacturonides, damage-associated molecular patterns[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(17): 5533-5538.
張燕梅, 李栋梁, 李俊峰, 等. 烟草疫霉侵染后剑麻H.11648叶片细胞超微结构和防御酶活性研究[J]. 热带作物学报, 2018, 39(6): 1161-1165.
Ferrari S, Vairo D, Ausubel F M, et al. Tandemly duplicated Arabidopsis genes that encode polygalacturonase-inhibiting proteins are regulated coordinately by different signal transduction pathways in response to fungal infection[J]. Plant Cell, 2003, 15(1): 93-106.
Wang X, Zhu X, Tooley P, et al. Cloning and functional analysis of three genes encoding polygalacturonase-inhi biting proteins from Capsicum annuum and transgenic CaPGIP1 in tobacco in relation to increased resistance to two fungal pathogens[J]. Plant Molecular Biology, 2013, 81(4-5): 379-400.
Lu L, Zhou Y, Zhou Y, et al. Expression profile analysis of the polygalacturonase-inhibiting protein genes in rice and their responses to phytohormones and fungal infection[J]. Plant Cell Reports, 2012, 31(7): 1173-1187.
Kobayashi Y, Ohyama Y, Kobayashi Y, et al. STOP2 activates transcription of several genes for Al- and low pH-tolerance that are regulated by STOP1 in Arabidopsis[J]. Molecular Plant, 2014, 7(2): 311-322.
