高压脉冲电场对酿酒酵母发酵能力的影响
2019-01-09范成凯应南娇
范成凯 应南娇 樊 凯 徐 莹 杨 勇
(杭州电子科技大学生命信息与仪器工程学院,浙江杭州 310018)
酿酒酵母(Saccharomyces cerevisiae)是人类生产生活中最重要的微生物菌种之一,被广泛应用于酒品酿造、食品烘焙及生物质乙醇等化合物的生产,在整个发酵过程中发挥着重要的催化作用[1-2]。为了满足巨大的应用需求,人们尝试采用各种方法来提高酿酒酵母的发酵能力,以缩短发酵时间,提高糖类物质转化为乙醇等产物的效率,进而降低生产时间和成本、增加生产效益。近年来,各种新兴的物理辅助技术应用于微生物发酵的潜能越来越受到人们关注。研究表明,静态磁场对酿酒酵母的生长具有促进作用[3-4],低功率超声波也可以提高酿酒酵母发酵过程中乙醇的产出[5-6]。
高压脉冲电场(pulsed electric field,PEF)作为一种非热灭菌技术,因其处理效率高、能耗需求低及对环境无污染等良好的应用特性主要被用于液态食品灭菌领域[7-9],有关PEF对微生物灭菌的机理机制也有诸多研究。随着对PEF技术的深入了解,PEF的应用价值被进一步挖掘且不再局限于微生物灭菌领域。研究表明,PEF作用下植物细胞中花青素等次级代谢产物的合成增加[10-11],Ohshima等[12]研究发现在电场强度为12 kV·cm-1的 PEF处理60 s后,大肠杆菌中的β-半乳糖苷酶的活性得到提高;Yin等[13]研究发现PEF可以提高厌氧氨氧化菌的活性并促进其生长,且与低强度超声波和磁场相比,PEF表现出更高的处理效率。酿酒酵母的发酵建立在细胞内一系列的酶催化反应及良好的生长代谢的基础上。前人研究表明,适当条件下的PEF可以提高酶的活性并促进细胞的生长,这为PEF作为一种更具优势的方法应用于酵母发酵提供了可能性[13]。
目前,有关PEF对酿酒酵母生理行为影响的研究主要集中在食品加工领域中对酵母菌的灭活等方面,而PEF对酿酒酵母发酵能力的影响尚鲜见报道。为了寻求PEF技术应用于酿酒酵母发酵的可行性,本研究以电场强度为唯一变量,采用不同电场强度的PEF刺激酿酒酵母,通过检测发酵底物中酵母生长量、葡萄糖消耗量和乙醇产出量等指标,并利用流式细胞术(flow cytometer,FCM)检测酿酒酵母细胞生理状态的变化,综合分析PEF对酿酒酵母生理状态和发酵能力的影响,以期为PEF技术应用于发酵工业提供理论基础。
1 材料与方法
1.1 酵母菌悬浮液的制备
活性干酵母粉(版号HY1505)购自湖北宜昌安琪酵母公司;酵母液态培养基(yeast extract peptone dextrose medium,YPD):葡萄糖 20 g·L-1、蛋白胨 20 g·L-1、酵母提取物 10 g·L-1;YPD 琼脂固体培养基另加 20 g·L-1琼脂粉。
酵母活化:在100 mL浓度为4%的葡萄糖溶液中加入2 g活性干酵母粉,轻轻混匀后35℃静置15 min,取适量划线至YPD琼脂培养基培养,得到单菌落后接种至YPD液体培养基,摇床培养(30℃,180 r·min-1)至对数生长期备用。
1.2 高压脉冲电场预处理
高压脉冲电场处理系统由杭州电子科技大学研制开发[14]。选定高压脉冲电场脉宽5 μs,频率100 Hz、作用时间100 s、极板间距(d)1 cm、样品处理容量1 mL,输出波形为方波。场强E的计算公式为E=U/d,通过改变电压来改变电场强度。本试验采用PEF电场强度为1、6 kV·cm-1对酿酒酵母进行预处理。
1.3 酿酒酵母荧光染色及流式分析
采用碘化丙啶(propidium iodide,PI)和羧基荧光素双乙酸酯[5(6)-carboxyfluorescein diacetate,5(6)-cFDA]对酿酒细胞进行双重染色,结合流式细胞术(FCM)检测并表征酵母细胞内酯酶活性和酵母细胞生理状态[15]。
酿酒酵母悬浮液经PEF处理后用PBS缓冲液(pH 值 7.2)清洗并离心(4 000 r·min-1,4℃,3 min)2次,然后用PBS缓冲液将酵母细胞重悬至浓度为105~106CFU·mL-1。取1 mL酿酒酵母菌悬液,加入10 μL 2 mg·mL-1PI染液,30℃避光孵育 10 min,然后加入 10 μL 5 mg·mL-15(6)-cFDA 染液,再次 30℃避光孵育10 min,染色完成后用PBS缓冲液清洗2次并重悬至1 mL。以相同体积不进行任何染色的酵母悬浮液作为阴性对照。采用 Accuri C6流式分析仪(美国BD公司)对酵母细胞进行分析,每个样品收集约10 000个细胞。
1.4 酵母发酵培养
酵母发酵培养基:葡萄糖70 g·L-1、酵母提取物5 g·L-1、硫酸铵 1 g·L-1、磷酸二氢铵 1 g·L-1、硫酸镁1 g·L-1。PEF处理后的酵母悬浮液按5%接种量分别转接至发酵培养基,30℃恒温摇床(180 r·min-1)培养12 h,分别取发酵时间为4、8、12 h时的发酵底液,经离心后取上清液,于-80℃冻存备用。
1.5 酿酒酵母发酵活性的检测
1.5.1 发酵底液中葡萄糖、酒精含量的测定 采用高效液相色谱(high performance liquid chromatography,HPLC)法测定酿酒酵母发酵底液中的葡萄糖和酒精含量[16]。色谱分析条件:Shimadzu LC-10AD液相色谱仪(日本岛津),Shimadzu RID-10A示差检测器(日本岛津),Shodex sugar KS-803配位交换色谱柱(日本Shodex);流动相为 H2SO4-H2O 溶液(v/v,0.5 ∶1 000),流速0.8 mL·min-1,进样量0.5 mL,色谱柱柱温为60℃。
1.5.2 发酵底液中酿酒酵母细胞生长量的测定 先取干燥离心管称重,然后加入适量酿酒酵母发酵底液,4℃条件下10 000 r·min-1离心5 min,取沉淀用蒸馏水反复清洗并重复离心3次,弃去上清液后将装有湿菌体的离心管置于65℃烘箱中干燥至恒重,减去离心管重量即得菌体干重。
1.6 数据分析
采用Microsoft Excel 2010和SPSS 9.0统计软件对试验数据进行处理。
2 结果与分析
2.1 PEF处理对酿酒酵母生长量的影响
经测定,发酵12 h后未经PEF处理的酿酒酵母干重为 0.460±0.05 g,电场强度为 1、6 kV·cm-1的 PEF试验组酿酒酵母发酵底物中酵母干重分别为0.512±0.006、0.419±0.027 g。 结果表明,经在电场强度为1 kV·cm-1的PEF处理后酿酒酵母的生长得到提高,即1 kV·cm-1的PEF促进了酿酒酵母细胞的生长。
2.2 酿酒酵母细胞的流式分析
PI染料表征破损及死亡生理状态下的酵母细胞,cFDA染料表征细胞内酯酶活性变化。LL区域表示细胞碎片或未得到PI和5(6)-cFDA染色的菌体,LR区域代表具有活性且细胞膜完整的酵母细胞,UR区域的细胞虽具有活性但是细胞膜受损,UL区域为已死亡细胞。PEF电场强度为1 kV·cm-1处理组中具有活性酿酒酵母细胞比例为89.8%,其中,具有细胞活性但细胞膜受损的比例为17.6%;6 kV·cm-1处理组中具有活性酿酒酵母细胞比例为89.9%,但细胞膜受损的活细胞比例为27.9%(图1)。综上,经电场强度为1、6 kV·cm-1的PEF处理后,具有内酯酶活性的酿酒酵母细胞比例均维持在较高水平,但PEF电场强度为6 kV·cm-1时,在具有活性的酵母细胞中细胞膜受损的比例大于1 kV·cm-1。
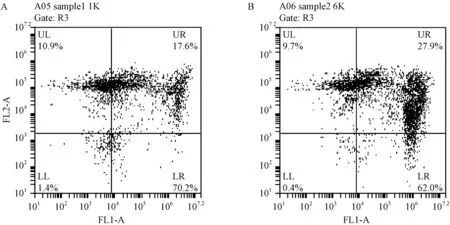
图1 流式细胞仪分析染色酿酒酵母细胞结果Fig.1 Results of flow cytometry analysis of Saccharomyces cerevisiae
2.3 PEF处理对酿酒酵母发酵底物中葡萄糖及酒精含量的影响
葡萄糖是酿酒酵母生长代谢过程所需的重要营养物质之一。乙醇是酿酒酵母发酵的主要产物。发酵底液中葡萄糖和乙醇含量的变化可以作为检测酿酒酵母发酵能力的重要指标。由图2、图3可知,发酵时间为0~8 h时,酿酒酵母的生长和发酵活动较为缓慢,发酵8 h后酿酒酵母发酵底物中的葡萄糖消耗的速度加快,同时乙醇产量也迅速增加,酿酒酵母的生长和代谢开始加速;发酵12 h时,与未经PEF处理组(电场强度0 kV·cm-1)相比,电场强度1 kV·cm-1处理组酿酒酵母发酵底物中葡萄糖消耗量提高了10.18%,乙醇产出量提高11.05%,而6 kV·cm-1处理组组酿酒酵母发酵底液中葡萄糖消耗量和酒精产出量分别下降5.13%和9.06%。综上,电场强度1 kV·cm-1的 PEF处理可提高酿酒酵母的葡萄糖消耗量和酒精含量。
3 讨论
高压脉冲电场处理会导致细胞膜出现“电穿孔”[17-18],提高细胞膜的通透[19-20],进而促进细胞对离子、小分子物质的吸收[21]。细胞增加营养物质的摄取对其自身的生长及代谢具有重要意义。此外,高压脉冲电场可以促进质粒DNA的转运[22]、提高酵母细胞内过氧化氢酶的活性[23]。也有研究证实PEF处理后酿酒酵母细胞中谷胱甘肽合成酶相关的基因被诱导表达[24];酶活性和相关基因表达量的增加也可能是酿酒酵母发酵能力提升的原因。高压脉冲电场会对细胞膜造成一定的损伤,细胞膜受损的部分细胞在适当条件下可恢复其原有活性[25-27],但当高压脉冲电场强度足够大时,细胞膜穿孔将进一步扩大,细胞蛋白质、DNA等大分子内容物外渗,甚至导致酵母细胞死亡[28-29]。因此,保证酿酒酵母的生存率是PEF提高酿酒酵母发酵能力的前提。

图2 PEF处理对发酵底物中葡萄糖相对浓度的影响Fig.2 Effect of PEF treatment on relative glucose concentration of fermentation substrates
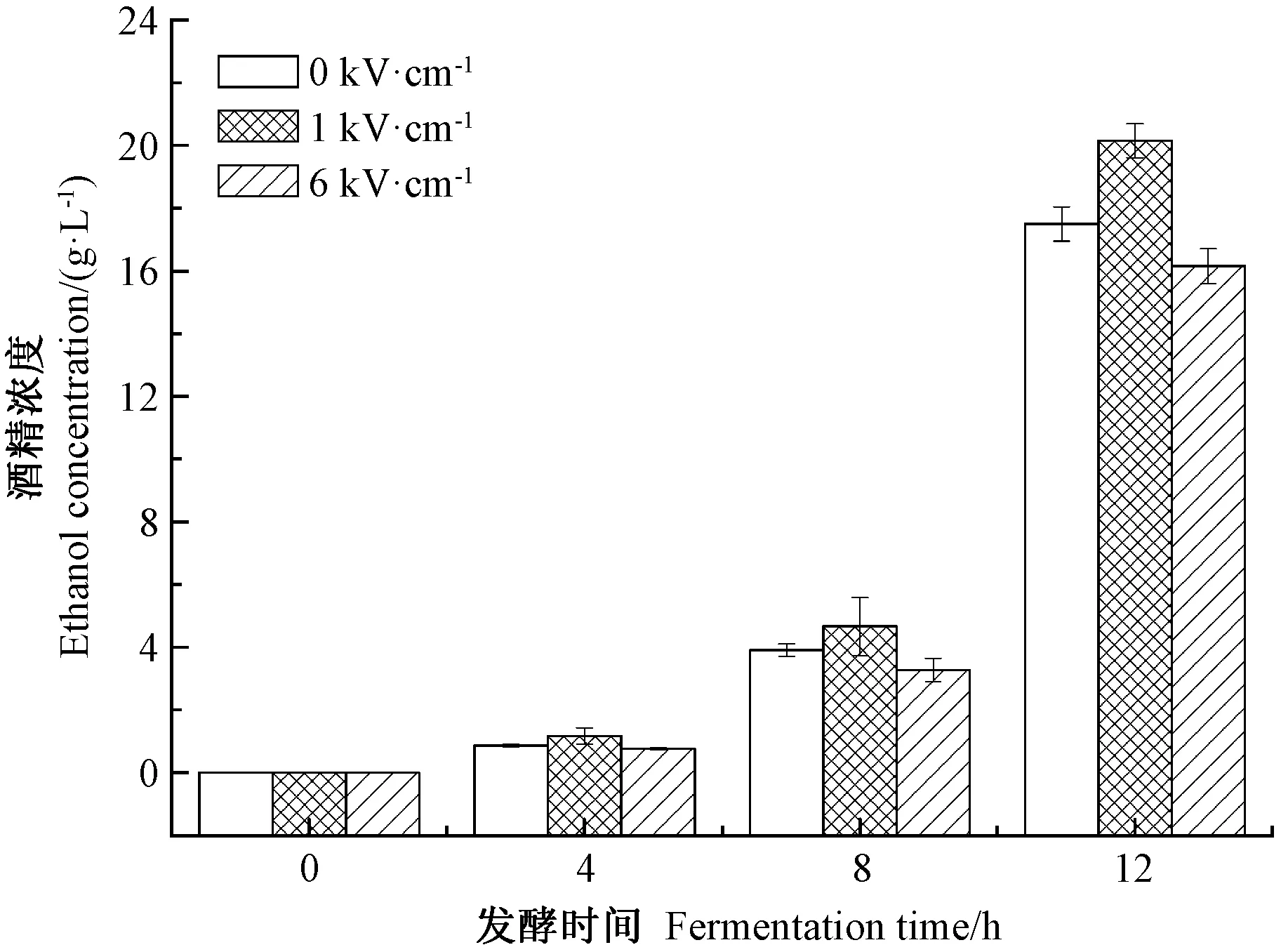
图3 PEF处理对发酵底物中酒精含量的影响Fig.3 Effect of PEF treatment on ethanol concentration of fermentation substrates
本研究通过比较电场强度为1、6 kV·cm-1的PEF对酿酒酵母发酵能力的影响,发现适当条件下的PEF对酿酒酵母的发酵能力具有积极影响,可以加快酵母的生长繁殖,提高乙醇的产出效率。Mattar等[30]进行的PEF刺激酿酒酵母生长的研究结果与本研究结果一致。此外,Najim等[31]研究发现PEF处理后保加利亚乳杆菌表现出对其生存环境更高的耐酸性,后续PEF对酿酒酵母影响的研究也可从酿酒酵母的耐酒精性等外界环境耐受性的角度进行探究。综合本研究中流式细胞术和发酵试验结果分析发现,电场强度为1、6 kV·cm-1的PEF对酿酒酵母的细胞活性和发酵能力表现出不同的影响,经1 kV·cm-1PEF刺激后的酵母细胞表现出更高的生长速率和发酵能力;而6 kV·cm-1组酵母细胞的生长与代谢活动却低于对照组(电场强度0 kV·cm-1),且对酿酒酵母的损伤效应更为明显。因此,选择合适的电场参数对提高酿酒酵母发酵能力具有重要意义。在后续的研究中,可继续深入探究不同电场参数与酿酒酵母发酵表现之间的关系,尽量减小PEF对酵母细胞造成的损伤,以达到提高酿酒酵母发酵能力的最佳效果。
4 结论
高压脉冲电场处理可以促进酿酒酵母细胞的生长和相关代谢活动从而提高酿酒酵母的发酵能力,经电场强度为1 kV·cm-1的PEF处理后的酿酒酵母细胞,其菌体生长量、发酵底物中葡萄糖消耗量和酒精产出量均得到提升,表明选择合适的高压脉冲电场参数对酿酒酵母进行预处理,可以促进其发酵能力。本研究仅就PEF处理对酿酒酵母发酵能力的影响作了初步探讨,今后可从酿酒酵母相关基因和蛋白质表达水平变化的角度,深入研究PEF处理提高酿酒酵母发酵能力的作用机制。
