甘露醇和蔗糖对菊花低温离体保存的影响
2019-01-09王小乐迟天华刘颖鑫王海滨陈发棣房伟民
王小乐 迟天华 刘颖鑫 王海滨 张 飞 陈发棣 房伟民
(南京农业大学园艺学院/农业部景观设计重点实验室,江苏南京 210095)
菊花(Chrysanthemum morifolium)为原产于我国的宿根花卉,是世界四大鲜切花之一,也是我国十大传统名花之一,具有极高的观赏和经济价值[1-2]。目前菊花种质资源主要依靠田间保存,需消耗大量人力物力,且易受到涝害、虫害、病害等影响,导致品种混杂、种性退化,甚至品种丢失[3-5]。
缓慢生长离体保存技术是指在人为控制下,通过改变培养环境、在培养基中添加化学物质等手段,使植株的生长速度减缓,延长继代扩繁的时间,从而达到中长期保存的目的[6]。该技术具有不易受外界环境影响、占据空间小、节省人力和物力、可快速繁殖等特点[7-9],近几年已被广泛运用于黄独[10]、薄荷[11]、千里光[12]等多种园艺作物的种质资源保存。国外已采用离体保存技术保存菊花种质资源[13],但目前在国内相关研究并不常见,王艳芳等[14]研究发现在23±2℃下,利用添加不同蔗糖与甘露醇配比的培养基对切花菊神马试管苗进行离体保存,成活率达到60.00%,但其未采用低温库保存以进一步提高存活率和延长保存周期。此外,菊花不同基因型的生长特性差异明显,对保存条件也有不同要求[15],需要开展进一步研究以形成较为完善的低温离体保存方案。
本试验选取4个田间生长类型差异较大的菊花品种,在7±2℃离体库中研究不同浓度甘露醇、蔗糖对菊花离体保存的影响,以期探索针对不同生长类型菊花品种合适的低温离体保存方案,为菊花种质资源低温离体保存提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
4个田间生长类型差异较大的菊花品种蒙娜丽莎黄、橙安娜、小洋菊和南农橙乒乓无菌苗均来自于南京农业大学中国菊花种质资源保存中心。
1.2 试验方法
1.2.1 4个菊花品种离体生长状况比较 4个品种分别接种10株带1个腋芽的茎段(每试管1株),并均设3次生物学重复,2个月后分别测量各品种菊花的株高、茎粗、节间长等指标。以MS+7 g·L-1琼脂为基本培养基,pH值为5.8±0.2,培养温度为23±2℃,光照强度为 40~50 μmol·m-2s-1,光照时间为 8:00-20:00和23:00-2:00。
1.2.2 试管苗低温离体保存比较 以MS+7.0 g·L-1琼脂为基本培养基,分别添加 45、60、75、90 g·L-1蔗糖和 0(CK)、5、10、15、20 g·L-1的甘露醇,30 g·L-1蔗糖处理作为对照,培养温度为7±2℃外,其他培养条件同1.2.1。每3个月观察统计1次试管苗成活率、绿叶数。
1.2.3 试管苗组织学观察 低温保存12个月后取最优浓度甘露醇处理的蒙娜丽莎黄、橙安娜、小洋菊和南农橙乒乓的茎段、叶片,以常温下MS+7 g·L-1琼脂+30 g·L-1蔗糖培养(60 d继代一次)的试管苗为对照,石蜡切片,番红-固绿染色后置于DM6B荧光显微镜(德国Leica公司)下拍照观察。
1.2.4 恢复生长 低温保存结束后取保存效果最好的处理转至正常条件下恢复培养。恢复培养45 d后测量统计菊花株高、叶片数量、茎粗、节间长度和根系数。
1.2.5 遗传稳定性鉴定 取恢复生长后植株嫩叶,采用CTAB法[16]提取DNA,SSR分子标记检测遗传稳定性;PCR扩增产物用8%非变性聚丙烯酰胺凝胶电泳检测,银染法[17-18]染色。
1.3 数据分析
利用SPASS 20.0和Microsoft Excel 2010对试验数据进行分析。
2 结果与分析
2.1 常温下4个菊花品种离体生长状况比较
由表1可知,培养2个月后,株高从高到低依次为蒙娜丽莎黄>小洋菊>橙安娜>南农橙乒乓,且各品种间差异显著;叶片数也表现为蒙娜丽莎黄>小洋菊>橙安娜>南农橙乒乓,其中蒙娜丽莎黄的叶片数显著多于其他品种;茎粗则表现为南农橙乒乓>橙安娜>小洋菊>蒙娜丽莎黄,南农橙乒乓的茎粗显著大于蒙娜丽莎黄和小洋菊,但与橙安娜无显著差异;节间长表现为蒙娜丽莎黄>小洋菊>橙安娜>南农橙乒乓,其中蒙娜丽莎黄和小洋菊无显著差异,但均显著高于橙安娜和南农橙乒乓;各品种间根系数均无显著差异。综上,4个菊花品种离体条件下生长势存在明显差异,具有较好的代表性。
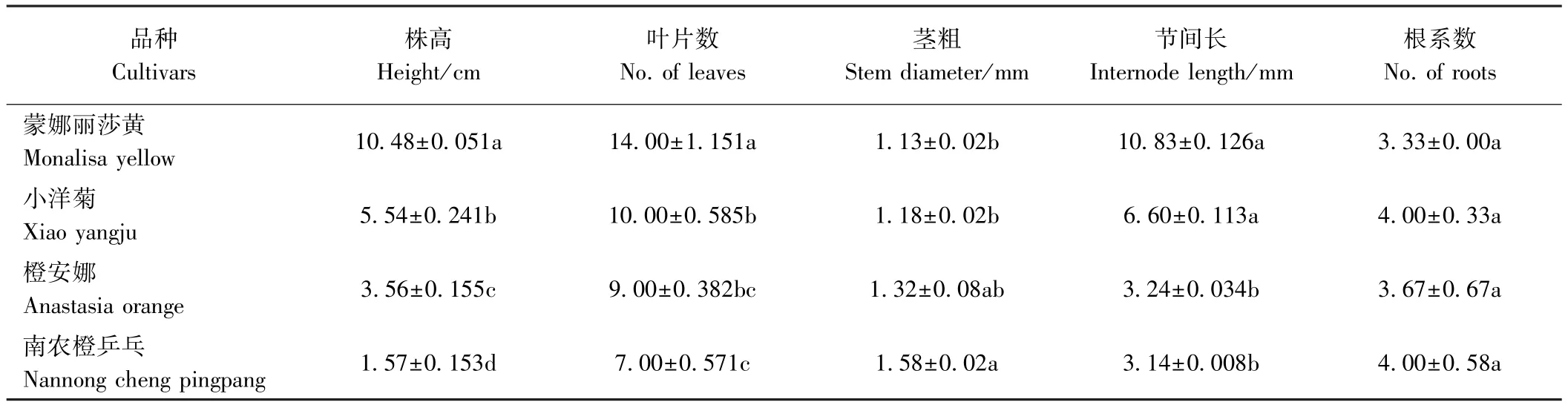
表1 离体培养2个月4个菊花品种的形态指标Table1 Morphological indexes of 4 chrysanthemum cultivars cultured for 2 month in vitro
2.2 不同浓度甘露醇对菊花低温离体保存的影响
由表2可知,9个月之前,各品种菊花不同处理间的存活率差异较小,12个月时各品种菊花间差异明显,随着甘露醇浓度的增加,蒙娜丽莎黄和橙安娜的存活率呈逐渐增加趋势,甘露醇浓度为20 g·L-1时存活率达到最高,分别为80.00%和93.33%;而小洋菊和南农橙乒乓的存活率则随着甘露醇浓度的增加呈先增加后降低的趋势,且均在15 g·L-1甘露醇处理下存活率最高,分别达到93.33%和86.67%。
由图1可知,保存12个月后,不同品种菊花的绿叶数变化趋势与存活率一致。随着甘露醇浓度的增加,蒙娜丽莎黄和南农橙乒乓绿叶数量逐渐增多,且在20 g·L-1甘露醇处理时绿叶数最多,显著高于其他处理;而南农橙乒乓和小洋菊绿叶数随着甘露醇浓度增加,呈先增加后降低的趋势,15 g·L-1甘露醇处理下南农橙乒乓和小洋菊绿叶数均达到最高,生长状态最好。
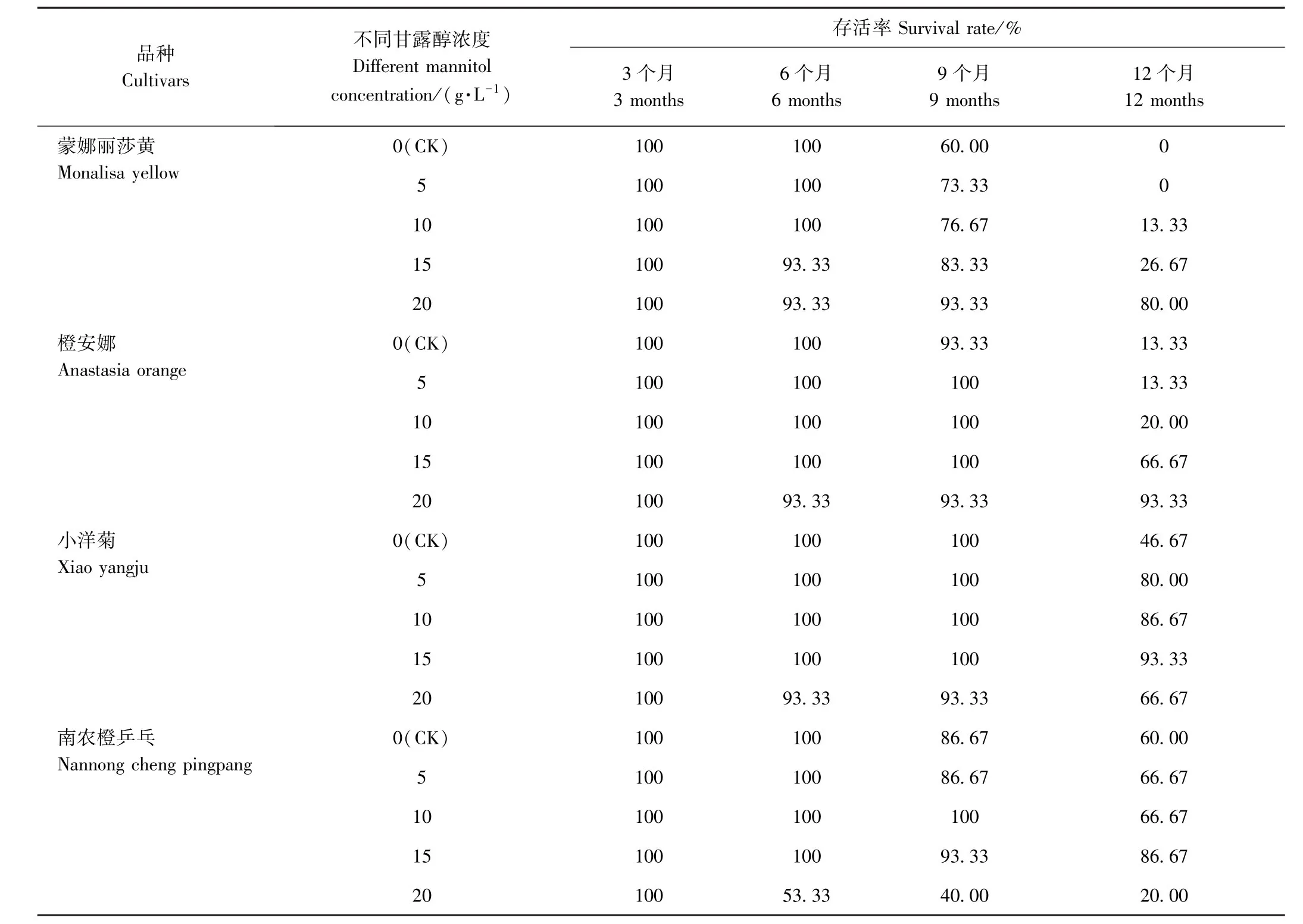
表2 不同浓度甘露醇对菊花低温离体保存存活率的影响Table2 Effect of different concentrations of mannitol on the survival rate of chrysanthemum in vitro conservation at low temperature
综上,15 g·L-1甘露醇对南农橙乒乓和小洋菊保存效果最好,而蒙娜丽莎黄和橙安娜最适甘露醇浓度为20 g·L-1,保存至12个月时,存活率最高,绿叶数最多。
2.3 不同浓度蔗糖对菊花低温离体保存的影响
由表3可知,90 g·L-1高浓度蔗糖处理后的蒙娜丽莎黄、橙安娜和南农橙乒乓存活率大幅下降,到保存12个月时均降为0,而小洋菊保存6个月时的存活率均高于其他3个品种,12个月时存活率仍为26.67%;保存至12个月时,蒙娜丽莎黄各处理均已全部死亡,而其他3个品种存活率随蔗糖浓度的升高,存活率呈先增加后降低的趋势;橙安娜、小洋菊和南农橙乒乓分别在45、60和45(和60)g·L-1蔗糖处理下存活率最高,分别为40.00%、73.33%和73.33%。综上,不同品种菊花离体保存对高浓度蔗糖耐受性存在差异,且蔗糖处理的存活率低于甘露醇处理。
由图2可知,保存至12个月时各品种菊花不同浓度蔗糖处理绿叶数均较少。蒙娜丽莎黄已全部死亡;其他3个品种随蔗糖浓度的增加,均呈先增加后降低的趋势,橙安娜、小洋菊和南农橙乒乓分别在45、60和60 g·L-1蔗糖处理下绿叶数最多。综上,蔗糖处理下4个品种菊花离体保存至12个月后,存活率均较低,且绿叶数少,植株生长状态差,保存效果较甘露醇处理差。
2.4 菊花组织学观察
低温下保存12个月后,将20 g·L-1甘露醇处理的蒙娜丽莎黄和橙安娜、15 g·L-1甘露醇处理的小洋菊和南农橙乒乓与正常2个月继代一次的对照试管苗相比,组织结构均发生了变化。具体表现为4个品种菊花植株叶片厚度变薄,叶肉细胞变小,细胞间隙减小,细胞密度增加(图3);且皮层细胞变小、密度增加(图4)。
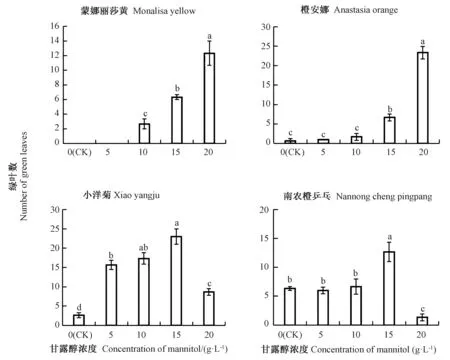
图1 不同浓度甘露醇对菊花低温离体保存绿叶数的影响Fig.1 Effect of different concentrations of mannitol on number of green leaves of chrysanthemum in vitro conservation at low temperature
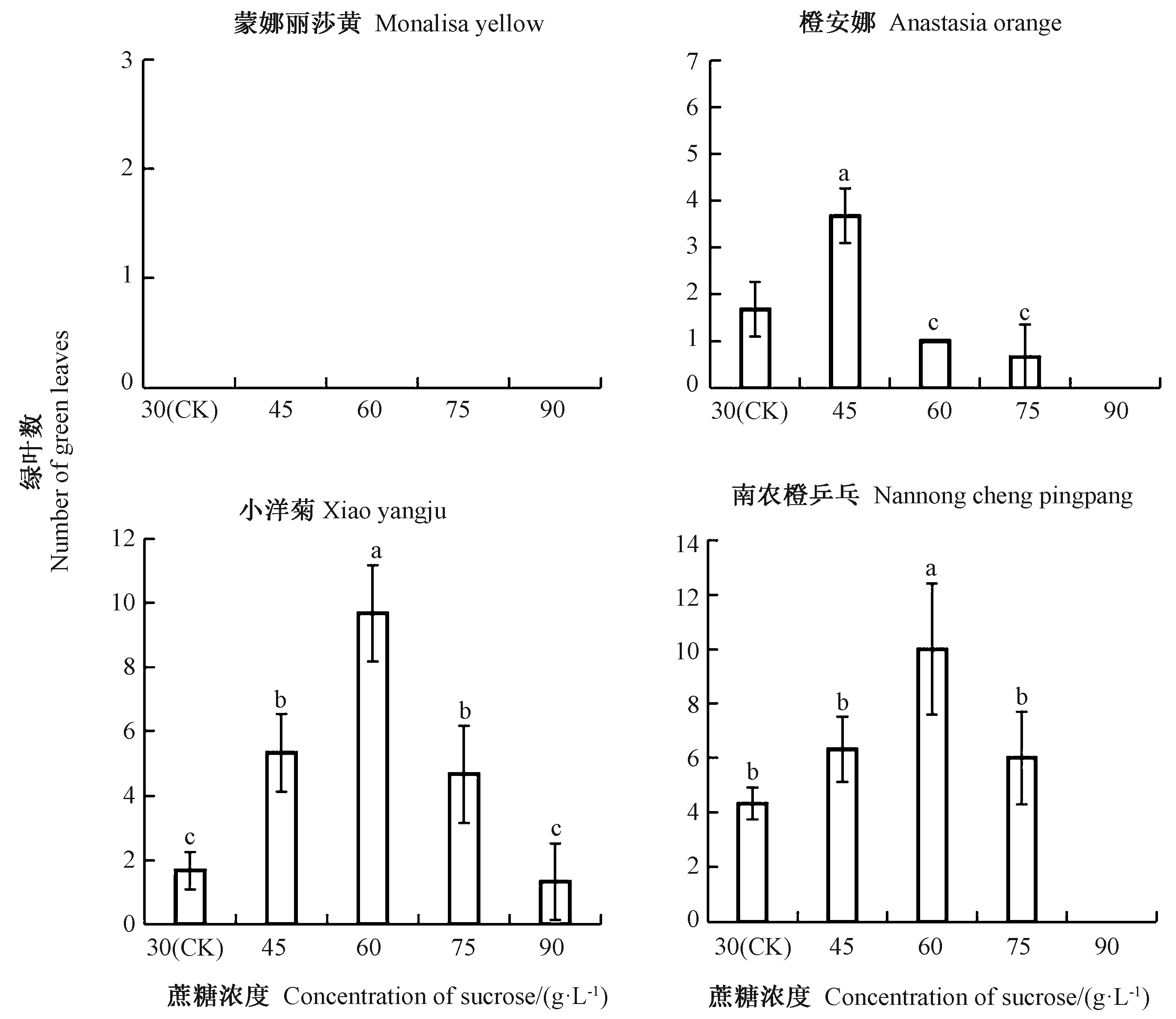
图2 不同浓度蔗糖对菊花低温离体保存绿叶数的影响Fig.2 Effect of different concentrations of sucrose on the number of green leaves of chrysanthemum in vitro conservation at low temperature
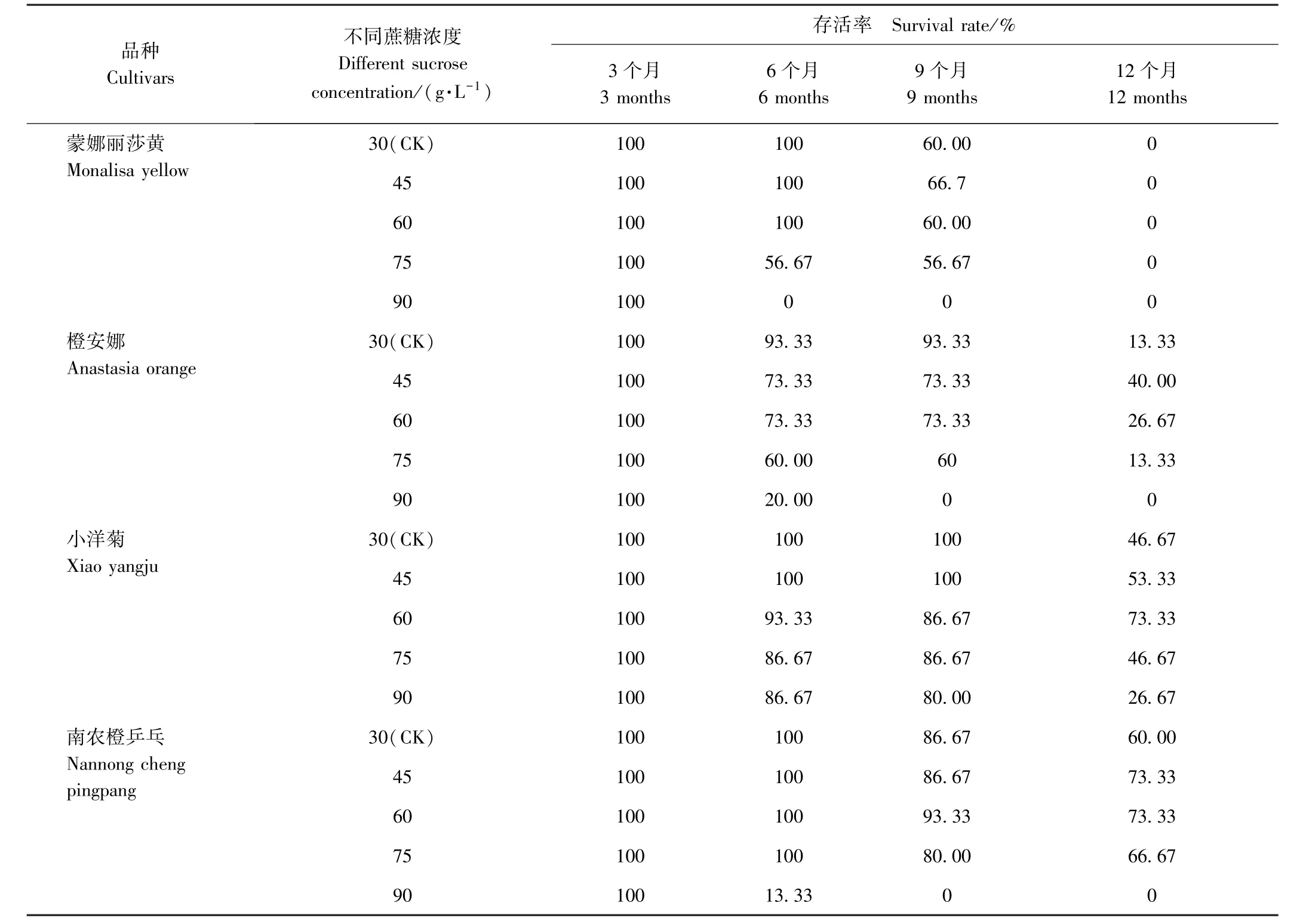
表3 不同浓度蔗糖处理对菊花低温离体保存存活率的影响Table3 Effect of different concentrations of sucrose on the survival rate of chrysanthemum in vitro conservation at low temperature
2.5 试管苗恢复生长和遗传稳定性鉴定
由表4可知,20 g·L-1甘露醇处理的蒙娜丽莎黄和橙安娜低温离体保存结束转移到正常条件下培养可恢复生长,恢复生长后与CK相比,其植株形态正常,株高、茎粗、节间长、叶片数量、根系数等无显著差异。与CK相比,15 g·L-1甘露醇处理的小洋菊恢复生长后其叶片数和根系数无显著差异,而株高和茎粗显著降低,节间长度显著增加;南农橙乒乓节间长度显著增加,其他指标无显著差异。再次继代培养后这2个品种菊花植株形态恢复正常,与CK相比差异不显著。
利用选取的5条随机引物对4个品种菊花再生植株进行SSR分子标记分析,由图5可知,5条随机引物在不同品种间扩增带数介于6~18之间,4个品种菊花引物扩增总条带数分别为61、58、57、61,与对照相比,均未出现变异条带。说明低温离体保存后4个品种菊花再生植株DNA水平上没有发生变化,低温下离体保存结束后保持了良好的遗传稳定性。
3 讨论
研究表明,甘露醇作为渗透调节物质,可形成渗透胁迫造成细胞水分与养分吸收困难、新陈代谢减弱,抑制试管苗的生长从而达到离体保存效果[19-21]。牛爱国等[22]研究表明,10 g·L-1甘露醇可使樱桃试管苗保存7.5个月的存活率达62%;兰伟等[23]研究表明,20 g·L-1甘露醇使香青兰试管苗保存9个月的存活率达40%。本试验在MS培养基中添加15 g·L-1甘露醇可使小洋菊和南农橙乒乓试管苗离体保存至12个月,存活率分别达93.33%、88.67%,与蝴蝶兰[24]、甜叶菊[25]的最适甘露醇浓度一致,大于永春芦柑[26](5 g·L-1),但低于文心兰[27](40 g·L-1),说明不同植物对甘露醇渗透胁迫适应性存在较大差异。此外,本研究还发现添加20 g·L-1甘露醇可使蒙娜丽莎黄和橙安娜试管苗保存至12个月的存活率分别达到80.00%和93.33%,但20 g·L-1甘露醇对小洋菊和南农橙乒乓保存效果不佳,试管苗不生长,叶片紧缩变褐,逐渐死亡。徐志微等[28]研究发现,葡萄品种Melissa在50 g·L-1甘露醇的培养基中保存4个月后存活率可达65%,而巨玫瑰已经全部死亡,表明同种植物不同品种对甘露醇渗透胁迫适应也存在差异。
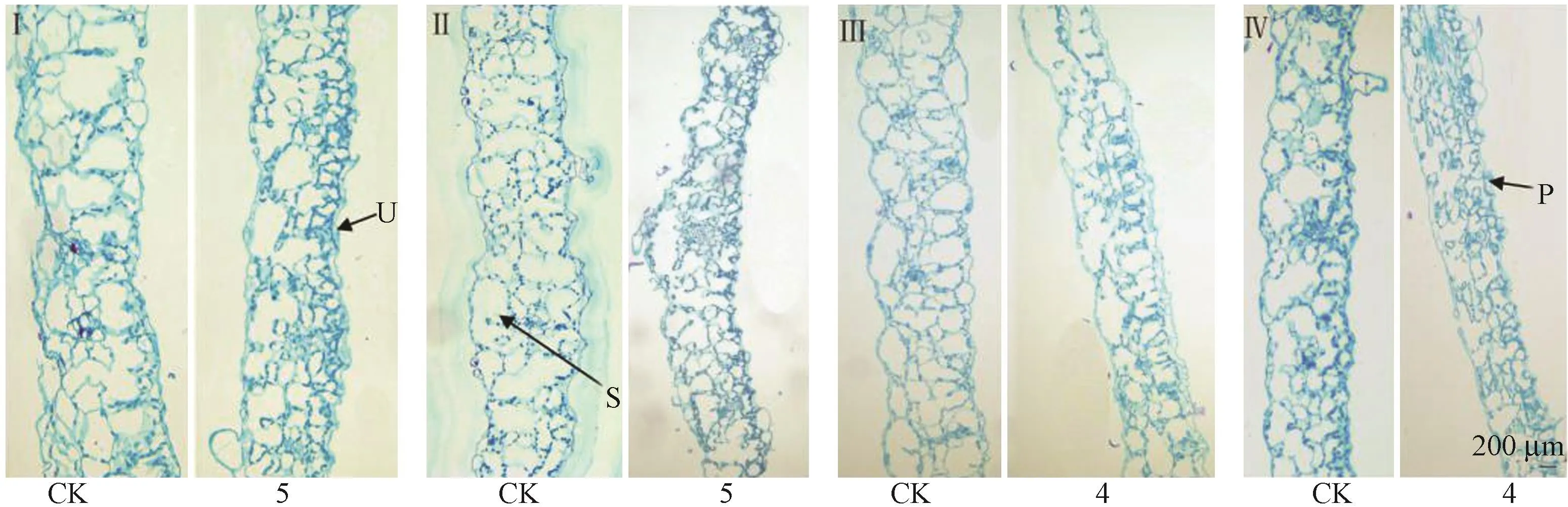
图3 低温离体保存12个月后菊花叶片组织横切观察Fig.3 The cross section of chrysanthemum leaves conserved for 12 months in vitro conservation at low temperature
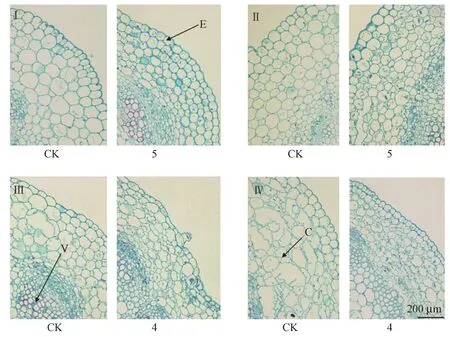
图4 低温离体保存12个月后菊花茎段组织横切观察Fig.4 The cross section of chrysanthemum stem conserved for 12 months in vitro conservation at low temperature
高浓度的蔗糖可通过提高培养基渗透压,抑制试管苗生长,从而延长保存时间[29-31]。本试验结果表明,保存至12个月时除蒙娜丽莎黄全部死亡外,橙安娜、小洋菊和南农橙乒乓分别在45、60和45(和60)g·L-1蔗糖处理下存活率最高,分别为 40.00%、73.33%和73.33%,均高于对照,但试管苗绿叶数少,生长状况差,效果不及甘露醇处理;而75~90 g·L-1蔗糖使试管苗植株生长高度减小、节间长度缩短,腋芽不萌发并逐渐变褐死亡,表明已对植株生长产生毒害作用。研究表明,高浓度的蔗糖对纪伊潮野菊[32]、木薯[33]、麦冬[34]等多种植物生长也会产生毒害作用。此外,本试验发现小洋菊和南农橙乒乓对高浓度蔗糖的耐性明显高于蒙娜丽莎黄和橙安娜,表明不同品种对蔗糖耐性也不同。有研究发现海枣Bartamoda在60 g·L-1蔗糖培养基保存至12个月存活率达55%,而Sakkoty已全部死亡[35]。不同植物对蔗糖耐性也不同,如大花卷丹离体保存适宜蔗糖浓度为90~110 g·L-1[36],东方百合西伯利亚为 60~90 g·L-1[37]。
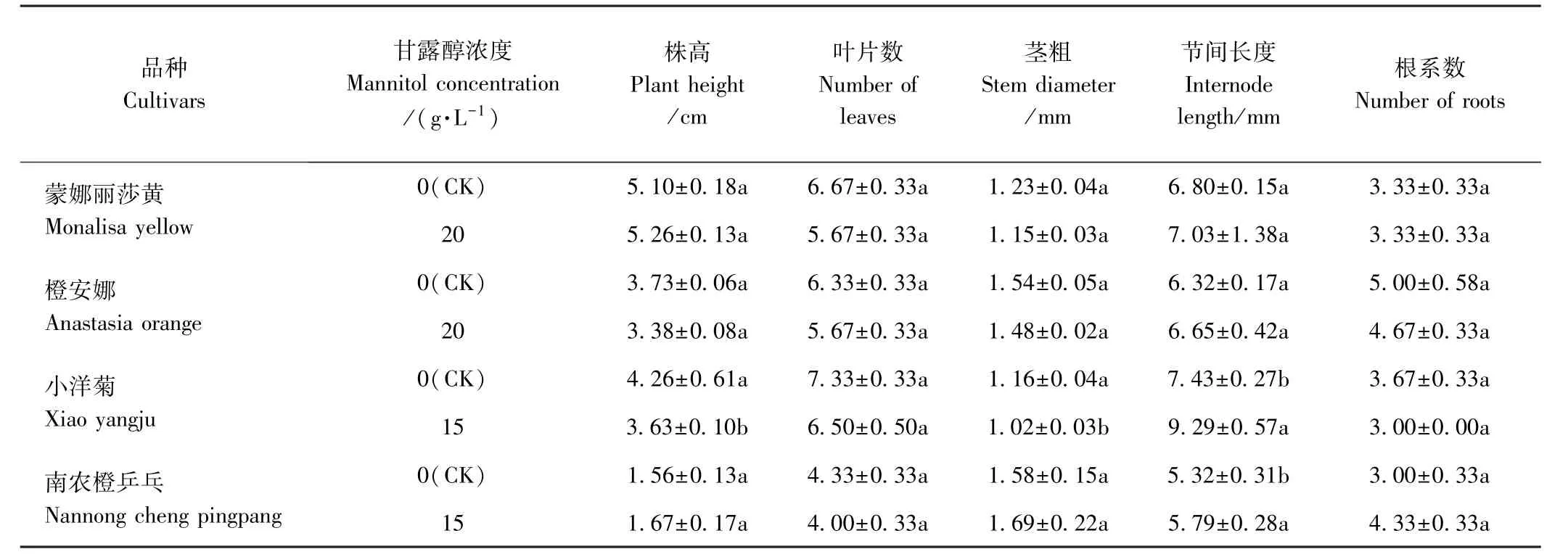
表4 不同浓度甘露醇处理对菊花低温离体保存后再生植株形态指标的影响Table4 Effect of different concentrations mannitol on the morphological indexes of the regenerated plantlets after in vitro conservation at low temperature
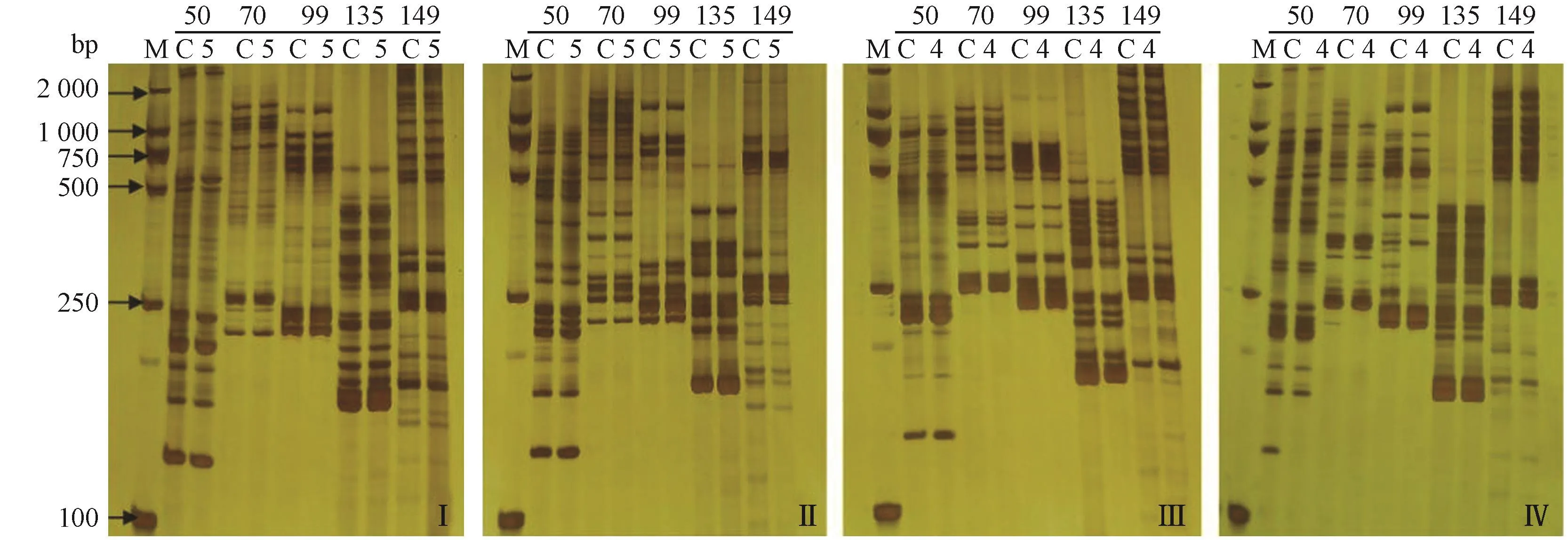
图5 再生植株的SSR分子标记图谱Fig.5 Genetic stability of the regenerated plantlets with SSR
本研究中低温保存结束后菊花试管苗的组织结构发生了一定的变化,具体表现为细胞变小、细胞间隙减小、密度增大,与贺川野菊[38]和野生毛葡萄[39]离体保存后的结果类似,其原因可能是植物细胞对低温和甘露醇形成的渗透胁迫做出的适应性反应。小洋菊恢复生长后,与对照相比出现株高降低、叶片变小等现象,其原因可能是植株从不良环境转移至正常条件下生长,需要一定的适应过程,再次继代培养后植株形态恢复正常,与对照无差异,SSR-PCR扩增图谱也未发现变异条带,说明低温离体保存后再生植株DNA水平上没有发生变化,菊花在低温下离体保存结束后保持了良好的遗传稳定性。
4 结论
本研究结果表明,7±2℃下 MS培养基添加 15 g·L-1甘露醇对南农橙乒乓和小洋菊试管苗的离体保存效果最佳,而蒙娜丽莎黄和橙安娜在添加20 g·L-1甘露醇处理下效果最佳;相比甘露醇,高浓度蔗糖(45~90 g·L-1)对试管苗的保存效果不佳。4个品种菊花经低温加甘露醇处理保存12个月后,试管苗恢复正常培养生长良好,且保持了良好的遗传稳定性。本研究结果为菊花种质资源的低温离体保存提供了理论依据和技术支撑。
