若尔盖高寒草地微地形的土壤微生物群落多样性特征
2019-01-09简小枚陈毅萍
江 聪, 简小枚, 杜 勇, 陈毅萍, 税 伟, 4
(1. 福州大学生物科学与工程学院, 福建 福州 350116; 2. 福州大学环境与资源学院, 福建 福州 350116; 3. 厦门大学环境与生态学院, 福建 厦门 361102; 4. 美国西密歇根大学地理系, 卡拉马祖 49000)
0 引言
若尔盖湿地生态保护区是青藏高原湿地的重要组成部分, 是世界上最大的高寒泥炭沼泽湿地, 同时也是黄河和长江上游重要的水源涵养地. 若尔盖湿地在全球气候变化、 防风固沙、 生物多样性保育等方面, 发挥着举足轻重的作用. 由于若尔盖湿地处在高寒、 高海拔生态脆弱地带, 环境变化的微小波动都可能会打破处于脆弱平衡的生态系统. 在自然因素作用和人类活动的双重影响下, 出现了湿地-草甸-退化草甸-沙化草地的退化演替趋势. 研究表明, 截至2011年, 若尔盖沙化面积已扩增到近10万hm2, 且以每年11.65%的速度继续沙化, 区域生态环境呈现逐步恶化的趋势. 草地沙化不仅引起草地生态系统服务功能下降、 生物多样性降低、 碳流失等一系列生态问题, 亦将影响局部甚至全球气候变化[4-5].
草地变化会影响“植物—土壤—微生物”地上和地下的生态过程, 随着草地沙化的加剧, 必然对地表植物群落以及地下土壤理化性质等产生影响, 而土壤环境和生物多样性的改变势必影响土壤微生物群落. 目前研究主要从不同沙化程度的草地与植物群落、 土壤特性、 微生物数量特征以及微生物群落结构的变化规律等方面进行研究[7-8]. 如税伟等研究不同沙化草地恢复重建过程中土壤理化性质及生态系统服务功能的变化特征; 孙飞达等[10]结合草地利用现状及不同的微地形分布研究土壤微生物数量分布特征及土壤理化性质的差异. 蒋永梅等[11]研究不同退化程度下的高寒草地与土壤微生物﹑土壤酶活性的变化特征. 但尚缺少关于草地沙化与土壤微生物功能多样性特征关系的研究. 土壤微生物是生态系统中重要的生物成分, 它既是土壤功能的保证, 也是恢复沙化土壤功能的基础. 土壤微生物与生态环境响应主要通过群落代谢功能差异来实现, 因此研究土壤微生物功能多样性能明确不同环境中微生物群落的作用. 特别在高寒草地的特殊环境下, 土壤微生物群落结构及功能更特殊, 研究土壤微生物群落功能多样性有助于阐明若尔盖沙化草地生态系统内部的结构及功能变化[12], 并可揭示草地生态系统的现状及预知发展趋势. 若尔盖沙化草地主要位于亚高山草甸草场, 其中迎风坡面的山垭口、 河床故道和牧道最易沙化[13]. 因此, 本研究以若尔盖湿地保护区内典型草地缓丘为研究对象, 采用Biolog微平板法对缓丘坡面的土壤微生物群落功能多样性进行分析, 在坡面尺度上探究草地沙化与土壤微生物群落功能多样性的特征关系, 进而了解高寒草地在沙化过程中土壤的生态过程. 同时为预防草地沙化与植被恢复重建提供理论依据.
1 研究区域与方法
1.1 研究区概况
若尔盖高原湿地的主体位于四川省阿坝藏族羌族自治州的红原县和若尔盖县, 其范围为101°30′E~103°30′E, 32°20′N~34°00′N, 平均海拔约3 500 m, 是世界上典型的低纬度高原湿地, 同时也是我国面积最大的高原泥炭沼泽集中分布区(图1). 气候属于高原寒温带湿润气候, 主要特点为: 长冬短夏、 霜冻期长、 干雨季分明, 年平均降水量为650~750 mm, 年平均气温0.7~1.1 ℃. 土壤类型以高寒草甸土、 亚高山草甸土为主, 沼泽土、 泥炭土分布次之[14]. 地表部分被沙土覆盖, 植物稀疏, 植物种类主要以青藏苔草(Carexmoorcroftii)、 防风(Saposhuikoviadivaricata)、 高山嵩草(Kobresiapygrwaea)、 垂穗披碱草(Elymusnutans)、 藏虫实(Corispermumtibeticum)、 毛穗赖草(Leymuspaboanus)和藏沙蒿(Artemisiawellbyi)等草本植物为主. 调查样地位于若尔盖湿地保护区内高寒草地的缓丘, 坡底和下坡位交界处有一条公路, 将调查样地一分为二, 下坡位到坡顶有铁栅栏围护. 根据张金屯等[15]对轻度﹑中度及重度退化草地划分的标志, 实地调查发现坡顶样地植物平均盖度低于30%, 属于重度沙化. 坡面样地植被平均盖度不一, 属于中度沙化和轻度沙化. 坡底部样地为河流支沟泥炭地, 支沟上游已经干涸, 无植被覆盖. 下坡位地势较为平缓, 鼠害严重, 样地区域密布着土丘, 为高原鼢鼠活动所致. 具体样地信息如表1所示.

图1 若尔盖县区位Fig.1 Location in Zoigê County

表1 样地信息Tab.1 Geographical information
1.2 土壤样品的采集
土壤样品采集样地位于四川省若尔盖县麦溪乡国有草场. 从缓丘的坡底到坡顶, 每个坡位设置3个10 m×10 m的土壤采集样方, 每个样方的土样为按“S”型路线选择5个样点的土样混合, 使用土钻采集深度为20 cm的土样, 用自封袋保存, 放入冰盒中运回实验室, 过2 mm筛后, 4 ℃保存.
1.3 土壤微生物多样性测定
Biolog Eco板通过微生物对单一碳源的利用来了解其微生物的动态, 可用于评估土壤微生物群落代谢多样性和功能多样性的研究[16]. 每块平板共96个微孔, 3组重复, 每组包含31种碳源和1个空白. 在一定温度下培养, 土壤微生物代谢底物产生的电子, 会使微孔内的染料变成紫色. 每孔颜色变化程度可以反映土壤微生物对31种不同单一碳源的代谢能力高低. 该方法被广泛应用于土壤微生物群落功能多样性研究[17].
称取相当于10.0 g干土的新鲜土壤放入三角瓶中, 加入90 mL灭菌的生理盐水(体积质量0.85% NaCl), 用无菌棉花塞封口. 震荡30 min后, 静置15 min, 用移液枪吸取10 mL上清液, 加入90 mL灭菌生理盐水. 按逐步稀释法, 将土壤悬液稀释为10-3g·mL-1. 在超净工作台中用移液器将制备好的土壤悬液接种到Biolog Eco板的各孔中, 每孔150 μL. 将接种好的Biolog Eco板盖好盖子, 放入25 ℃的培养箱中培养7 d. 每隔24 h用Biolog读板仪在590 nm下测定各孔的吸光度值, 完成数据的采集和储存[18].
1.4 数据的处理
1) 每孔颜色平均变化率(AWCD). 土壤微生物的代谢活性用每孔颜色平均变化率(average well color development, AWCD):
(1)
式中:Ai是除对照孔外各孔吸光度值,AA1是对照孔吸光度值.Ai-AA1为负值时归零.
2) Shannon-Wiener指数(H′). 用于研究异质性问题, 评估群落的丰富度, 对稀有种数目变化反映敏感. 计算公式如下:
H′=-∑Piln(Pi)
(2)
式中:Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比率.
3) Simpson指数(D). Simpson优势度指数是最著名的优势度指数之一, 常用于评估群落常见种优势度, 主要用于度量调查群落的集中性, 是多样性的反面即集中性的度量. 计算公式如下:
D=1-∑(Pi)2
(3)
4) McIntosh指数(U). McIntosh指数U用于评估群落均一度, 计算公式如下:
(4)
式中:ni是第i孔的相对吸光值, 即Ai-AA1.
对不同坡位数据进行单因素方差分析, 数据用平均值±标准差表示. 采用SPSS 22.0进行数据分析统计﹑主成分分析, 利用Excel 2007与Origin 9.0作图.
2 结果与分析
2.1 土壤微生物群落平均颜色变化率
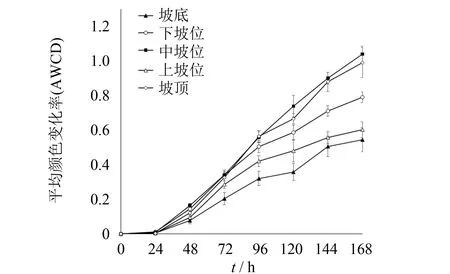
图2 不同坡位草地土壤微生物AWCD值Fig.2 AWCD values of soil microbial communities at different slope positions
Biolog Eco板每孔平均颜色变化率(AWCD)可以表征土壤微生物群落代谢活性[19]. 一般来说, 土壤微生物生长主要受碳源的利用, 在培养过程中利用土壤微生物对基质采取选择性利用, 从而表现为反应孔出现颜色差异, 见图2. 由图2可看出, 在0~24 h的培养时间内, AWCD值基本为零, 且无明显变化, 说明该时间段微生物代谢活性低, 几乎没有代谢碳源. 24~168 h的培养时间内, 随着培养时间增加, AWCD值呈现出先快速增加, 随后持续平缓的升高直至试验结束. 结合显著性分析可知, 培养前期24~96 h各坡位AWCD值差异不大, 但72~96 h, AWCD值的增速达到最大, 故选择96 h的数据进行土壤微生物群落功能多样性指数分析和主成分分析. 培养中期96 h后开始差异显著, 表明微生物进入指数增长期, 开始大量利用碳源, AWCD值大体呈现出中坡位>坡顶>下坡位>上坡位>坡底的规律, 中坡位微生物代谢活性最高, 坡底微生物对基质的利用能力最低.
2.2 土壤微生物群落多样性
土壤微生物多样性指数的常用指标有Shannon指数、 Simpson指数、 McIntosh指数[20]. Shannon指数可用于评估土壤微生物丰富度, Simpson指数是测定群落组织水平最常用的指标之一, 表示群落受优势物种影响的程度. Mcintosh指数反应碳源利用种类数不同, 可表征土壤微生物群落均一度[21]. 如表2所示, 中坡位的Shannon丰富度指数最大, 显著大于坡底及坡顶的指数值(P<0.05), 且坡底与坡顶的各指数间均有显著性差异(P<0.05); 同样地, 中坡位的Simpson优势度指数最大, 且显著大于坡底及上坡位的指数值(P<0.05); 不同坡位McIntosh均一度指数之间无显著性差异, 但中坡位的均一度值显著大于坡底指数值, 显著小于坡顶指数值(P<0.05). 表明坡顶部和坡中部的微生物种类较为丰富, 碳源利用程度较高. 土壤微生物多样性指数差异表明处于中坡位的轻度沙化草地土壤微生物群落多样性相对较高, 而严重退化草地的多样性指数值相对较低.
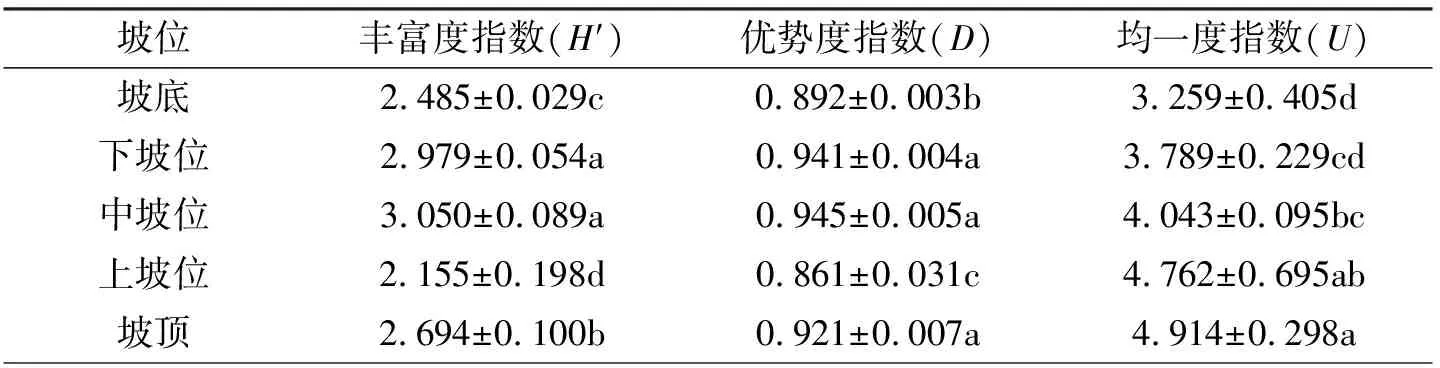
表2 土壤微生物群落多样性指数
注: 数据以(平均值±标准差)表示, 不同字母表示不同坡位间差异显著(P<0.05); 相同字母表示差异不显著(P>0.05)
2.3 土壤微生物碳源利用特征
Biolog Eco板上的31种碳源可分成6大类, 即糖类、 氨基酸类、 羧酸类、 胺类、 酚酸类及聚合物类. 不同坡位土壤微生物对6类碳源类型利用程度见表3, 由表3可知: 沿着坡底到坡顶的梯度上, 各坡位土壤微生物对碳源的利用程度差异较大, 各碳源总体呈现升高趋势. 对缓丘坡底的微生物利用碳源程度分析发现, 氨基酸类碳源的利用率最高(0.516 1), 其次为羧酸类(0.414 6), 酚酸类碳源利用率最低(0.128 8);通过对缓丘下坡位分析发现, 氨基酸碳源利用程度最高(0.681 3), 其后依次为聚合物类(0.604 7), 羧酸类(0.576 3), 胺类(0.546 5), 糖类利用率最低(0.320 7), 且缓丘上坡位的土壤微生物碳源利用情况与下坡位的一致; 中坡位草地上碳源的利用情况呈现出氨基酸类>胺类>羧酸类>聚合物类>酚酸类>糖类; 对退化较为严重的坡顶土壤微生物碳源利用情况分析可知, 其各碳源利用情况反而高于其他坡位的碳源利用, 其中, 氨基酸类利用率达0.859 3, 最低的酚酸类碳源利用率也达到0.353 9. 通过显著性差异分析, 发现不同坡位的土壤微生物群落对羧酸类碳源的利用率差异不显著(P>0.05), 而对胺类碳源的利用率差异显著(P﹤0.05). 总体上, 氨基酸类利用率变化明显大于其他碳源, 而胺类及酚酸类的利用程度较低, 表明氨基酸类是该区域土壤微生物利用的主要碳源, 即是引起土壤微生物群落功能差异的敏感碳源.
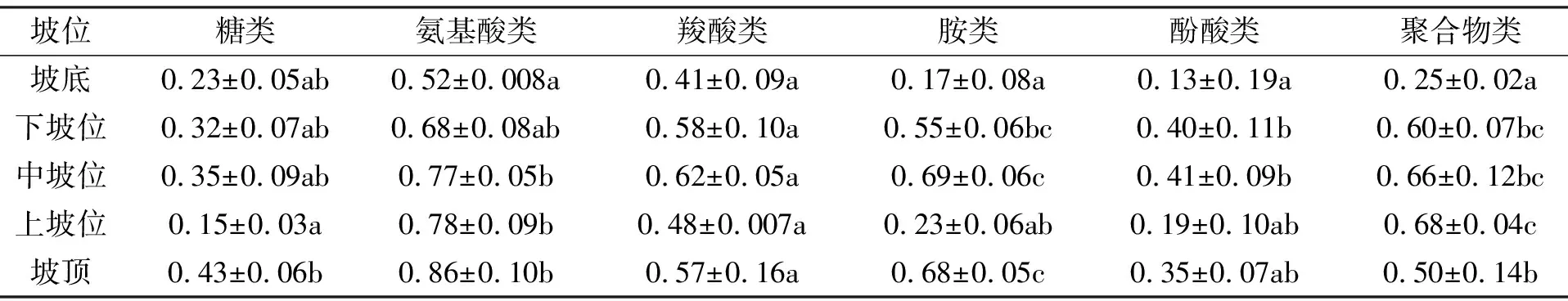
表3 土壤微生物对6种不同类型碳源的利用率
注: 数据以(平均值±标准差)表示, 不同字母表示不同坡位间差异显著(P<0.05); 相同字母表示差异不显著(P>0.05)
2.4 土壤微生物利用碳源的主成分分析
对培养96 h的31种碳源底物利用情况进行主成分分析, 了解土壤微生物群落功能差异, 详见图3. 将31个因子降维得到4个主成分(PC), 累计贡献率达76.8%, 可以较全面地概括变量的大部分信息, 表征不同坡位土壤微生物对单一碳源的代谢能力. 其中PC1贡献率为32.6%, PC2为21.2%, PC3为12.4%, PC4为10.5%. 由于前两主成分的累计贡献率达53.9%, 因此前2个主成分是解释微生物碳源利用变异的主要贡献者, 现主要对前2主成分进行分析. 由图3可知, 坡底与坡顶在PC2发生明显分离, 上坡位、 中坡位和下坡位在PC2发生明显分离聚集, 说明不同坡位对土壤微生物群落的碳源利用有显著的影响. 通过前2个主成分的因子载荷发现, 对PC1贡献较大(因子载荷>0.5)的碳源有7种, 对PC2贡献较大的碳源有4种. 结合因子载荷图可知, 对PC1起主要分异作用的是糖类碳源(α-D-葡萄糖-1-磷酸、D-甘露醇、D-葡萄糖胺酸、D-半乳糖酸-γ-内脂), 聚合物类(吐温80)、 氨基酸类碳源(L-丝氨酸)以及酚酸类碳源(4-羟基苯甲酸). 对PC2贡献较大的是糖类碳源(D-半乳糖醛酸、 N-乙酰-D-葡萄糖胺、D-纤维二糖、D,L-α-磷酸甘油). 由此可知, 在主成分分离中糖类、 氨基酸类、 聚合物类及酚酸类是缓丘坡面上土壤微生物群落主要利用的碳源.

图3 土壤微生物群落主成分分析Fig.3 Principal component analysis of soil microbial communities
3 讨论
3.1 微地形生境下土壤微生物碳源代谢特征
Biolog Eco板有31种碳源, 可以通过分析单一碳源利用程度来表征土壤微生物群落的代谢活性, 从而了解微环境生境下微生物群落的动态变化. AWCD值越大, 表示土壤微生物群落代谢活性越高[22]. 在缓丘坡位上呈现中坡位>坡顶>下坡位>上坡位>坡底的规律, 表明不同坡位的土壤微生物代谢活性存在差异. 结合野外调查发现中坡位沙化程度较轻, 植被平均覆盖率>65%, 故土壤微生物代谢活性较高, 而坡底主要为泥炭地且其植被覆盖率极低, 土壤微生物生存环境恶劣. 微地形生境下植被通过生理生态过程影响土壤环境, 不同的土壤环境为土壤微生物群落提供不同的理化环境及营养物质, 与此同时土壤微生物群落活性和多样性会迅速响应土壤环境改变[23-24], 相反土壤微生物群落也会通过有机物和土壤元素的迁移和富集, 反馈调节植被的生长状况由此可见植物—土壤—微生物三者之间关系密切. 研究表明, 植被种类多样性与土壤微生物种类多样性呈显著正相关[25].
另一方面沙化程度也会影响土壤微生物群落特征. 一般来说, 沙化程度越高, 会导致植被盖度下降﹑物种单一﹑群落趋于简单, 同时沙化会造成高寒草地土壤的碳氮比﹑氮磷比﹑磷钾比等营养元素下降, 土壤理化性质也会改变[26], 由此土壤微生物群落代谢活性也会降低. 根据31种碳源利用情况发现, 缓丘草地土壤微生物群落利用的主要碳源为糖类和氨基酸类, 且坡顶和坡底的土壤微生物群落具有相异的碳源利用方式. 通过主成分分析发现, 不同坡位的土壤微生物对碳源的利用模式有所差异, 土壤微生物对糖类、 氨基酸类、 羧酸类、 胺类、 酚酸类及聚合物类的利用具有选择性, 这可能与沙化程度﹑植被覆盖及土壤微生物自身生理特征有关. 微生物主要是通过群落代谢功能的差异来影响环境, Biolog微平板法是目前研究微生物代谢功能特征有利的手段. 但本研究未进一步探讨植物与土壤微生物的关系, 以及影响土壤微生物群落特征的主要环境因素, 这对于揭示沙化草地的土壤微生物特征具有重要意义.
3.2 微地形生境下土壤微生物群落功能多样性特征
土壤微生物群落功能多样性能描述土壤微生物群落状态, 同时能灵敏地反映出土壤质量变化[27]. 土壤微生物群落功能多样性与均一性不仅能提高土壤生态系统的稳定性, 亦能提升土壤微生态环境的抵抗能力. 本研究发现, Shannon指数和Simpson指数均表现为中坡位大于坡顶及坡底的指数值, Shannon指数越大反映土壤微生物群落利用碳源的种类越多且越均匀, 而Simpson指数越大表明土壤微生物群落对常见碳源的利用程度越大. 由此可见, 中坡位的土壤微生物群落物种丰富度和群落中常见物种的优势度较高, 且对常见碳源利用率也越大. 这可能是因为坡中部植被覆盖较高, 地上植被覆盖情况不同会造成土壤理化性质的差异, 增加土壤的微生物多样性[28]. 坡上部植被稀疏, 受风沙侵蚀程度较大, 土壤养分及土壤含水量等明显减少, 导致土壤微生物群落多样性降低. 坡底部泥炭地的温度低, 土壤酸性强, 养分贫乏, 其酸碱性也能显著影响微生物群落多样性[29], 导致坡底部土壤微生物群落多样性会大大减少. 下坡位与坡底紧连, 是起伏度不大的退化草地, 实地调查发现该片草地鼠害严重, 鼠害是草地退化的伴生物, 同时鼠害也会加速草地的退化, 啃食地表植被及掘土挖洞都会破坏土壤环境, 导致生态循环失调, 土壤微生物群落多样性也会减少[30]. 草地退化会导致植物的生产力及多样性下降﹑土壤理化性质改变, 影响草地地上及地下生态过程. 作为土壤环境敏感的响应者, 土壤微生物群落多样性﹑数量会随之改变. 如彭岳林等[31]调查发现退化程度不一的草地中土壤细菌﹑真菌﹑放线菌数量存在差异. 综合多样性指数分析结果, 本研究选取的若尔盖高寒草地缓丘微地形土壤微生物群落多样性很大程度上受到不同沙化程度的影响.
总的来说, 土壤微生物群落多样性是表征土壤质量变化的敏感指标, 不同退化程度的草地不仅改变影响地表植被覆盖, 作为草地生态系统重要组成部分的土壤微生物, 其分布、 活性及功能多样性都会受到退化程度的影响, 本研究选取的缓丘微地形生境, 草地沙化程度存在差异, 其生态恢复效应也有明显差异. 在关注地表草地沙化加剧的同时, 注意到沙化过程中地下土壤微生物群落功能多样性的变化, 为评价高寒草地沙化情况提供一种新思路, 同时对若尔盖湿地生态环境恢复和草地保护具有重要意义.
