复发难治性多发性骨髓瘤患者外周血中PD-1的表达及意义
2019-01-09翁珊珊吴圣豪蔡小平郑翠苹
翁珊珊,吴圣豪,蔡小平,郑翠苹
多发性骨髓瘤(MM)是一种B细胞恶性克隆性肿瘤,其典型特性为异常的浆细胞分泌并产生单克隆免疫球蛋白,导致骨髓(BM)造血衰竭,最终出现贫血、溶骨性病变、高钙血症、高黏滞血症、肾功能衰竭和反复的细菌感染等[1]。MM作为免疫效应细胞的恶性肿瘤,存在体液免疫和细胞免疫的双重缺陷与失调,能使之逃避机体的免疫监视和免疫杀伤功能。造成MM免疫功能紊乱的一个关键因素是程序性死亡-1(PD-1)。PD-1在各类免疫细胞的活化和耐受中起了关键作用,其存在两种配体,即PD-L1和PD-L2。大量研究证明,PD-1与其配体结合,能产生并传递负性调控信号,诱导肿瘤抗原特异性T细胞的凋亡和免疫无能,促使肿瘤的免疫监视与免疫逃逸[2]。本研究观察PD-1在复发难治性多发性骨髓瘤(RRMM)患者外周血中的表达,分析其在免疫功能中的作用,报道如下。
1 资料与方法
1.1 一般资料 选取2015年3月至2016年10月浙江省温州市中心医院收治的RRMM患者28例,初诊时均符合RRMM的诊断标准,临床资料完整,且完成至少2个周期治疗。其中男16例,女12例;中位年龄67岁;IgG型16例,IgA型7例,IgD型5例;Durie-Salmon疾病分期:Ⅱ期10例,Ⅲ期18例;复发19例,难治9例。伴肾功能不全18例。患者既往均经包括硼替佐米、沙利度胺在内的不同方案的治疗,中位化疗数6(3~16)次。另选同期在本院健康体检者14例作为对照组,均无感染、肿瘤及自身免疫性疾等病史,其中男8例,女6例;中位年龄50岁。两组一般资料差异无统计学意义(P>0.05)。
1.2 治疗方法 28例患者均采用来那度胺联合地塞米松的治疗方案(LD),28 d为1个疗程,来那度胺10~25 mg/d,于d1~21给药,休息 7 d。初始剂量根据患者的肾功能、年龄及骨髓造血情况来决定。地塞米松 20 mg/d,于疗程 d1、8、15、22 给药。肝、肾功能不良或不能耐受的患者应调整剂量。服用来那度胺期间常规使用肠溶阿司匹林片100 mg,qd以预防深静脉血栓形成。随访至2017年8月。
1.3 疗效评价及实验方法 患者在完成2个周期治疗后评价疗效,比较治疗前后PD-1表达的差异。疗效参照EBMT/ABMTR标准[3],分为严格完全缓解(Scr)、完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。抽取各实验对象清晨空腹外周血,EDTA抗凝。取标本各10l进行溶血,得到分离的淋巴细胞,PBS洗涤 1次,分别加入不同荧光标记抗人 CD4/CD8、CD45RA、CD27和PD-1表面分子抗体,振荡器震荡均匀,室温避光染色20 min,离心5 min弃上清液,得到的细胞用PBS液洗涤2次,震荡均匀,室温避光保存。流式细胞仪设置获取细胞数不少于 50 000个,并用flowjo流式分析软件对结果进行分析,得出PD-1的表达。
1.4 统计方法 使用SPSS17.0统计软件进行处理,计量资料以均数±标准差表示,多组比较采用方差分析,两组比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PD-1的表达水平 3组CD4+、CD8+T细胞表面PD-1水平差异均有统计学意义(均 P< 0.05),RRMM患者CD4+、CD8+T细胞表面PD-1表达水平均高于健康组,治疗后RRMM患者CD4+T、CD8+T细胞表面PD-1表达水平亦均高于健康组(均P<0.05)。3组外周血中CD4+TPD-1表达水平高于CD8+T(均 P< 0.05)。见表 1。
2.2 不同临床分期RRMM外周血CD4+T和CD8+TPD-1的比较 III期RRMM患者治疗前后CD4+、CD8+T细胞中PD-1表达水平均高于II期(均P<0.05)。见表 2。
2.3 与临床疗效的相关性分析 Scr、CR、VGPR为9例,PR、SD为11例,PD为8例。与治疗前比较,达到Scr、CR、VGPR的MM患者CD4+T、CD8+T PD-1表达明显下降;而PD者PD-1表达也下降,但不明显。见表3。

表1 研究对象外周血CD4+、CD8+T细胞PD-1表达量
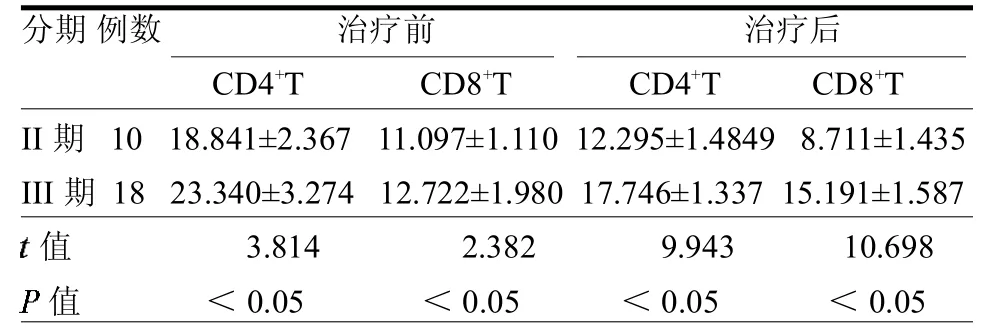
表2 RRMM治疗前后疾病分期中CD4+T和CD8+T PD-1表达

表3 复发难治组治疗前后CD4+T、CD8+T PD-1的表达
3 讨论
MM是血液系统第3大常见恶性肿瘤,尽管新化疗药物的应用及alloSCT等治疗手段使MM的缓解率不断提高,但其初诊后5年生存率仅为44%,终将复发耐药甚至进展[4],对于复发难治耐药的患者,目前尚无疗效满意的治疗药物。以往实验显示,在不同的实体肿瘤和大多数血液系统恶性肿瘤患者的外周血细胞上PD-1可较高水平的表达,且与肿瘤的不良预后相关。这提示 PD-1可能参与抗肿瘤的免疫应答。PD-1是一种Ⅰ型跨膜糖蛋白,在活化的T及B细胞、单核细胞、NK细胞以及间充质干细胞中高表达[5],在T细胞功能紊乱时持续性表达,作为抑制性信号在肿瘤发病过程中限制 T细胞的免疫效应。PD-1还可影响T细胞的分化,抑制各种炎性介质的释放[6],与肿瘤的发生发展存在密切关系。
本研究应用流式细胞术发现,RRMM患者外周血中CD4+和CD8+T细胞表面PD-1的表达均增高,且CD4+T细胞PD-1的表达约是CD8+T细胞的2倍,健康组表达少量PD-1。目前尚不清楚正常人T细胞中PD-1表达的意义,推测可能与机体免疫耐受的维持有关。本研究还发现,PD-1的表达与MM分期有关,经有效治疗后PD-1的表达下降,提示PD-1的表达与骨髓瘤临床分期、疾病严重程度相关,高表达PD-1的MM患者具有临床进展迹象。而治疗后疾病未缓解甚至疾病进展者 PD-1的表达无明显下降甚至上升,即PD-1的表达水平与疗效有相关性,但需进一步研究证实。
作为新型免疫抑制剂,抗PD-1抗体已用于各种肿瘤的治疗,在治疗RRMM中疗效显著,其中CR 17%,PR70%[7]。Nivolumab用于黑色素瘤的治疗效果也很惊人,据报道黑色素瘤患者客观缓解率大于30%[8]。另一项Ⅰ/Ⅱ期非小肺癌临床研究结果显示,用PD-1抗体治疗的患者有效率为45%,中位无进展生存期为10个月;而用顺铂加吉西他滨治疗的患者有效率为28%,中位无进展生存期为6个月[9]。早前Iwai的研究团队用骨髓瘤小鼠模型证明了抑制PD-1/PD-L1信号通路能抑制MM瘤细胞生长,并设想PD-1可用于MM的治疗中。Tamura等[10]的研究也证明,应用抗PD-1单克隆抗体,能够增强MM对自体细胞的溶解活性。
综上所述,PD-1/PD-L1在免疫抑制中具有重要作用,阻断此途径可促进抗肿瘤免疫应答,为MM免疫逃逸机制及其靶向治疗提供重要的理论及实验依据。PD-1治疗相关的毒副作用非常小,患者能够耐受,可作为替代和可持续选择的新型治疗方式。但目前缺乏评估其在早期疾病和维持应用中的试验,有待进一步研究。
