山葡萄苯丙氨酸解氨酶基因(PAL)的克隆与表达分析
2019-01-09杨铭慧刘海峰
陈 蒙,张 雪,张 宇,杨铭慧,刘海峰
(延边大学 农学院,吉林 延吉 133002)
山葡萄 (Vitisamurensis) 为葡萄科葡萄属。原产地主要在我国东北部,分布在吉林、辽宁和内蒙古地区[1-2],是栽培范围最广泛的果树种类之一,在果树生产中具有重要地位。山葡萄抗病性较强,对黑痘病、白粉病和炭疽病有较强的抵抗能力[3]。山葡萄味酸、微涩,富含浆汁,是制造葡萄酒的最佳原料,所酿制的葡萄酒的颜色深红,风味品质很好,口感醇正,深受人们喜爱。山葡萄果皮颜色的深浅,主要取决于花色苷的含量,因此对花色苷研究十分重要。
花色苷(Anthocyanin)为一种水溶性色素,以糖苷形式存在于植物体内,是类黄酮化合物,是植物花、果实以及控制叶片颜色变化的重要组成成分。种皮花色素含量的多少决定种皮颜色的深浅,种皮色泽的差别与花色素的含量呈正相关[4]。在酿造葡萄酒时葡萄中的多种花色苷与其他物质相互作用,产生新的花色苷,而且在后续酿造过程中继续产生反应,生成许多复杂的花色苷色素衍生物[5]。花色苷功能很多,主要使植物器官产生不同颜色,另外花色苷对于种子传播、授粉、抵抗病原物侵染、防紫外线损伤等诸多方面都表现出了明显作用[6-7]。花色苷分布在植物的各个组织中,使植物呈现出色彩斑斓的颜色[8-10]。但由于花色苷稳定性影响因子多、降解机制复杂,结构不稳定,全面开展花色苷的降解机制和如何提升花色苷稳定性的研究极其重要。有学者研究表明,花色苷在生物合成中,受多种基因约束,其中编码蛋白酶的是结构基因,调节蛋白酶活性的是调节基因,二者进行协同调节,共同调控这类色素物质的积累过程。
山葡萄花色苷的生物合成是一个十分复杂的过程,分为2种途径,一种是苯丙烷类代谢途径,另一种是类黄酮途径。在花色苷合成过程中,3 分子的丙二酰-CoA 和 1 分子的对香豆酰-CoA 结合形成第 1 个具有 C15 架的黄酮类化合物[11]。在 1960 年,Neish 验证了 PAL 可以促使花青素合成[12]。PAL 基因的表达方式多样,其活性的干扰因素较多,具有一定的组织特异性。苯丙氨酸解氨酶在有颜色的葡萄品种表达很强,在白色葡萄中表达很少或者不表达。很多植物 PAL 的集中部位在根部,老熟叶片不表达[13]。PAL 的活性较高,大多数存在植物的木质化组织中,但非木质化组织中没有 PAL 的活性[14-16]。PAL 基因是一个多基因家族,PAL 蛋白第1次在麦子(Hordeumvulgare) 中被发现[17],随后被证实广泛存在于植物、真菌、酵母和藻类中。植物 PAL 基因家族成员对各类激素以及逆境威胁的影响存在差异,在植物体各个组织和各个发育期的表达也有所差别。
目前对山葡萄花色苷调控相关基因进行分析和研究的报道较少,本试验从山葡萄8个着色期时期进行研究,探索控制合成花色苷的限速酶PAL基因在山葡萄浆果时期到成熟期的基因表达量。试验结果为今后研究山葡萄花色苷积累与相关基因变化规律及调控作用提供了基础数据,为深入研究控制山葡萄果皮成熟过程的重要基因建立基础。
1 材料和方法
1.1 植物材料
采摘山葡萄双红幼嫩完整无病虫害的叶片,随后置于-80 ℃中保存备用。
1.2 试剂材料
RNA反转录试剂盒GoScriptTM购自Promega公司。实时荧光定量,选用SYBRGreenⅠ试剂盒,购自QIAGEN公司。
1.3 试验方法
1.3.1 DNA样品提取和检测 采用CTAB法[18]对山葡萄叶片基因组 DNA 提取后,经 Eppendorf 核酸检测仪检测,测定DNA 的质量。
1.3.2 PAL基因引物的设计与合成 在 NCBI 网站中,下载 GenBank 中与山葡萄近缘植物的 PAL 基因的氨基酸序列,使用多序列比对方法找到保守区域,利用Primer 6.0设计特异引物。引物序列如下:PAL-s:5′-TGCTTGATACAGGTTCTTGAATGCT-3′;PAL-a:5′-CCTAGCAGATTGGGAGAGGAGCACC-3′,在上海生工生物工程技术服务有限公司合成。
1.3.3 PCR扩增目的基因片段 利用 PAL基因引物进行 PCR 扩增来获得目的基因片段。扩增程序:95 ℃预变性2 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃终延伸5 min。使用 PAL 引物进行菌液 PCR 检测,将阳性克隆的菌样邮寄到生工生物有限公司进行测序。
1.3.4 PAL基因序列分析 将测序后的序列使用 NCBI 网站进行 Blast 比对,以验证测序结果的正确性。并使用生物信息学软件进行序列分析,用到的软件如表1所示。
1.3.5 实时荧光定量PCR分析 以延边大学农学院山葡萄双红群体中挑选的果实饱满、无病虫害的果粒为材料。分8个时期取样,分别为花后28 d、转色前、转色10%、转色30%、转色50%、转色80%、转色100%和完熟期。取其果皮,液氮中速冻,置于-80 ℃保存。采用改良CTAB法提取山葡萄8个不同着色时期的总RNA进行反转录。使用Primer 5.0软件,根据已经克隆到的PAL基因全长序列,设计VamPAL引物。内参基因选用ACTIN(Accession No.AB073011)。设计的引物序列如下:上游引物VamPALa:5′-TGCTTGATACAGGTTCTTGAATGCT-3′;下游引物VamPALs:5′-AAGACCAGCGATGTAG GAGA-3′。从上述8个时期的cDNA 模板中任选其一,依次稀释1,5,25,125,625倍5个梯度来制备标准曲线,反应设3个重复,反应体系:2×SuperReal Premix Plus 10 μL、10 μmol/L 的正反向引物各0.6 μL、cDNA模板1 μL、50×POX Reference Dye 0.4 μL、RNase-free ddH2O补至总体积为20 μL;反应程序:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火32 s,60 ℃延伸32 s,循环40次。扩增完毕后,对PCR产物进行熔解曲线分析。利用MxPro软件完成数据处理。

表1 生物信息学分析网上软件Tab.1 The online software for bioinformatics analysis
2 结果与分析
2.1 山葡萄总DNA
如图1所示,使用核酸检测仪和凝胶成像仪检测DNA浓度和质量,DNA 的 OD260/280值为 1.75,表明 DNA 纯度较高,可进行后续试验。
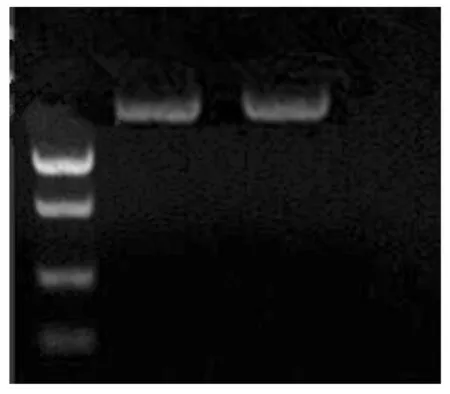
图1 DNA电泳图Fig.1 DNA electrophoresis map
2.2 VamPAL 基因全长的克隆与生物信息学分析
以提取 DNA 为模板,PAL-a、PAL-s为引物进行 PCR 扩增,得到1条1 763 bp 的序列(图2)。经Blast 比对后发现,它与欧亚种葡萄(GenBank登录号:JN858963)同源性达到100%,认定该序列为山葡萄PAL基因的核苷酸序列。提交PAL的核苷酸序列,GenBank(https://www.ncbi.nlm.nih.gov/)登录号是MH045991。运用 DNAStar 软件分析,该 DNA 序列具有完整的开放阅读框 1 671 bp,3′-UTR 为 9 bp,5′-UTR 为85 bp,推断它能编码 556 个氨基酸。命名为VamPAL。

图2 VamPAL基因PCR电泳图谱Fig.2 VamPAL gene PCR electrophoretogram
2.3 基因编码蛋白质理化性状分析
运用 ProParam 程序,对山葡萄VamPAL基因所编码蛋白的理化性质进行分析,结果显示,该蛋白是由 556 个氨基酸构成,分子量 (MV) 为 61.07 ku,等电点为 5.76。在构成山葡萄 VamPAL 蛋白的 20 种氨基酸中亮氨酸 (Leu) 的量最多,为 11.5%;色氨酸 (Trp) 的量最少,为 0.9%,无吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。正电荷残基 (Arg+Lys) 个数是 52,负电荷残基 (Asp+Glu) 个数是 67,不稳定性系数是 30.42,脂溶系数是 92.07,说明山葡萄 VamPAL 蛋白为稳定蛋白质。
2.4 VamPAL 蛋白保守区预测
对VamPAL基因的蛋白保守区域进行预测,结果表明,山葡萄VamPAL含有苯丙氨酸解氨酶超级家族结构域,属于 PAL 家族蛋白。其特征序列为 GTVTASGDLVPLSYIAG,位于该蛋白的 39-55 位氨基酸(图3)。

图3 VamPAL基因编码蛋白的功能结构域分析Fig.3 Functional domain analysis of VamPAL encoded protein
2.5 VamPAL 蛋白的亲水性分析
使用 ProtScale 软件对 VamPAL 蛋白质亲水性进行分析(图4),其中纵坐标表示疏水性系数,横坐标表示序列所处位点。根据氨基酸数值越小亲水性越强,数值越大亲水性越弱的规律可以看到,疏水性最大值在 123 的位置上,数值是 2.389;最小值在 447 的位置上,数值是-2.856,总的亲水性平均值是-0.178,因此,VamPAL是亲水性蛋白。

图4 VamPAL 蛋白序列的亲水性分析Fig.4 Hydrophilic analysis of VamPAL protein sequence
2.6 VamPAL 蛋白的跨膜结构域分析
运用 TM-pred 在线分析VamPAL基因的氨基酸序列可知,PAL 蛋白在 41-59,105-123,347-363,540-556 区域可能形成 4 个分别以 49,113,355,548 为中心的由内到外的跨膜螺旋,在 39-56,105-124,347-363 区域分别以47,113,355 为中心形成 3 个由外到内跨膜螺旋(图5)。
2.7 VamPAL 蛋白的信号肽预测及二级结构分析
使用 SignalP 4.1 Server 软件预测山葡萄VamPAL基因的氨基酸序列是否具有信号肽,分析表明,山葡萄VamPAL基因编码的蛋白无信号肽。
运用网上资源 HNN 推测VamPAL基因的二级结构,结果表明(图6),该蛋白的二级结构是由 44.78%的无规卷曲、47.30%的 α-螺旋和7.91%的 β-折叠构成。
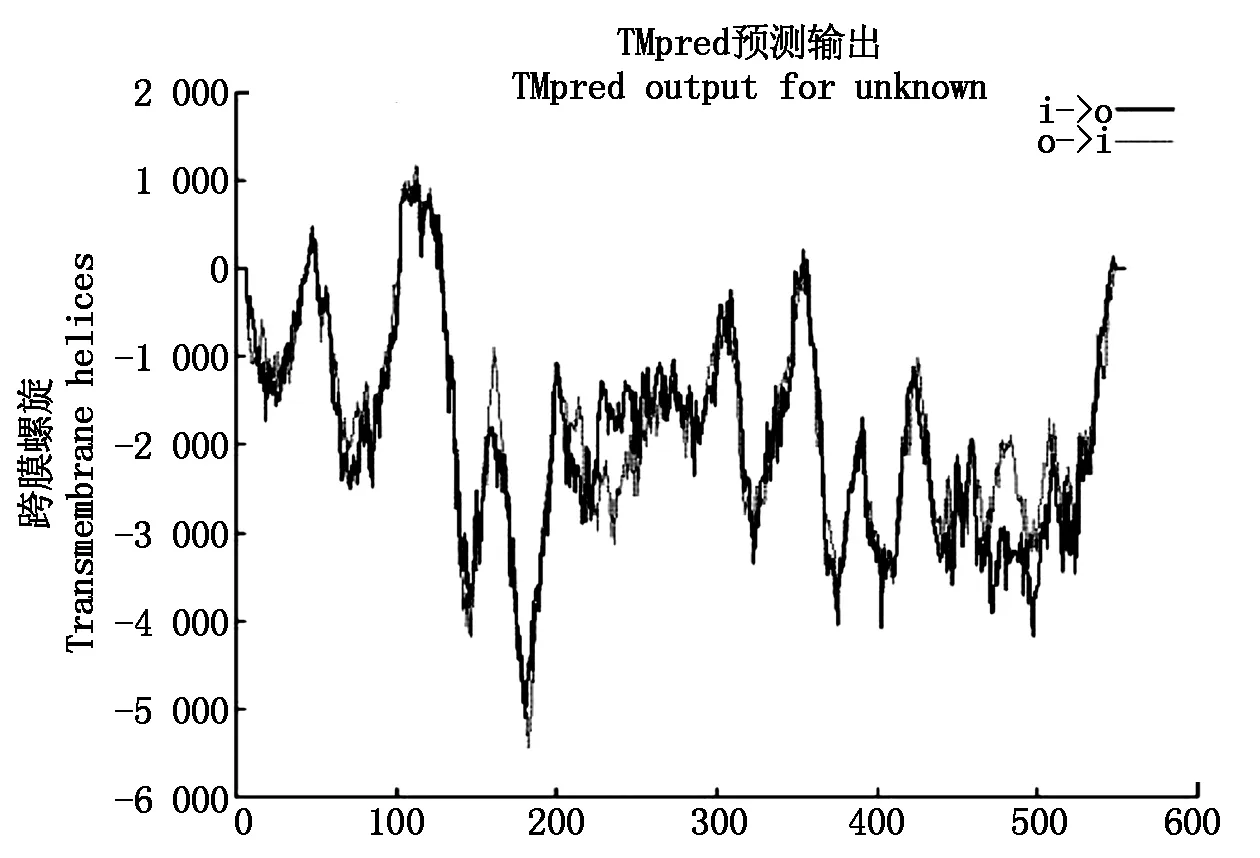
图5 VamPAL蛋白序列的跨膜分析Fig.5 Transmembrane analysis of VamPAL protein sequence

A.α-螺旋;E.无规卷曲;R.β-折叠。A.Alpha helix;E.Random coil;R.Extended strand.
2.8 细胞定位分析
使用 TargetP 1.1 软件对 VamPAL 蛋白序列进行细胞定位分析,分析结果显示,该蛋白在线粒体中的可能性为 0.256,在分泌途径中存在的可能性为 0.094。可靠级别为 4(表2)。
2.9 山葡萄 VamPAL编码蛋白质的同源性及进化分析
使用 NCBI 的工具 BlastP 对获得的山葡萄 PAL 基因的氨基酸序列进行同源性比对,比对结果表明,山葡萄 PAL 基因同欧亚种葡萄(GenBank登录号:ABM67591)、荔枝(GenBank登录号:ACR15762)等 PAL类基因的同源性相近,相似性分别为 100%,99%。运用多重序列比对软件,将山葡萄VamPAL及其他 9 种植物 PAL基因编码的氨基酸序列比对分析,结果如图 7(下划线为保守域)所示。

表2 VamPAL蛋白的TargetP 1.1定位分析结果Tab.2 VmPAL protein TargetP 1.1 positioning analysis results

图7 山葡萄VamPAL与其他植物的PAL氨基酸多序列比对Fig.7 Alignment of the predicted amino acid sequences of VamPAL in Vitis amurensis and those of several other plants
2.10 山葡萄 VamPAL 基因及其他物种构建系统发生进化树
为了对山葡萄VamPAL和其他物种的 PAL 基因进行深入的研究,在多重比对的基础上,使用分子生物学软件 MEGA 5.0,对山葡萄VamPAL基因及其他物种 PAL 基因的氨基酸序列构建系统发生进化树。分析结果如图 8所示,山葡萄VamPAL基因同欧亚种葡萄同源性最近,同水稻、甘蔗等植物的同源性较低。
2.11 山葡萄苯丙氨酸解氨酶基因(PAL)的表达分析
2.11.1 采用改良CTAB法提取山葡萄 采用改良CTAB法[19]提取山葡萄8个不同着色时期的总RNA,如图9所示。依据核酸检测仪和凝胶成像仪检测RNA浓度和质量,保证RNA完整、无杂质污染,进行反转录。

图8 不同物种PAL类基因构建的分子进化树Fig.8 The molecular evolutionary tree of different PAL genes

图9 八个时期RNA电泳Fig.9 Agarose gel electrophoresis of 8 stage total RNA
2.11.2 实时荧光定量PCR标准曲线的制备 标准的熔解曲线是呈单一峰的,若有多个峰产生,说明有非特异性扩增产生。此次试验中,通过图10观察到,ACTIN、PAL对引物的溶解曲线呈单一峰,扩增特异性较高,获得的结果具有较高的可靠性。图11为ACTIN、PAL这2个基因的标准曲线。横坐标是初始模板量的对数,纵坐标代表Ct值。从图11可以看出,PAL基因的相关系数为0.999,接近1,说明定量结果可靠,所用引物及反应条件符合荧光定量PCR扩增的要求。
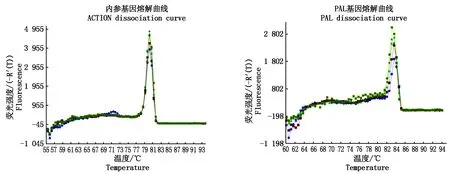
图10 ACTIN、PAL对引物的溶解曲线Fig.10 ACTIN, PAL on the primer dissociation curve
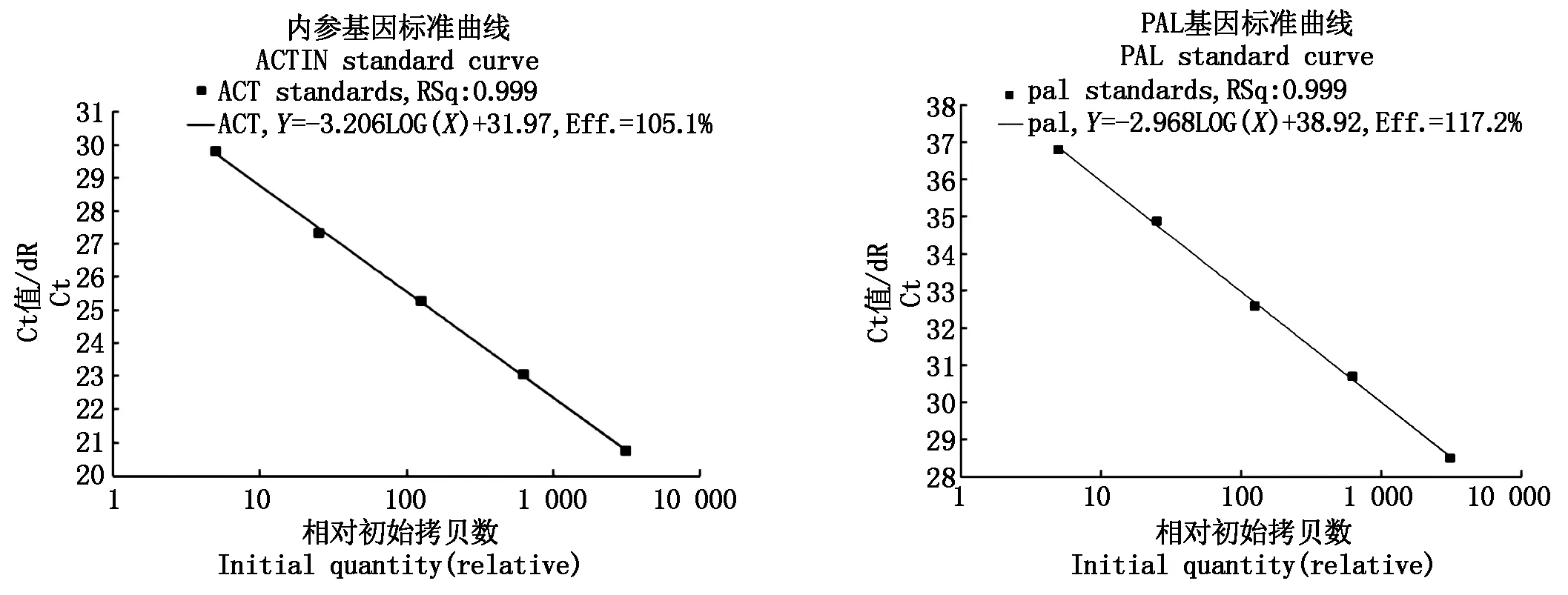
图11 ACTIN、PAL基因的标准曲线Fig.11 ACTIN, PAL genes of the standard curve
2.11.3VamPAL基因在葡萄果皮不同着色时期的表达水平分析 以内参基因ACTIN,选任一时期为对照,进行实时荧光定量PCR,探究VamPAL基因在葡萄生长发育过程中,果皮在8个时期的表达规律,结果如图12所示,纵坐标代表相对表达量,横坐标代表转色时期。VamPAL基因从转色前第Ⅱ个时期(花后28 d)到完熟期表达量逐次递减,转色50%和转色100%几乎不表达,VamPAL基因的表达量呈递减趋势。

图12 VamPAL基因在8个时期的表达规律Fig.12 VamPAL gene expression pattern in eight periods
3 结论与讨论
PAL 是催化苯丙烷类代谢的第1步反应酶,也是苯丙烷途径的关键酶,在植物发育过程、次生代谢以及果实着色等过程中起重要作用。PAL 基因主要存在于高等植物,微生物和某些藻类中,在动物体内尚未发现。随着研究工作的进行,研究人员陆续在大量植物中证实了PAL基因的存在,并且发现PAL 基因在大多数植物中是以多基因家族存在的。PAL 基因家族成员定位的组织具有差异性,其特异性受外源因子的诱导,调控的代谢途径各有差异[20-22]。本试验借鉴前人方法与经验[23],从山葡萄里克隆得到其 PAL 基因 DNA 全长序列,且命名为VamPAL。用生物信息学软件进行多序列比对分析,预测其蛋白的二级结构,结果显示,它由无规卷曲、α-螺旋、β-折叠构成,此结果与前人得出的葡萄、大豆等 PAL 蛋白二级结构结论相同,表明VamPAL和其他植物已分离 PAL基因有极高同源性,尤其是欧亚种葡萄,并具有相同蛋白质保守活性位点。
通过 PCR 技术,从山葡萄果皮里成功克隆到苯丙氨酸解氨酶基因全长序列。VamPAL基因全长 1 763 bp,属于苯丙氨酸解氨酶超基因家族,含有多个跨膜结构域,该基因编码的蛋白不具有信号肽,整体表现为亲水性,是稳定的亲水蛋白,其和欧亚种葡萄(GenBank登录号:ABM67591)、PAL类基因的同源性相近,相似性为 100%。
NCBI数据库登陆的葡萄PAL信息共有8个,其中,cDNA序列5个,DNA序列3个。根据葡萄品种来源,PAL序列来源及氨基酸序列相似性,选取PAL1(品种:Vitisvinifera;PAL序列来源:genomic DNA;核苷酸登录号:FM213198;氨基酸登录号:CAR82483)、PAL2(品种:Vitisvinifera;PAL序列来源:cDNA;核苷酸登录号:GU585850;氨基酸登录号:ADP07927)、PAL3(品种:Vitisvinifera;PAL序列来源:cDNA;核苷酸登录号:EF192469;氨基酸登录号:ABM67591)、PAL4(品种:Vitisvinifera;PAL序列来源:genomic DNA;核苷酸登录号:JN858963;氨基酸登录号:AEX32790)、PAL5(品种:Vitisvinifera;PAL序列来源:genomic DNA;核苷酸登录号:JN858957;氨基酸登录号:AEX32784)、PAL6(品种:Vitisvinifera;PAL序列来源:cDNA;核苷酸登录号:X75967;氨基酸登录号:CAA53581)、PAL7(品种:Vitisamurensis;PAL序列来源:cDNA;核苷酸登录号:GQ443745;氨基酸登录号:ACV60529)、PAL8(品种:Vitisamurensis;PAL序列来源:cDNA;核苷酸登录号:GQ443744;氨基酸登录号:ACV60528)以及梨PAL基因(GenBank登录号:FJ478149、FJ478150)、小麦PAL基因(GenBank登录号AY005474)、甜荞PAL基因(GenBank登录号:GU363529)、油松PAL基因(GenBank登录号:AF013485)和VamPAL进行分析,经Blast软件比对,结果显示PAL3、PAL4、PAL5、PAL6的同源性为99%,与梨PAL基因(GenBank登录号:FJ478149、FJ478150)同源性也比较高,可能是参与调控木质素合成等相关代谢的PAL酶[24]。PAL1、PAL2、PAL7与小麦PAL基因(GenBank登录号AY005474)亲缘关系较近,推测PAL基因在诱发水杨酸的形成上起到重要作用[25]。VamPAL与甜荞PAL基因(GenBank登录号:GU363529)亲缘关系较近,可能是参与调控黄酮类化合物合成的PAL酶[26]。而PAL8与催化形成反式肉桂酸的油松PAL基因(GenBank登录号:AF013485)亲缘关系较近[27]。PAL基因的表达调控受内部和外部调节[28],内部发育调节PAL酶的活性,在山葡萄生长发育前期呈一定规律变化。PAL基因在转色50%和转色100% 这2个时期几乎不表达,这可能受到某种抑制PAL酶活性因子在该时期表达量的影响,这一结论与李莉等[29]的研究观点基本一致,即PAL基因在苯丙氨酸代谢途径中果皮转色50%和转色100%这2个时期的表达量相对较少,可能受植物体内某种内源性抑制物质的影响,这种物质可能是某些氨基酸、反式肉桂酸等。李会宣等[30]对鸭梨PAL基因家族基因表达水平研究表明,PAL还参与了果期木质素的合成,且PAL基因在果实的发育过程中的表达存在明显差异。王敬文等[31]通过生物激素诱导甘薯块根,得出植物激素对PAL酶活性有刺激作用。
苯丙氨酸代谢途径是植物最重要的次生代谢途径之一,越来越多的研究者关注到苯丙氨酸代谢途径关键酶的研究。PAL基因的表达调控受很多因素调节,本次研究PAL基因在山葡萄果皮8个时期的表达规律,分析PAL基因在转色50%和转色100%几乎不表达的原因,可为探索山葡萄果皮转色阶段影响花色苷组成的关键酶的表达规律奠定基础。
