清醒时脉搏血氧饱和度正常的慢性阻塞性肺疾病患者夜间低氧血症的发生情况和S100B水平的变化
2019-01-04王才木陈启江张根生
王才木 陈启江 崔 巍 张根生
慢性阻塞性肺疾病(COPD)是一种以气流受限为特征的肺部疾病,气流受限不完全可逆,呈进行性发展。随着疾病的进展,可发生低氧血症,引起认知功能障碍等脑损伤,导致患者生活质量降低[1]。COPD患者夜间低氧血症较为常见,在清醒时脉搏血氧饱和度(SpO2)正常的患者中,存在SpO2<90%的睡眠时间占总睡眠时间30%以上者占38%~70%[2]。通常认为SpO2降低多发生在快速动眼睡眠(REM)时相,可能与该时相呼吸中枢对低氧和高二氧化碳的反应性下降、呼吸节律浅快不规则、肋间内肌活动下降,以及膈肌疲劳等因素有关,进而导致睡眠时潮气量减少、分钟通气量降低和动脉血氧分压(paO2)下降[3]。既往研究[4]发现,COPD患者的脑损伤可能与缺氧导致的脑神经元损伤有关。而进一步研究发现,缺氧并不是COPD患者引起脑损伤的直接相关因素[5-6],当发生低氧血症或SpO2下降时,脑血管反应性通过提高脑血流量来增加脑的供氧,进而预防脑缺氧和脑损伤的发生[7],但是睡眠时脑血管反应性调节会有所下降,在伴有夜间低氧血症的COPD患者中尤为常见。在非快速动眼睡眠(NREM)时相,上述变化同样存在,而对于COPD患者该时相低氧血症发生率的评估,以及这种低氧造成的后续脑损伤鲜有报道。有研究[8]发现,REM时相仅占夜间总睡眠时间的13%,剩余睡眠时间均为NREM时相,因此夜间低氧血症主要发生在NREM时相。由此可见,夜间低氧血症的发生和持续时间(特别是在NREM时相)对于COPD患者脑缺氧和脑损伤的影响尤为重要。
目前评估脑损伤的方法主要包括血清检测和脑电图检查,其中血清检测指标以神经元特异性烯醇化酶(NSE)和血清S100B蛋白多见[9]。NSE是判断神经元和神经胶质细胞受损的敏感指标,受体温影响大,在亚低温情况下其预测价值较低。S100B是钙结合蛋白,主要由星形胶质细胞产生,在急性和慢性脑损伤的情况下,S100B从活化的神经胶质细胞释放入血,在脑创伤、脑出血、缺血性脑卒中等多种脑损伤中有较高的敏感性和特异性,并能评估神经元的治疗效果,故S100B可作为评估神经元损伤的可靠指标[10]。
本研究旨在观察清醒时SpO2正常的COPD患者夜间低氧血症的发生情况,分析夜间低氧血症的发生对中枢神经系统损伤的影响,不同睡眠时相的低氧血症患者的血清S100B水平有无差异,以及在纠正低氧血症后患者血清S100B水平的变化,以便对此类COPD患者进行早期预警和及时干预。
1 对象与方法
1.1 研究对象 选择2014年1月—2016年1月期间宁海县第一医院急诊科收治的325例COPD患者。纳入标准:① 结合临床表现和病史明确诊断为COPD,入院诊断以COPD为主诊断,且符合COPD全球倡议(GOLD)分级的2和3级标准[2级为第1秒用力呼气容积(FEV1)50%~79%,3级为FEV1 30%~49%][11-12];② 清醒静息状态下paO2≥60 mmHg(1 mmHg=0.133 k Pa);③ 有完整的临床随访资料;④ 同意并签署知情同意书。排除标准:伴随有其他严重危及生命的疾病(如安装心脏起搏器、肺恶性肿瘤、心力衰竭、休克等)的患者;患抑郁症、癫 或合并严重创伤、脑肿瘤的患者;有睡眠呼吸暂停[睡眠呼吸暂停次数(AHI)>15次/h]的患者;入院前有过量饮酒史的患者;过去4周内有神经性或神经肌肉疾病的患者;CT检查存在脑卒中(如脑出血、脑梗死等)的患者;入院前已接受过COPD系统治疗的患者;未签署知情同意书的患者。剔除研究期间死亡、自动出院和中途退出的患者。排除清醒静息状态下paO2<60 mm Hg的患者151例,入院前曾接受系统治疗的患者25例,伴其他严重危及生命的疾病的患者15例,伴AHI>15次/h的患者31例,4周内有神经性或神经肌肉疾病的患者13例,GOLD分级为1或4级的患者22例,数据遗失4例,最终符合纳入标准的患者为64例,其中男39例、女25例,平均年龄为(65.9±9.0)岁。本研究符合医学伦理学标准,并经医院伦理委员会批准,所有纳入患者均获得本人或其家属知情同意。
1.2 方法
1.2.1 研究分组 记录所有入组患者的基础资料,在入院第1天静息状态下完成血气分析、肺功能检查和6 min步行试验,应用多导睡眠监测仪记录患者在不吸氧状态下睡眠时SpO2的分布情况。本研究中夜间低氧血症是指夜间SpO2<90%的时间占总睡眠时间的10%[13]。根据是否发生夜间低氧血症将患者分为正常组(23例)和低氧组(41例),其中低氧组再根据夜间低氧血症发生的睡眠时相分为快速动眼睡眠(REM)低氧亚组(20例,只在REM期发生夜间低氧血症)、非快速动眼睡眠(NREM)低氧亚组(13例,只在NREM期发生夜间低氧血症)和混合低氧亚组(8例,两个时相均发生夜间低氧血症)。
1.2.2 肺功能检查和6 min步行试验 患者入院时行肺功能检查,检查指标包括FEV1占用力肺活量百分比(FEV1/FVC)和FEV1占预计值的百分比(FEV1%),以及吸入支气管舒张药后的FEV1/FVC。6 min步行试验是指在室内沿着15 m走廊缓步行走,在整个测试期间用数字脉搏血氧仪监测SpO2[14],将6 min 步行试验测得的SpO2<90%的时间占总测试时间的百分比记为SpO2T6。
1.2.3 血气分析和血清S100B检测 患者分别于入院第1天和第2天6至7时在静息且不吸氧状态下抽取桡动脉血,使用血气分析仪(ABL 80,丹麦Radio meter Medical公司)进行结果分析,将夜间睡眠时SpO2<90%的时间占总睡眠时间的百分比记为SpO2<90%T。患者分别于入院第1天18至19时、第2天6至7时、第7天6至7时抽取静脉血,离心后收集血清,存储于-80℃冰箱,待标本收齐后,采用ELISA法测定血清S100B水平,按照试剂盒(上海美轩生物科技有限公司)说明书进行操作,该试剂盒最低检测质量浓度<1 pg/mL。
1.2.4 多导睡眠监测仪监测 为排除其他影响睡眠的因素,监测当日患者禁食咖啡、茶和烟酒等,且未处于镇静状态,应用便携式多导睡眠监测仪(Alice PDx,美国伟康公司)记录患者第1天22时(开始时间)至次日6时(结束时间)不吸氧时的睡眠状态。所有脑电图监测结果均进行人为核查和分析,主要监测指标包括睡眠时相所占比例、AHI、夜间SpO2水平和脑电觉醒指数(Arl)等。
NREM时相脑电觉醒:脑电图突然出现频率转换,持续时间至少3 s,且此前至少存在10 s稳定的任何期睡眠。REM时相脑电觉醒:脑电图突然出现频率转换,包括α、θ波和(或)>16 Hz持续时间至少3 s,且此前至少存在10 s稳定的任何期睡眠,同时存在至少持续1 s的骸肌电波幅增加。
1.2.5 氧疗 低氧组患者于入院第2天起每天22时至次日6时予鼻导管吸氧治疗,氧流量为2 L/min。
1.3 统计学处理 应用SPSS 16.0统计学软件。呈正态分布的计量资料以±s表示,组内比较采用单样本t检验,两组间比较采用独立样本t检验,两组以上的组间比较采用单因素方差分析;计数资料以频数(n)和百分率(%)表示,组间比较采用χ2检验。采用Pearson相关分析S100B水平与paO2的相关性。以P<0.05为差异有统计学意义。
2 结 果
2.1 低氧血症发生情况 在64例患者中,夜间低氧血症发生率为64.06%(41/64),其中48.78%(20/41)发生在 REM 时相,31.70%(13/41)发生在 NREM 时 相,19.51% (8/41)在 REM 和NREM两个时相均发生低氧血症。
2.2 正常组与低氧组间一般临床资料、肺功能检查和6 min步行试验结果比较 两组间的一般临床资料、发病时间,吸烟、既往治疗和各合并症患者的构成比,肺功能检查指标,以及SpO2T6的差异均无统计学意义(P值均>0.05),见表1。

表1 两组间一般临床资料、肺功能检查和6 min步行试验结果比较
2.3 正常组与低氧组间睡眠时间、血气分析和睡眠监测指标比较 低氧组患者的总睡眠时间显著短于正常组(P<0.001),第2天的paO2显著性低于正常组同时间和同组第1天(P值均<0.001),SpO2<90%T显著高于正常组(P<0.001)。两组间第1天的paO2、第1和2天的动脉血二氧化碳分压(paCO2),以及AHI和Arl的差异均无统计学意义(P值均>0.05)。见表2。

表2 两组间睡眠时间、血气分析和睡眠监测指标比较
2.4 夜间低氧血症和氧疗对COPD患者血清S100B水平的影响 入院第1天,低氧组血清S100B水平为(3 188.9±228.3)pg/mL,显著高于正常组同时间的(2 885.1±226.4)pg/mL(P<0.001);第2天,低氧组血清 S100B 水平为(3 497.7±319.5)pg/mL,显著高于正常组同时间的(2 909.0±257.9)pg/mL 和同组第1天(P值均<0.001);第7天,低氧组血清S100B水平为(2 966.0±180.3)pg/mL,显著低于同组第1和2天(P值均<0.001),但与正常组同时间[(2 895.7±206.8)pg/mL]的差异无统计学意义(P>0.05)。
进一步分析不同睡眠时期低氧血症对S100B水平的影响,结果显示,各低氧亚组间的一般临床资料、发病时间,吸烟、各合并症患者的构成比,肺功能检查指标,SpO2T6、总睡眠时间,paO2、SpO2<90%T,以及入院第1、2和7天的S100B水平的差异均无统计学意义(P值均>0.05),但各低氧亚组入院第2天的paO2和第7天的S100B水平均显著低于同亚组第1天(P值均<0.05),入院第2天的S100B水平均显著高于同亚组第1天(P值均<0.001)。见表3。
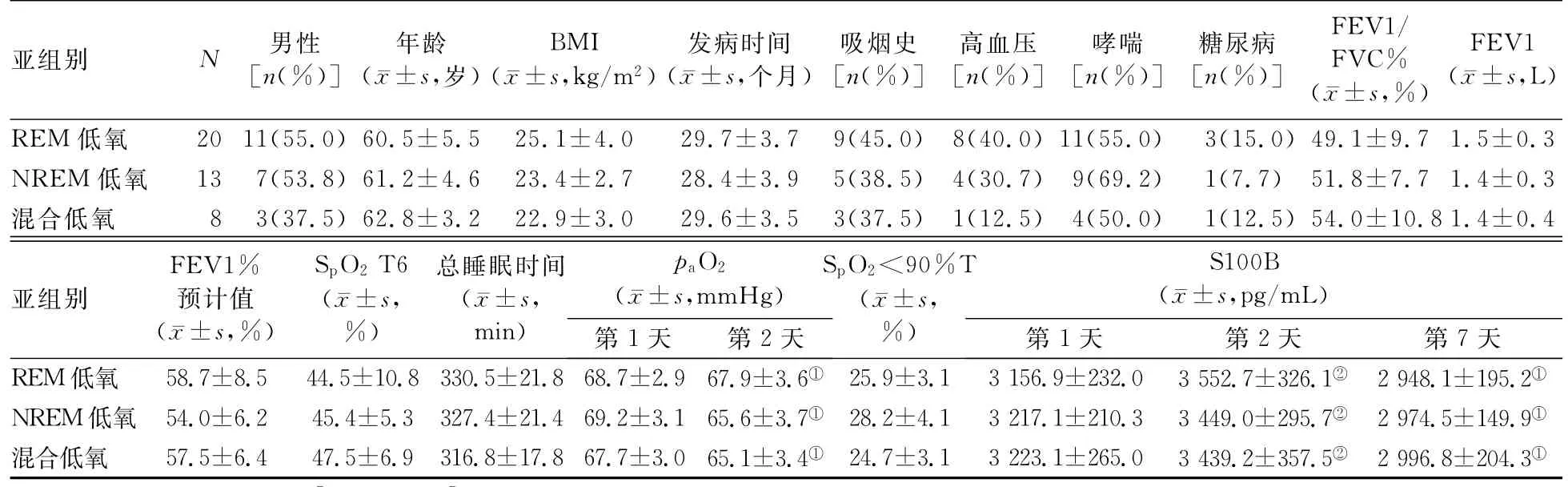
表3 各低氧亚组间一般临床资料和实验室检查指标比较
2.5 血清S100B水平与低氧血症的相关性Pearson相关分析结果显示,患者的血清S100B水平与paO2呈负相关(r=-0.626,P<0.001),而与夜间睡眠时SpO2<90%T呈正相关(r=0.700,P<0.001)。
3 讨 论
在COPD患者中,38%~70%的患者发生夜间SpO2降低;本研究中有>50%的COPD患者发生夜间SpO2降低,与既往研究[15]结果相似。其主要原因:睡眠状态下呼吸肌肌力下降,呼吸活动主要依赖膈肌,但COPD患者膈肌疲劳,收缩力下降,分钟通气量明显降低;上气道扩张肌力下降,上气道阻力增加;呼吸中枢对化学刺激的反应性下降;气道黏液分泌引起睡眠期间通气/血流比例失衡等[16-17]。
既往研究[18]发现,COPD患者在NREM时相动脉血氧饱和度(Sa O2)大幅度降低并不常见,除非清醒时血氧水平已经有所下降,且明显的氧合下降多与REM时相Sa O2降低有关。也有研究[19]发现,COPD患者在NREM时相和REM时相的SpO2均降低;REM时相通气量下降幅度达35.5%~39.0%,NREM时相通气量下降幅度为19%~21%。本研究结果显示,64.06%(41/64)的清醒时SpO2正常的COPD患者发生夜间低氧血症,其中48.78%(20/41)的低氧血症发生在REM 时相,31.71%(13/41)发生在 NREM 时相,19.51%(8/41)在两个时相均有发生。提示,清醒时SpO2正常而在NREM时相发生夜间低氧血症的COPD患者占较高比例。当SpO2降低时,通过脑血管氧反应性地将脑血流量增加至200%来预防脑缺氧[20-21],故本研究通过脑电图监测脑血管氧反应性,确保患者即使在低氧血症的情况下仍有足够的脑氧输送。有研究[22-23]发现,存在低氧血症的COPD患者在静息状态下的脑血流量显著高于非低氧血症的COPD患者,且前者在由运动引起的低氧期间脑血流量也同样增加;提示,脑血管氧反应性虽可代偿COPD患者的脑缺氧,但是缺乏脑血流量调节会导致脑血管氧反应性受损[24]。Meadows等[25]发现,若将在慢波睡眠期间发生的低氧血症患者的Sa O2降低5%~10%,其脑血流量减少;提示,如果睡眠期间(尤其是在NREM时相)患者的Sa O2降至正常值以下,此时脑血管氧反应性受损,更易导致神经元损伤。
S100B是神经胶质细胞中的特异性蛋白,在急性和慢性脑损伤的情况下,神经胶质细胞的完整性被破坏,导致其释放入细胞外液,并可在血液中被检测到。S100B水平与脑损伤程度有较好的相关性,对评估病情动态变化有较高的敏感性和特异性,可预测中度至重度脑损伤患者的预后,监测脑损伤患者二次损伤的发展和评估治疗效果,故其可作为轻度脑损伤患者的筛查指标和评估神经元损伤的生物标志物[10]。神经系统疾病如急性缺血性、创伤性脑损伤和慢性缺氧性脑损伤患者的血清S100B水平升高已被广泛认知[10]。有研究[26]根据血清S100B水平评估COPD患者的脑损伤,发现脑损伤程度与海马萎缩和认知功能受损有关。本研究结果显示,低氧组入院第1天的血清S100B水平显著高于正常组同时间,第2天的血清S100B水平显著高于正常组同时间和同组第1天,第7天的血清S100B水平显著低于同组第1和2天,但与正常组同时间的差异无统计学意义;各低氧亚组入院第1、2和7天的S100B水平的差异均无统计学意义,但入院第2天的S100B水平均显著高于同亚组第1天,而入院第7天的S100B水平显著低于同亚组第1天。提示,夜间低氧血症发生在NREM时相和REM时相时的S100B水平均较高,患者入院第2天血清S100B水平升高主要由夜间低氧血症所致。本研究在入院第2天每天22时开始至次日6时给予低氧患者2 L/min的氧流量吸氧治疗,至第7天低氧组患者血清S100B水平不仅显著低于同组第1和2天,且与正常组同时间的水平接近;提示,血清S100B水平可以随着低氧血症的纠正下降低,故对于有夜间低氧血症的COPD患者建议适当给予氧疗。
本研究相关性分析结果显示,患者的血清S100B水平与paO2呈负相关,而与夜间睡眠时SpO2<90%T呈正相关,与既往研究[6,8,20]结果一致,进一步验证S100B水平可作为COPD患者夜间低氧血症所致脑损伤的评价指标。同时,夜间SpO2<90%T作为夜间SpO2降低的评价指标,可被广泛应用于评估脑损伤的研究[6,8,20]中。
本研究尚存在一些缺陷。首先,对COPD患者夜间低氧血症的发生机制未作进一步研究,仅初步得出由于脑氧反应性调节功能失调使得脑组织缺氧而引起神经元损伤的结论。其次,脑CT和MRI检查很难对COPD患者是否存在脑损伤作出功能性诊断,且脑MRI检查很难在基层医院开展。尽管本研究采用的血清S100B水平可作为筛查或诊断COPD患者脑损伤的有效指标,但其检测为有创性,且其结果会受到其他因素的干扰。本研究排除了脑血管出血、脑梗死、脑肿瘤、酒精性中毒、抑郁症、癫、黑色素瘤等可能导致S100B水平升高的因素,但未能进行综合评估,若能动态观察S100B、NSE和脑电图监测的多项指标,则能更好地评估清醒时SpO2正常而夜间发生低氧血症的COPD患者对脑损伤的影响。
综上所述,清醒时SpO2正常的COPD患者夜间低氧血症发生率>50%,发生夜间低氧血症的COPD患者血清S100B水平显著升高,给予氧疗后下降。因此,血清S100B水平有望作为评估清醒时SpO2正常而夜间发生低氧血症的COPD患者脑损伤的有价值的标志物。
